
Osnovy_vzaimodejstviya_ultrazvuka_s_biologicheskimi_obektami
.pdfв относительно мягких условиях ультразвуковой обработки (0,05...0,5 Вт/см2; 0,88 МГц; 30 с) ускоряется процесс синтеза соединительно тканого белка в культуре фибробластов.
Представляет практический интерес возможность стимуляции синтеза и ряда других белков в клетках, в частности биосинтеза интерферона в индуцированных вирусом лейкоцитах.
Интерферон синтезируется в клетках организма и в культуре тканей в ответ на воздействие природных и искусственных индукторов - вирусов, эндотоксинов, внутриклеточных паразитов, высоко- и низко- молекулярных соединений. Помимо антивирусной активности, интерферон проявляет способность подавлять размножение быстроделящихся клеток, обладает иммуномодулирующим действием. Он эффективен как радиозащитное и антитоксическое средство.
Интерферон, будучи важнейшим неспецифическим фактором повышения резистентности, продуцируется почти сразу после попадания индуктора биосинтеза, например вируса, в организм, однако естественно образующегося интерферона часто оказывается недостаточно для предупреждения развития болезни. Воздействие ультразвуком те- рапевтических интенсивностей на область локализации патологического процесса, очевидно, приводит к стимуляции биосинтеза интерферона. Не исключено, что именно этот эффект лежит в основе ультразвуковой физиотерапии вирусных кератитов.
При ряде патологий весьма эффективно введение в организм экзогенного интерферона, полученного либо в результате химического синтеза, либо генно-инженерными методами, либо при его биосинтезе в культуре лейкоцитов, индуцированных вирусом.
Для получения наиболее качественного (лейкоцитарного) интерферона лейкомассу из свежей крови фракционируют, обрабатывают гомологичным интерфероном (проводят прайминг) и индуцируют биосинтез интерферона каким-либо вирусом, например вирусом Сендай или вирусом болезни Ньюкасла. После этого клетки помещают в специально подобранную среду и выдерживают при температуре 37 °С, постоянно перемешивая. Через 16...8 ч клетки отделяют и выделяют из среды интерферон, активность которого можно оценить по его способности защищать клетки в культурах тканей от цитопатического действия вируса.
Воздействие ультразвуком с частотой 880 кГц и интенсивностью 0,05...0,6 Вт/см2 в течение 130...300 с на суспензию лейкоцитов до прайминга или после него, во до вирусной индукции, не приводит к заметному изменению количества синтезированного интерферона. Ультразвук с интенсивностью, превышающей 0,6 Вт/см2, подавляет процесс биосинтеза.
Воздействие ультразвуком с интенсивностью от 0,01 до 0,05 Вт/см2 на лейкоциты после вирусной индукции практически не влияет ни па скорость биосинтеза интерферона, ни па жизнеспособность клеток, оцениваемых по их окрашиваемости красителем трипановым синим. После обработки ультразвуком с интенсивностью ОД Вт/см2 в суспензии обнаруживается около 10 % погибших клеток. Дальнейшее увеличение интенсивности ультразвука приводит к экспоненциальному росту числа нежизнеспособных (прокрашиваемых) клеток, а после обработки ультразвуком интенсивностью 0,7 Вт/см2 в суспензии остается 65 % жизнеспособных лейкоцитов (рис. 5.8).

Рис. 5.8. Снижение числа жизнеспособных клеток (лейкоцитов) в суспензии вод воздействием ультразвука
Существенное увеличение скорости гибели клеток при интенсивностях ультразвука, превышающих 0,7 Вт/см 2, обусловлено кавитацией, порог возникновения которой зависит от объемной концентраци и клеток в среде, в разбавленных суспензиях совпадает с поротом кавитации в воде (0,3 Вт/см2) и становится весьма значите льным, если объем частиц в суспензии превы шает 2 %, Согласно теоретическим оценкам и экспериментальным данным, порогу кавитации в суспензии лейкоц итов, содержащей 3 ·106 кл./см3, соответствует интенсивность ультразвука 0,6 Вт/см2.
Облучение ультразвуком суспензии лейкоцитов в течение 5 мин с интенсивностью от 0,05 до 0,6 Вт/см2 приводит к увеличению на 30% количества интерферона, синтезируемого жизнеспособными клетками. Дальнейшее увеличение интенсивности ультразвука обусловливает резкое сни жение количества синтезированного интерферона (в пересчете на жизнеспособные клетк и). Ультразвук, интенсивность которого п ревышала 1 Вт/см2, приводил к практически полному подавлению биосинтеза (рис. 5.9), хотя, как было указано выше, в этих условиях около половины исходного количества клеток в суспензии не прокрашивается трипановым синим, т. е. они являются, суда по этому, вполне жизнеспособными.
Рис. 5.9. Влияние ультразвука на количество интерферона, синтезированного лейкоцитами в суспензии (в расчете на количество жизнеспособных клеток)
Подавление биосинтеза интерферона в лейкоцитах при интенсивностях ультразвука, превышающих порог кавитации, очевидно, обусловлено процессами, сопровождающими кавитацию, например интенсивными микропотоками, возникающими как вне, так и внутри клеток. Эти микропотоки вызывают грубое нарушение внутриклеточной архитектоники, что приводит к подавлению биохимических реакций, в частности биосинтеза интерферона.
Факт увеличения количества интерферона, синтезируемого лейкоцитами в суспензии, не поддается однозначной интерпретации.
Увеличение интенсивности ультразвука в интервале от 0,1 до 0,6 Вт/см2 повышает скорость биосинтеза интерферона, но одновременно снижает число жизнеспособных клеток. Поэтому суммарный эффект невелик.
Обычно клетки, единожды использованные для синтеза интерферона, выбрасывают, гак как при повторном использовании они дают незначительное количество препарата. Однако после трехминутного ультразвукового воздействия на «отработанные» клетки наблюдается стимуляция повторного синтеза интерферона (табл. 5.2). Максимальный выход препарата может быть получен при интенсивности ультразвука 0,01...0,2 Вт/см2, Ультразвук с интенсивностью выше 0,7 Вт/см2 резко ингибирует повторный синтез интерферона.
Таблица 5.2
Зависимость выхода интерферона (по активности препарата в международных единицах) oт интенсивности ультразвукового воздействия на суспензии однократно использованных для биосинтеза лейкоцитов
Интенсивность ультразвука, Вт/см2 0 |
0,05 |
0,1 |
0,2 |
0,4 |
0,7 |
1,0 |
2,0 |
Титр (активность) интерферона, МЬ 150 |
1200 |
1200 |
1200 |
900 |
900 |
150 |
150 |
Применение ультразвука для стимуляции позволяет на 20...25 % увеличить выход продукта и делает практически целесообразным повторное использование лейкоцитов.
Полученный очищенный интерферон хранят либо к виде раствора, либо в виде лиофильно высушенного препарата. При длительном хранении активность интерферона медленно снижается, что обусловлено агрегацией его молекул. Попадая в организм, интерферон связывается со специфическими рецепторами клеточной поверхности. Отдельная молекула или агрегат как одно целое могут связаться лишь с одним рецептором. Поэтому агрегация приводит к снижению количества действующих единиц, что равносильно снижению активности препарата.
Ультразвуковая обработка растворов интерферона с интенсивностью 1,0... 1,5 Вт/см2 и течение 5...10 мин увеличивает антивирусную активность интерферона в 2-4 раза. Судя по результатам электрофореза препаратов интерферона в акриламидном геле, ультразвуковое воздействие приводит к снижению концентрации в растворе частиц с молекулярной массой 120-140 тыс. дальтон и увеличению частиц с молекулярной массой 60-70 тыс. дальтон и 30-35 тыс. дальтон, что соответствует димерам и мономерам интерферона.
Клинические испытания показали целесообразность ультразвуковой обработки интерферона перед использованием для лечения вирусных заболеваний.
5.6.3. Стимуляция роста клеток в культуре
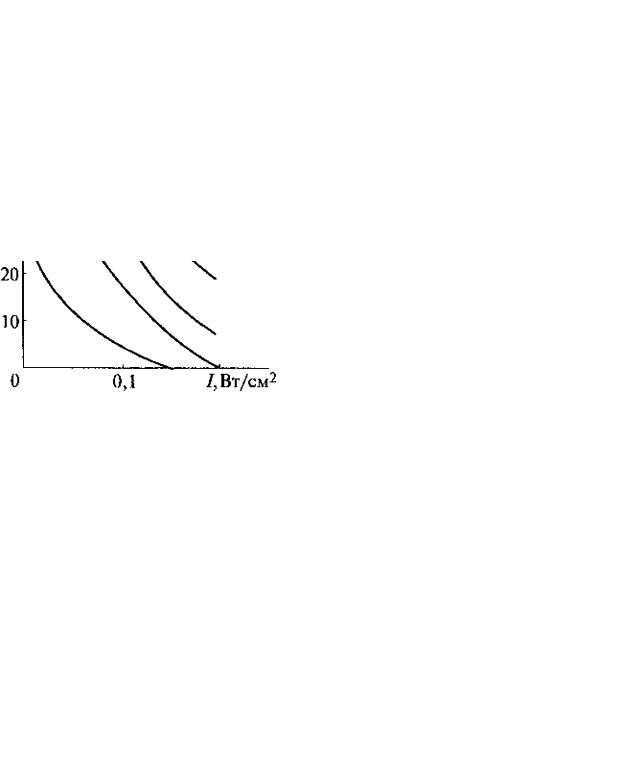
Воздействие ультразвуком с частотой 0,88 МГц и интенсивностью 0,02...0,08 Вт/см2 в течение 5…30 с способствует значительному приросту клеточной массы. Так, в контрольном опыте количество клеток перевиваемой культуры почки теленка через трое суток увеличивается с 8 · 104 кл./мл до 3,1 · 105 кл./мл. Индекс пролиферации при этом составляет 3,8. Если же исходный материал в течение 10 с обработать ультразвуком с интенсивностью 0,05 Вт/ см2 (0,88 МГц), то индекс пролиферации возрастает до 9,0, а концентрация клеток за трое суток увеличивается до 7,2 · 105 кл./мл.
Аналогичные результаты получены и на других культурах, в частности на культурах клеток почки хомячка. Э ффект стимуляции для различных культур качественно одинаков. Он зависит от интенсивности ультразвука и времени воздействия ( рис. 5.10).
Рис. 5.10. Зависимость прироста количества клеток и культуре (па третьи сутки) от времени и интенсивности ультразвуковой стимуляции клеток пере д их введением в
культуру: 1-5с, 2-10с,3- 30с, 4-35с, 5-45с
5.6.4. Предынкубацио нная обработка яиц ультразвуком и введение лекарственных веществ через неповрежденную скорлупу
Используя ультразвуковы е методы для предынкубационной обрабо тки яиц, можно получить ряд полезных для птицеводства эффектов,
Предынкубационная очи стка поверхности яиц в низкочастотных 2 2...44 кГц ультразвуковых ваннах длится 30...60 с. Качество белка при этом не меняется, а
уничтожение микрофлоры на скорлупе способствует увеличению выводимости цыплят. Следует, однако, отметить, что чрезмерное повышение мощности ультразвука, способствующее ускорению очистки и повышению ее качества, может привести к нарушению процесса развития эмбрионов, снижению выводимости, увеличению количества цыплят с врожденными уродствами.
Кратковременное воздействие высокочастотным ультразвуком (880 кГц) невысокой интенсивности на яйцо перед инкубацией приводит к увеличению выводимости цыплят
(табл. 5.3).
Таблица 5.3
Выводимость цыплят (в процентах) после воздействия высокочастотным ультразвуком на яйцо перед инкубацией в течение 10 с (300 яиц на каждый опыт)
Контрольный |
Выводимость цыплят, % при интенсивности ультразвука, |
|
|
|
образец |
Вт/см2 |
|
|
|
0,05 |
0,4 |
0,7 |
|
|
82±2 |
83±2 |
88± |
87±2 |
|
2 |
||||
|
|
|
Наилучшие результаты достигаются при интенсивности ультразвука 0,4 Вт/см2 и десятисекундной длительности обработки. Следует отметить, что, чем выше инкубационное качество яиц, тем меньше проявляется стимулирующее действие ультразвука. Очевидно, при низкой исходной выводимости значительным оказывается резерв роста и развития, который и реализуется при неспецифическом ультразвуковом воздействии.
В практическом птицеводстве для профилактики заболеваний и массовой гибели цыплят в инкубационное яйцо вводя т различные лекарственные вещества, в том числе антибиотики. Самый простой и распространенный способ введения антибиотиков - прокалывание скорлупы шприцем, последующее введение раствора в воздушную камеру и герметизация яйца. Этот способ позволяет легко дозировать лекарство, но требует строгой стерильности и практически не поддается автоматизации.
Известно, что ультразвук ускоряет транспорт многих веществ через мембраны и пористые перегородки и широко используется в медицине для введения лекарств в организм через неповрежденные покровные ткани, а также в промышленности для ускорения процессов пропитки ряда материалов.
Если на скорлупу нанести лекарственное вещество, например антибиотик ампициллин, или поместить яйцо в раствор этого антибиотика с концентрацией, в 10 раз превышающей концентрацию раствора, используемого для введения шприцем, то даже через десятки минут его содержание в яйце будет пренебрежимо мало. В этом легко убедиться по отсутствию лизиса - разрушения клеток в тест-культуре Sarcina lutea после добавления к ней содержимого яйца.
Если же опустить яйцо в этот же раствор антибиотика острым концом всего лишь на 1/5 но высоте и воздействовать ультразвуком, как это показано на рис. 5.11, то в содержимом яйца обнаруживается ампициллин.

Рис. 5.11. Фонофорез лекарственных веществ в яйцо:
1 - яйцо; 2 кювета; 3 - раствор лекарственного вещества; 4 - преобразователь ультразвука
Под влиянием ультразвук а (880 кГц) антибиотик активно транспортируется в яйцо через скорлупу и подскорлупну ю мембрану, накапливаясь в его содержимом в концентрации, сравнимой с концентраци ей, полученной при введении раствора в воздушную камеру шприцем через прокол в скорлупе (табл. 5.4)
Таблица 5.4
Оценка содержания ампициллина в содержимом яйца по величине зон лизиса клеток в культуре Sarcina lutea
Способ введения антибио тика |
Диаметр зон |
|
лизиса, мм |
||
|
||
Шприцем через прокол в скорлупе 0,2 мл раствора с концентрацией 5 |
12,0 |
|
·102 Ед./мл |
||
|
||
Нанесение на поверхность скорлупы раствора с концентрацией 5 · 103 |
Нет лизиса |
|
Ед./мл |
|
|
Введение ультразвуком сквозь скорлупу из раствора с концентраци ей 5 |
|
|
· 103 Ед./мл в течение 5 с при интенсивности (Вт/см2); |
2,4 |
|
|
||
0,2 |
16,5 |
|
|
||
0,6 |
17,0 |
|
|
||
1.0 |
Сплошной лизис |
|
|
||
1,5 |
|
Аналогичным способом н а 18-е сутки инкубации при переносе яиц в выводные шкафы в яйцо вводят вакцину, например, против болезни Марека, что позволяет избавиться от трудоемкой и малопроиз водительной операции введения вакцины внутримышечно каждому цыпленку всего поголовья молодняка.
5.6.5. Снижение уровня иммунологической специфичнос ти клеток
В последнее время все шире используется трансфузия отдельных компонентов крови - эритроцитарной, лейкоцитарной, тромбоцитарной массы, плазмы, альбумина, что позволяет при ряде патологических состояний достичь значительно большей терапевтической эффективности, чем при переливании цельной крови.
Следует, однако, отметить, что ветеринарная гемотрансфузиология сопряжена с определенными сложностями в связи с большим числом групп крови у животных. У коров, например, не менее 11-ти, у лошадей более девяти, у овец - семь, а у свиней обнаружено 14 групп крови. Встречаются животные, кровь которых не относится ни к од- ной из известных групп.
Групповая специфичность клеток крови обусловлена антигенными детерминантами, представляющими собой гликопротеиды и гликопротеидные комплексы, расположенные на наружной поверхности цитоплазматической мембраны. Эти детерминанты играют основную роль в иммунологическом распознавании «своих» и «чужих» клеток, а следовательно, и в трансплантационной совместимости тканей, в том числе крови и ее форменных элементов.
Иммунологическая несовместимость может быть снижена или преодолена, если частично или полостью удалить антигенные детерминанты с клеточной поверхности.
Обработка эритроцитов гликолитическими ферментами, отщепляющими полисахаридный остаток антигенных детерминант, весьма перспективна, но практически неосуществима в настоящее время в связи с отсутствием необходимых ферментов требуемой чистоты и специфичности. Возможна и химическая модификация группоспецифичных антигенов с целью их полной инактивации, но свойства полученных при этом эритроцитов остаются пока непредсказуемыми. Этих недостатков лишен ультразвуковой метод, позволяющий механически удалять группоспецифичные антигены с мембран эритроцитов и других клеток.
В поле ультразвука докавитационных интенсивностей возникают микропотоки, обеспечивающие «смывание» (десорбцию) с поверхности клеток молекул белков и других биополимеров, что подтверждается изменением энзиматической активности клеток, потерей ими связанных с мембранами антигенов, появлением в среде, в которой суспендированы клетки, заметных количеств гликопротеидов. Во избежание обратного связывания с мембранами «смытых» микропотоками макромолекул клетки после ультразвуковой обработки следует немедленно отделить от среды.
Выбор оптимального режима ультразвуковой обработки эритроцитов с целью снижения их антигенной активности при сохранении целостности клеток и их основных свойств требует учета целого ряда обстоятельств.
Энергия микропотоков и, следовательно, эффективность снижения антигенной активности эритроцитов увеличиваются с возрастанием интенсивности ультразвука (рис. 5.12), но при этом не должен быть превышен порог кавитации, разрушающей клетки в суспензии. Порог кавитации можно повысить, увеличивая концентрацию клеток, но это ведет к уменьшению расстояния между клетками, и «смытые» с их поверхности антигены после выключения ультразвука быстро сорбируются на поверхности близлежащих клеток. Эффективность ультразвуковой обработки зависит и от частоты ультразвука. При низких частотах понижается порог кавитации и увеличивается вероятность гемолиза, при частотах, превышающих 1МГц, повышается порог кавитации, но уменьшается эффективность десорбции антигенов.

Параллельно с процессом десорбции антигенных детерминантов с поверхности эритроцитов в ультразвук овом ноле протекает и обратный процесс - сорбция антигенов клетками, а ультразвук л ишь сдвигает равновесие в сторону десорбции. Поэтому только с помощью ультразвука не удастся полностью удалить антигенные детерминанты с поверхности клеток.
Максимальное и весьма существенное снижение антигенной активности эритроцитов в суспензии с концентрацией клеток 106...109 кл./мл обеспечивается ультразвуком с частотой 0,88 МГц, интен сивностью 0,4 Вт/см2 в импульсном режи ме. Длительность импульсов - 4 мке, частота следования - 50 Гц, время обработки - до 30 мин.
Рис. 5.12. Относительное изменение концентрации антигенов на поверхности эритроцитов в зависимости от плотности энергии ультразвука
Антигенные детерминанты разных групп крови по-разному связан ы с эритроцитами. Опыты, проведенные па крови человека, показали, что снижения а нтигенной активности эритроцитов на 97 % уда ется достичь у 15 % доноров группы В (III) и лишь у 4 % доноров группы А (II).
В отличие от химических методов модификации антигенной активности клеток ультразвуковой метод позволяет не только удалить антигенные детерминанты, но и пересаживать их па мембраны других клеток.
Так, антигенные детерминанты, «смытые» с поверхности эритроцитов ультразвуковыми микропотоками, отделен ные от эритроцитов центрифугированием и введенные в
суспензию предваритель но обработанных ультразвуком и отмытых эритроцитов других групп крови, сорбируются на этих эритроцитах, изменяя их иммун ологический статус. Очевидно, что аналогичная операция может быть проведена и с др угими клетками. Такая «пересадка» антигенов в настоящее время еще не практикуется, по весьма перспективна для преодоления реакций отторжения.
Ультразвук, в оптимальном режиме обеспечивающий десорбцию антигенов с клеточной поверхности, мало влияе т на другие функции клеток, Эритроциты, например, после удаления с их мембран ан тигенов не меняют своих размеров, не те ряют способности связывать и переносить кислород. Остается практически постоянн ым и заряд клеточных мембран, оцененный по электрофоретической подвижности клеток. Проницаемость мембран, но отношению к кислороду и ионам калия также не претерпевает заметных изменений. Более того, эх иноциты, образовавшиеся из эритроцито в при их выделении из донорской крови, после ультразвуковой обработки часто снова принимают дискоидную форму, характерную для интактных клеток. Однако ультразвуковая обработка не проходит бесследно для эритроцитов.
5.7. ПОЛУЧЕНИЕ КОРМОВЫХ ДОБАВОК С ПОМОЩЬЮ
УЛЬТРАЗВУКА
Некоторые отходы кожевенной промышленности содержат большое количество белка и после переработки могут успешно использоваться в качестве кормовой добавки. В кожевенных отходах содержится большое количество несовместимых с кормами веществ. Это кремнефтористые и сернистые соединения натрия, парадихлорбензол и ряд других веществ, включая соли хрома, используемые для консервирования кожевенного сырья и его дубления при переработке в кожу. Химические способы снижения содержания токсических веществ до допустимого уровня и разрушения прочных связей в структуре кожи требуют длительного времени, большого количества воды и различных химических соединений.
Процесс переработки кожевенного сырья примерно в 25 раз ускоряется в мощных низкочастотных ультразвуковых полях и занимает не 2-5 суток, а 2-3 часа. При такой обработке смесь отходов с растворами интенсивно перемешивается, ускоряется экстракция консервантов, разволокняется структура кожевенных отходов, что значительно повышает их перевариваемость, а значит, кормовую ценность.
Полученный эффект, очевидно, обусловлен интенсификацией пропитки кожевой ткани реагентами, ускорением химических реакций в ультразвуковом иоле (см. § 1.9), повышением скорости удаления из кожевой ткани продуктов реакции, а также механическим воздействием ударных волн и кавитационных микропотоков на структуру ткани. В результате такой обработки из отходов кожи практически полностью удаляются различные консерванты и дубители. Полученная таким способом сухая измельченная кормовая добавка содержит 70% белка и 17% жира. Содержание перевариваемого протеина составляет 420 т/кг.
Аналогичным способом можно готовить грубые корма из соломы. Обычно солому заливают на 8...14 ч раствором щелочи, что обеспечивает ее размягчение и насыщение влагой. Обработка измельченной соломы в растворе щелочи мощным низкочастотным ультразвуком в течение трех минут резко сокращает время приготовления корма, в 3-4 раза уменьшает расход щелочи, а также значительно повышает перевариваемость и питательность корма.
Успешно применяют ультразвук и для повышения эффективности производства рыбной кормовой муки. Обычно образующиеся в процессе прессования при производстве рыбной муки бульоны содержат значительное количество белков и липидов. Так, в бульоне, образовавшемся при переработке 30 т сырья, содержится около 1,5 т белка и 0,5 т жира. Этот подпрессовый бульон можно упарить, а образовавшийся концентрат использовать для обогащения кормовой муки. Однако соленые бульоны практически не пригодны для упаривания, так как при этом в конечный продукт попадает большое количество соли. Кроме того, метод уваривания весьма энергоемок. Для отделения белка и жира от жидкой среды можно использовать методы электрофлотации и электрокоагуляции, но оба эти метода требуют затраты большого количества энергии па единицу готовой продукции, в которую к тому же нередко попадает металл электродов в виде загрязняющих примесей. Этих недостатков лишен ультразвуковой метод коагуляции белков в подпрессовых бульонах. После десятиминутной обработки мощным низкочастотным ультразвуком в бульоне, выдерживаемом при 95°С, образуются хлопья, которые быстро осаждаются. Их легко отделяют с помощью сепаратора и высушивают одним их обычных способов. Применение ультразвука позволяет без существенных дополнительных затрат на 8...10 %
увеличить общий выход рыбной муки - ценной кормовой добавки в рацион сельскохозяйственных животных.
Следует отметить, что в рыбной муке обычно содержится значительное количество жира, который, окисляясь при хранении продукта, снижает его качество. Однако, если к жому после прессования добавить воду в соотношении 1:4, смесь в течение 10…15 мин обработать мощным ультразвуком с частотой 18...22 кГц, а затем вновь подвергнуть прессованию, то содержание жира в жоме и в конечном продукте снижается с 13 до 8%, что существенно повышает качество рыбной муки. Отделенный при этом рыбий жир также представляет собой ценную кормовую добавку.
В качестве эффективных добавок к корму, содержащих биологически активные вещества, нередко используют одноклеточные водоросли и кормовые дрожжи, выращенные па дешевом природном сырье: измельченных отходах древесины, тростнике, кукурузных кочерыжках, лузге подсолнечника, оболочках гречихи и проса, отходах сахарного производства.
Используют дрожжи в виде белково-витаминно-минеральных добавок в рационы крупного рогатого скота, сельскохозяйственной птицы, пушных зверей. Солому и другие малоценные корма подвергают дрожжеванию, добавляя с корм дрожжи и создавая условия для их развития. Питательность грубых кормов в результате их обогащения белком, витаминами, органическими кислотами и ферментами значительно повышается.
Достаточно длительный процесс дрожжевания можно существенно ускорить, стимулируя рост и развитие клеток ультразвуком, Ультразвуковое воздействие в течение нескольких минут повышает интенсивность брожения, улучшает качество готового продукта, снижает расход дрожжей. Разрушенные мощным ультразвуком клетки сами по себе являются хорошим стимулятором развития дрожжей. Этот эффект связывают с так называемым «мортальным фактором», возникающим при разрушении клеток, стимулирующим рост и развитие остальных, оставшихся целыми клеток. Основываясь на этих представлениях, для ускорения процессов дрожжевания четвертую часть исходной суспензии подвергают мощному ультразвуковому воздействию, приводящему к разрушению клеток, а затем смешивают полученный продукт с оставшимися тремя четвертями суспензии.
Ценным источником белка и биологически активных веществ, необходимых для рационального кормления, могут служить одноклеточные водоросли, например хлорелла. Однако гемицеллюлоза, составляющая их оболочку, плохо разрушается в желудочно- кишечном тракте сельскохозяйственных животных, что существенно снижает их кормовую ценность. Кратковременное воздействие ультразвуком неразрушающих интенсивностей (10 кГц; 2 кВт) на хлореллу в суспензии с объемной концентрацией клеток от 10 до 25 % стимулирует в последующие несколько часов синтез ими биогенных стимуляторов. Скорость синтеза увеличивается, если суспензию клеток после ульт- развуковой стимуляции выдерживать в темноте при температуре 3...7. После этого клетки в суспензии разрушают, используя мощный ультразвук или СВЧ-поле.
Полученная таким образом жидкая масса - «зеленое молоко» - может быть использована как в свежем, гак и в консервированном виде. Для длительного хранения массу сушат и включают в состав порошковых гранулированных концентратов или прессованных кормосмесей.
Скармливание «зеленого молока» молодняку сельскохозяйственных животных, в том числе и птице, резко снижает их падеж и в среднем на 17% увеличивает привесы.
