
Osnovy_vzaimodejstviya_ultrazvuka_s_biologicheskimi_obektami
.pdfБродильная активность дрожжей после обработки ультразвуком (425 кГц; 0,5.,.5 ч) увеличивается па 12...15 %, а количество клеток в облученной ультразвуком (0,8 МГц; 2,5 Вт/см2; 5 мин) суспензии быстро увеличивается.
Обработка ультразвуком (0,9 и 2,6 МГц; 0,5...1,2 Вт/см2; 10 мин) несколько снижает число жизнеспособных клеток костного мозга в суспензии. Однако уже после нескольких суток хранения при 40С в облученных ультразвуком образцах остается значительно больше жизнеспособных клеток, чем в контрольных образцах. Время разрушения половины клеток костного мозга в суспензии увеличивается после ультразвукового воздействия практически вдвое - с 5 до 9 дней, что позволяет при хранении уменьшить потери клеток, пригодных для трансплантации.
Увеличение интенсивности ультразвука до значений, превышающих 1...1.5 Вт/см2, приводит, как правило, к подавлению биологических функций клеток. Непрерывный ультразвук (1 и 2 МГц; 0,8...2,6 Вт/см2; 60 мин) подавляет скорость роста амниотических клеток в культуре, причем порог подавляющего действия лежит между 0,8 и 1,7 Вт/см2.
Между областями явного стимулирования и явного подавления лежит область, где наблюдается суперпозиция этих эффектов. Так, клеткам асинхронной культуры ткани китайского хомячка после ультразвуковой обработки (1 МГц; 2,5 Вт/см2 SPTA; 1 мин) предоставили возможность роста в монослое. В первые 24 ч роста не наблюдалось. Затем обнаружился рост, и к 35-му часу скорость роста нормализовалась. В данном случае остановка роста в первые 24 ч объясняется примерным равенством гибнущих и пролиферирующих клеток в среде.
Обычно клетки животных тканей в культуре хорошо переносят ультразвуковое облучение, если исключаются кавитация или нагрев. Выжившие клетки, как правило, способны к нормальному росту и развитию, хотя образованные ими колонии нередко не достигают размеров, характерных для колоний, возникших из необлученных ультра- звуком клеток.
3.3.3. Ультразвуковое воздействие на деление клеток
Временное ингибирование некоторых функций организма и отдаление периодов наибольшей активности важнейших из них является общей реакцией организма и отдельных его систем на внешнее повреждающее воздействие. Особенно часто этот феномен проявляется в задержке клеточного деления в некоторых тканях в ответ на повреждающие, активирующие или сигнальные воздействия. Действие ультразвука также временно уменьшает скорость деления клеток.
На клетках мерисистемы корней гороха показано, что непрерывный ультразвук (2 МГц; 0,5...20 Вт/см2; 1 мин), как и импульсный сходных параметров, вызывает уменьшение скорости роста корня, уменьшение митотического индекса, снижение скорости синтеза белка, ДНК и РНК. Интересно отметить, что, в основном, эффект возникает в первые секунды облучения, а затем лишь незначительно увеличивается.
Животные ткани более чувствительны к ультразвуку, и скорость деления клеток в них уменьшается при весьма малых интенсивностях ультразвука. Так, пятиминутное облучение ультразвуком интенсивностью 60 мВт/см2 (1 МГц) заметно снижает митотический индекс в тканях печени крыс. Облучение ультразвуком (2 МГц; 0,1 Вт/см2; 5 мин) клеток аденокарциномы Эрлиха приводит к торможению роста опухоли, возникшей при перевивании этих меток. Патогенность облученных ультразвуком клеток
карциномы имеет тенденцию к восстановлению и во втором пассаже мало отличается от контрольных образцов. Снижается скорость деления и при воздействии ультразвуком на клетки в культуре фибробластов человека.
Наиболее существенна задержка в скорости деления клеток культуры лейкомичных мышей при действии ультразвука (1 МГц; длительность импульса - 1 мс; частота следования импульсов 1 кГц; 5 Вт/см2) па «покоящуюся» клетку Задержка практически незаметна, если клетка находится в стадии митотического деления, хотя ее механическая прочность уменьшается, что, по-видимому обусловлено значительными изменениями в структуре клетки, предшествующими ее делению. Так, фибриллярная структура митотического веретена может разрушаться при воздействии ультразвуком относительно невысоких интенсивностей (0,8 МГц; 0,2.-0,5 Вт/см2).
В настоящее время есть очень мало данных, характеризующих чувствительность клеток к ультразвуку в разные фазы митотического цикла. Представляются бесспорными лишь факты задержки клеточного деления в интерфазе и меньшей чувствительности митотического индекса к ультразвуку в период митоза.
Задержка клеточного деления под влиянием различных воздействий относится не к патологическим проявлениям, а к физиологическим защитным реакциям, направленным на увеличение длительности интерфазы до значений, достаточных для репарации нарушений, накопившихся в клетке. Повреждения, не отрепарированные в интерфазе, могут во время митоза проявиться в виде серьезных дефектов, приводящих клетку к гибели.
В период митоза многие функции клетки весьма напряжены, что ослабляет работу репарационных механизмов. Поэтому задержка клеточного деления на стадии митоза не имеет биологического смысла. Внешнее воздействие именно в этот промежуток митотического цикла, возможно, приводит к хромосомным аберрациям и другим тяжелым для клетки последствиям.
3.3.4. Хромосомные аберрации, индуцируемые ультразвуком
Исследование мутагенного действия ультразвука стимулировалось, с одной стороны, опасением, что ультразвуковая терапия может иметь отрицательные последствия (так же в свое время было с радиоактивными методами лечения), а с другой - желанием получить новый способ направленного изменения наследственных признаков животных и растений. По-видимому, такой двойственный подход явился одной из причин большого разнообразия результатов, полученных разными исследователями. В числе других причин можно назвать широкий спектр параметров использованного разными исследователями ультразвука (интенсивностей, режимов и длительности облучения), различия в природе и состоянии исследуемых объектов. Не исключена также вероятность методических ошибок.
Результаты, полученные разными авторами, в первом приближении можно сравнить, сопоставляя дозы ультразвуковой энергии и возникающие при этом эффекты.
Обычно дозой называют величину D = It, где I - интенсивность ультразвука, t - время. Таким понятием дозы можно пользоваться лишь в случае, если эффект линейно зависит как от интенсивности ультразвука, так и от времени облучения, т. е. если снижение интен- сивности ультразвука можно скомпенсировать увеличением времени воздействия. Для ультразвуковых биоэффектов таким понятием можно пользоваться лишь в грубом

приближении. На оси, изображенной на рис. 3.1.1, обозначены доз ы ультразвуковой энергии. Над осью показа на область, где наблюдают эффекты, связанные с нарушением целостности хромосомных аберраций.
Рис. 3.11. Хромосомные а беррации при ультразвуковом воздействии (результаты анализа многочисленных данных, полученных рядом исследователей)
Область под осью характеризуется отсутствием влияния ультразвука на частоту хромосомных аберраций. Сравнивая дозы, мы, очевидно, не учитываем возможности того, что эффект может зависеть нелинейно от интенсивности ультразвука или времени облучения. Отчасти этим, а отчасти различиями в экспериментальных условиях и в природе исследуемых об ъектов может объясняться наложение обл астей, где одни исследователи обнаружили эффект хромосомных аберраций, а другие - нет.
Механизм возникновения аберраций в ультразвуковом поле неизвестен.
3.3.5. Комбинированное действие ультразвука и некоторых других физико- химических факторов на клетки
Широкое внедрение в кл инику комплексных методов лечения и ча сто встречающиеся сочетания ультразвука с другими физическими факторами и фармакологическими средствами потребовали специального изучения реакции организма в целом и клетки в частности на такие комби нированные воздействия.
Особый интерес представляет исследование последовательного и одновременного действия на клетки ионизирующего и ультразвукового излучений. Подобная совокупность воздействий нередко встр ечается в диагностике и в терапии и треб ует пристального внимания в связи с тем, что, по крайней мере, ионизирующие излу чения способны вызывать различные хро мосомные аберрация.
Так, при сравнении действия рентгеновского излучения (290 Р) и ультразвука (1 МГц; 1,1 Вт/см2; 1 мин; непрерывн ый режим) на клетки меристемы корешко в гороха было показано, что число микроядер в клетках увеличивается только в первом случае и никогда - во втором. Это лишний раз подтверждает мутагенную активность рентгеновского излучения и отсутствие этого свойства у ультразвука указанных параметров.
Не увеличивается число х ромосомных аберраций, индуцированных в клетках костного мозга мышей рентгеновс ким облучением (50 Р) после предварительной ультразвуковой (0,8 М Гц; 0,1 ..1 Вт/см2; 5 мин) обработки.
Несколько иная картина наблюдалась при исследовании реакции лимфоцитов на комбинированное ультразвуковое и рентгеновское (20, 50,100 Р) воздействие. Ультразвук (0,8 МГц; 3 Вт/см2; 10 ми н) существенно увеличивает число хромосомных нарушений, если цельная кровь, в которой находились лимфоциты, сначала под вергалась радио-
активному, а затем (через 5 мин) ультразвуковому воздействию. Если кровь сначала подвергалась действию ультразвука, а затем ионизирующего излучения, число хромосомных аберраций не увеличивалось. Ясли на клетки после рентгеновского облучения в течение часа действовать ультразвуком низкой интенсивности (2 МГц; 0,02 Вт/см2), число хромосомных нарушений заметно уменьшается по сравнению с кон- трольными образцами. Тот же ультразвук, использованный до рентгеновского облучения, заметно увеличивает (по сравнению с контрольным образцом) число нарушений в клеточных хромосомах.
Сообщается о высокой чувствительности к комбинированному воздействию и других клеточных характеристик. Обнаружен синергизм в действии ультразвука (1 МГц; 10 Вт/см2 SPTP; 5 мин) и ионизирующих излучений (600..1000 рад) на электрофоретическую подвижность раковых клеток. Ультразвук (0,9 МГц...0,14 Вт/см2; 10 мин) в 1,3 раза снижает дозу последующего облучения рентгеновскими лучами, необходимую для уничтожения 99 % клеток в культуре, способных образовывать колонии. Один лишь ультразвук не влияет на этот параметр. Пострадиационное облучение ультразвуком не меняет реакции клеток на рентгеновские лучи.
Зависимость реакции клетки па ультразвуковое воздействие от ее состояния наглядно проявляется в опытах с клетками, метаболизм которых целенаправленно изменен различными веществами или подбором внешних условий. Так, выживаемость клеток Не La повышается па 22 %, если их облучать ультразвуком (0,9 МГц; 0,2 Вт/см2; 3 с) в среде, содержащей 30...35 % версена. Защитными свойствами обладает и сывороточный компонент питательной среды, обеспечивающий нормальную работу защитных механизмов клетки. Он повышает па 80% выживаемость клеток Не La и предотвращает подавление роста культуры, облученной ультразвуком.
Комбинированное действие ультразвука с различными веществами удобно исследовать на клетках дрожжей.
Дрожжи - типичные сапрофиты, нашедшие широкое применение в пищевой промышленности и кормопроизводстве. Для своей жизнедеятельности они нуждаются лишь в кислороде, сахарах определенного типа и неорганических солях. Сахар служит источником энергии и основным исходным продуктом для синтеза белков, жиров, витами- нов и других жизненно важных органических веществ. Благодаря толстой клеточной стенке дрожжи весьма резистентны к ультразвуковому воздействию и остаются жизнеспособными при достаточно интенсивном и длительном ультразвуковом облучении. Именно поэтому они являются удобной моделью для изучения действия ультразвука на проницаемость клеточных мембран, а также на некоторые процессы жизнедеятельности.

Рис. З.12. Необратимое уменьшение фотоиндуцированного стечени я дрожжей а суспензии под влиянием H2S (конечная концентрация 10-2моль)
Реакция клеток дрожжей на ультразвуковое воздействие отражается на их фотоиндуцированной хем илюминесценции, связанной с активностью обменных процессов (рис. 3.12). При облучении ультразвуком с интенсивност ью 0,4 Вт/см2 практически все клетки в суспензии остаются жизнеспособными. У величение интенсивности ультразвука до 1 Вт/см2 приводит к гибели 10 % клеток.
Добавление в суспензию дицитрофенола, Na2S или Na3N, диффун дирующих в клетку сквозь цитоплазматические мембраны и подавляющих процессы д ыхания в митохондриях, приводит к уменьшению интенсивности фотоиндуцированного свечения. Подавление, в зависимости от концентрации ингибиторов дыхания, может быть как обратимым, так и необратимым.
Рис. 3.13. Последователь ное действие ультразвука и N2S на фотои ндуцированное свечение дрожжей в суспензии (стрелками указаны моменты вклю чения и выключения ультразвука)
Например, Na2S в концен трации 10-2 моль приводит к необратимому уменьшению интенсивности свечения. При концентрации 10-3 моль это вещество обратимо уменьшает интенсивность свечения, восстановление которой происходит в течение 30…40 мин.
Восстановление интенсивности свечения до исходною уровня, очевидно, обусловлено функционированием защитных механизмов клетки, соответствующим образом пе- рестраивающих ее метаболизм. Ультразвук низких интенсивностей (0,1...0,2 Вт/см2) стимулирует этот процесс в 1,5-2 раза, сокращая время восстановления.
Облучение клеток ультразвуком более высоких интенсивностей (0,4 Вт/см2) в суспензии, содержащей ингибиторы дыхания в малых концентрациях, приводит к значительному усилению их действия. При совместном или последовательном воздействии ингибитором дыхания Na2S и ультразвуком наблюдается необратимое, ступенчатое уменьшение интенсивности свечения, если время между последующими воздействиями не превышает нескольких минут (рис. 3.13). Увеличение этого интервала приводит к уменьшению эффекта синергизма, а когда интервал составляет 30...40 мин и более, эффект не наблюдается вовсе.
Аналогичные результаты получены при изучении совместного действия ультразвука с динитрофенолом и Na3N. Чувствительность клеток дрожжей в суспензии к ультразвуку существенно зависит от их состояния. Так, интенсивность свечения суспензии, содержащей 1 % глюкозы, понижалась в 4-6 раз при комбинированном действии Na2S (10-3 моль) и ультразвука (1 МГц; 1 Вт/см2; 10 мин). Эффект не наблюдался, если клетки находились в среде, не содержащей глюкозу.
Скорость связывания лимфоцитами 45Са++ вдвое повышается под действием ультразвука интенсивностью 0,05 Вт/см2 и продолжительностью 30 с. Накопление Са++ в лимфоцитах влияет на характер иммунного ответа лимфоцитов и, кроме того, является необходимым условием их активации. В частности, растительный митоген кон конканавалин также существенно ускоряет процесс накопления ионов Са++ в лимфоцитах. Действие конканавалина связывают с изменениями в структуре плазматических мембран, с интенсификацией обмена мембранных белков и жирных кислот в фосфолипидах, а также с образованием кальциевых каналов, пронизывающих мембрану.
Результат комбинированного действия конканавалина и ультразвука (0,88 МГц; 0,05 Вт/см2; 60 с) на лимфоциты вчетверо превосходит влияние одного только митогена (30 мкг/ мл) или только ультразвука.
Повышение проницаемости клеточных мембран для ряда веществ, очевидно, и объясняет увеличение эффективности лекарственных веществ под действием ультразвука.
Например, ультразвук (880 кГц; 0,4 Вт/см2) существенно увеличивает эффективность влияния нарост и интенсивность биолюминесценции светящихся бактерий цитотоксических лекарственных препаратов: цитостатина, циклофосфана и антибиотика широкого спектра действия дексорубицина, используемых для лечения злокачественных новообразований.
Кокаин и кураре в низких концентрациях проявляют защитные свойства при повреждающем действии ультразвука на ткани головастиков. Вещества, защищающие клетки от повреждающего ультразвукового воздействия, можно назвать сонопротекторами по аналогии с радиопротекторами, защищающими биологические объекты от ионизирующих излучений.
3.3.6. Разрушение клеток под действием ультразвука

Рис. 3.14. Гемолиз эритро цитов в поле микропотоков вблизи заостр енного излучателя ультразвука с частотой 2 0 кГц в зависимости от амплитуды колебаний инструмента
При ультразвуковой кавитации суспендированные в жидкости клетки испытывают значительные механичес кие усилия и разрушаются (см. §§ 1.13, 2.1 4). Особенно эффективен для разруше ния клеток низкочастотный ультразвук. Н апример, вблизи колеблющегося с частотой 20 кГц торца ультразвукового инструмента гемолиз наблюдается при амплит удах 16...20 мкм (рис. 3.14).
Регулируя условия ультразвукового воздействия - меняя частоту, мощность и время ультразвукового воздейст вия, а также состав среды, - можно получать конечный продукт с заданными свойствами. Так, дезинтеграция перевиваемой культуры клеток почки теленка, зараженной вирусом инфекционного ринотрахеита крупного рогатого скота, ультразвуком с частотой 22 кГц и амплитудой колебаний 40 мкм в течение трех м инут позволяет полу- чать частицы с повышенн ой способностью связывать антитела против упомянутого вируса. Эти частицы при годны для вакцинации и изготовления эфф ективных диагностикумов. Дезинтеграция тех же клеток ультразвуком с частотой 44 кГц дает возможность выделять пр еимущественно полноценные вирусные частицы, пригодные для заражения клеток культуры тканей с целью дальнейшей наработки материала для вакцин и диагностикумов. Варьируя параметры ультразвукового воздействия, можно получить частицы с различным соотношением инфекционной и антигенной а ктивности.
3.3.7. Механизмы биологического действия ультразвука
Поток молекул через кле точную мембрану описывается первым за коном Фика:

где D - коэффициент диффузии;
dc/dx - градиент концентр ации вещества.
В стационарных условия х dc/dx можно заменить отношением разн ости концентраций с11
– с1 к толщине мембраны :
где Р = D/l - коэффициен т проницаемости мембраны
Для молекул, диффундирующих сквозь нее, этот коэффициент определяется толщиной мембраны и коэффициентом диффузии.
В реальных условиях слои раствора, непосредственно прилегающие к мембране, практически не перемеш иваются, следовательно, концентрация ди ффундирующих молекул в данных слоях может существенно отличаться от концент рации аналогичных молекул в объеме. Толщина этих так называемых слоев Нернста меняется от единиц до сотен микрометров и зав исит от свойств поверхности и интенсивно сти перемешивания раствора. Совокупность собственно мембраны с диффузионными слоями можно рассматривать как эффективную мембрану толщину которой определяют но формуле:
где  и
и  толщины диффузионных слоев по обе стороны от мембраны.
толщины диффузионных слоев по обе стороны от мембраны.
Поток через мембрану описывается уравнением
Здесь  - обобщенный коэффициент диффузии с прилегающими слоями;
- обобщенный коэффициент диффузии с прилегающими слоями;
 - проницаемость;
- проницаемость;
 - концентрации молекул.
- концентрации молекул.
Под влиянием ультразвук а величины  и
и  существенно умен ьшаются в результате
существенно умен ьшаются в результате
интенсивною перемешивания раствора микропотоками. Соответств енно уменьшается  и возрастает поток веществ через мембрану
и возрастает поток веществ через мембрану
Коэффициент диффузии в среде и диффузионных слоях также может меняться под действием ультразвука, так как цитоплазма и прилегающая к поверхности клетки среда отличаются выраженной тиксотропией, и уже при интенсивности ультразвука 40 мВт/см2, используемой в диагностике, вязкость клеточного содержимого су щественно уменьшается, а температ ура среды несколько увеличивается за счет поглощения

ультразвуковой энергии (см. § 1.3). Возрастание температуры сред ы и уменьшение ее вязкости приведут к увеличению коэффициента диффузии в примембраниых слоях, что обусловит увеличение потока молекул неэлектролитов через мембр аны. Это может проиллюстрировать эффект ускорения транспорта Сахаров через мембраны эритроцитов под действием ультразвука с интенсивностью 0,1 Вт/см2 (см. §3.2).
Путем обычной диффузии через клеточные мембраны в клетку проникают самые разные соединения. Помимо воды это незаряженные молекулы многих растворимых в воде веществ, в том числе многих сложных лекарственных препаратов. В то же время трансмембранный транспорт ряда жизненно важных для клетки ве ществ осуществляется специальными, присутств ующими в мембранах клетки переносчиками, Такой транспорт но градиенту концентрации, не требующий затраты энергии, называют облегченной диффузией.
При облегченной диффузии, так же, как и в случае простой диффузии, ультразвуковые микропотоки, перемешивая среду, частично снимают диффузионн ые ограничения и ускоряют перенос веществ. Это подтверждается ускорением погло щения эритроцитами глюкозы из инкубационной среды при облучении суспензии клеток ультразвуком с интенсивностью 0,1Вт/см 2.
При активном транспорт е перенос молекул через мембрану осуществляется против градиента кoнценрации с затратой энергии. Действие ультразвуковых микропотоков снижает эффективность транспортировки веществ. В этом случае поток частиц, например ионов натрия, складывает ся из двух слагаемых:
где  - поток ионов Na+ за счет простой диффузии;
- поток ионов Na+ за счет простой диффузии;
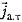 - поток ионов Na+, активно транспортируемых через мембрану.
- поток ионов Na+, активно транспортируемых через мембрану.
Очевидно, что  и
и  противоположно направлены и в стационарных условиях равны.
противоположно направлены и в стационарных условиях равны.
Под влиянием ультразвук а  увеличивается, а
увеличивается, а  в лучшем случае не изменяется. В результате нарушается равновесие ионов па мембране, изменяется се потенциал.
в лучшем случае не изменяется. В результате нарушается равновесие ионов па мембране, изменяется се потенциал.
В этих рассуждениях не у читывалось действие ультразвука на структуру самой мембраны. Между тем, ультразвуковые патоки способны «смывать» с поверхности мембран биомакромолекулы (см, § § 1.10 и 3.2). Это меняет условия экранировки зарядов на мембранах и влияет на их проницаемость и условия диффузии ион ов через мембраны.
Интенсивные микропото ки способны нарушать целостность клеточ ных мембран, через разрывы в которых частично или полностью вытекает содержимое клеток. Этот случай может рассматриваться как предельный случай изменения условий транспортировки веществ через клеточную мембрану при ультразвуковом воздействии.
При нагревании за счет перехода энергии ультразвука в теплоту разность температур между центром клетки и ее периферией при интенсивности ультра звука Вт/см2 по расчетам составляет 10-3 К, а градиент температур - 2...5 град/см. С ледовательно, в этих
условиях оказывается возможным изменение скоростей потоков веществ в результате термодиффузионного переноса как внутри клетки, гак и через клеточную мембрану.
Потенциал Дебая (вибропотенциал), возникающий в суспензиях клеток и тканях под влиянием ультразвука, используемого в терапевтической практике, достигает 10 мВ, т. с. величин, сравнимых со значениями потенциалов клеточных мембран.
При кавитации, когда интенсивность ультразвукового излучения превышает 0,3 Вг/см2, на клеточные мембраны наряду с ударными волнами, энергичными микропотоками и потенциалами Дебая, могут влиять свободные радикалы, азотная и азотистая кислоты, а также перекись водорода.
Таким образом, изменение проницаемости клеточных мембран - универсальная реакция на ультразвуковое воздействие, независимо от того, какой из факторов ультразвука, действующих на клетку, превалирует в том или ином случае.
Нарушение состава внутриклеточной среды и микроокружения клетки не может не отразиться на скорости биохимических реакций с участием ферментов, весьма чувствительных к содержанию в среде тех или иных ионов, продуктов ферментативных реакций и некоторых других веществ.
Суммируя, можно предложить следующий механизм действия ультразвука на клетки. Физико-химические ультразвуковые эффекты в среде (механические, тепловые, электрические, химические) —> нарушение микроокружения клеточных мембран (снижение градиентов концентраций различных веществ возле мембран, обратимая десорбция молекул с их поверхности, изменение мембранного потенциала, обратимое уменьшение вязкости внутриклеточной среды) —> изменение проницаемости клеточных мембран (ускорение диффузии, изменение эффективности активного транспорта, нарушение целостности мембран) —> нарушение состава внутри - и внеклеточной среды —> изменение скоростей ферментативных реакций в клетке (небольшая активация и преимущественное подавление ферментативных реакций в клетках вследствие изменения оптимальных для функционирования ферментов концентраций веществ) —> развитие репаративных реакций в клетке, связанных с синтезом других веществ (синтез РНК и новых ферментов, продуцируемых клеткой для компенсации возникшего недостатка в продуктах ферментативных реакций) —>...
Из анализа этой схемы - результата существенных упрощений - следует, что специфичным в действии ультразвука на биологические системы является изменение микроокружения клеточных мембран, приводящее к нарушению процессов переноса веществ через мембраны. Дальнейшая цепочка процессов может быть инициирована и другими физико-химическими факторами, приводящими к аналогичным нарушениям, в частности, к увеличению проницаемости клеточных мембран.
3.4. ДЕЙСТВИЕ УЛЬТРАЗВУКА НА МНОГОКЛЕТОЧНЫЕ
СИСТЕМЫ
Ткани, органы и весь организм - это не просто сумма клеток, но сложная, иерархически организованная система, в которой клетка является простейшей подсистемой, способной в определенных условиях к самостоятельному существованию.
