
Органика часть 2
.pdfМІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ ДЕРЖАВНИЙ ВИЩИЙ НАВЧАЛЬНИЙ ЗАКЛАД
«УКРАЇНСЬКИЙ ДЕРЖАВНИЙ ХІМІКО-ТЕХНОЛОГІЧНИЙ УНІВЕРСИТЕТ»
Спеціальність: всі спеціальності за напрямами: хімічна технологія та інженерія, фармація, біотехнологія, видавничо-поліграфічна справа, харчова технологія та інженерія
Факультет: |
заочний |
|
Курс: |
3 |
|
Семестр: |
V |
|
Навчальна дисципліна: |
Органічна хімія |
|
ТЕМАТИЧНИЙ МАТЕРІАЛ І ПИТАННЯ ДЛЯ ПІДГОТОВКИ
ДО ВИКОНАННЯ КОНТРОЛЬНОЇ РОБОТИ № 2
З ОРГАНІЧНОЇ ХІМІЇ
Викладач: доцент Охтіна О.В.
2011
ЕЛЕМЕНТОРГАНІЧНІ СПОЛУКИ
Елементоорганічними сполуками називають такі органічні сполуки, в молекулах яких крім С, Н, О, N, S і галогенів містяться інші елементи Періодичної системи, атоми яких безпосередньо сполучені з атомом карбону.
Елементоорганічні сполуки класифікують за природою елемента. У зв’язку з цим розрізняють Na, Mg, Al, Si, P – та інші елементоорганічні сполуки.
Назва елементоорганічних сполук складається з назви елемента і назви сполученого з ним вуглеводневого радикала, наприклад: - метил натрій, триетилалюміній і т.д.
Всі елементорганічні сполуки підрозділяються на два класи – металоорганічні сполуки (МОС), тобто сполуки, які мають безпосередній зв’язок карбону з металом, та елементоорганічні сполуки (ЕОС), тобто сполуки, які мають безпосередній зв’язок карбону з неметалами, іншими ніж О, N, S та галогени.
В залежності від електронегативності елементів зв’язок карбон-елемент може мати різний характери, причому електронна густина в залежності від відносної електронегативності атомів карбону та елементу може бути зміщена як до, так і від атому елементу. Так, в елементоорганічних сполуках (ЕОС) зв’язок карбон-елемент має ковалентний характер, тоді як в МОС зв’язок може бути трьох типів – дійсно іонний зв’язок (якщо його утворюють найбільш електронегативні метали, такі як Na, K), високо полярний зв’язок із значною часткою іонності (якщо його утворюють інші метали І, ІІ і, частково, ІІІ групи, які мають порівняно низьку електронегативність) та дійсно ковалентний полярний зв’язок (якщо його утворюють всі інші метали). Оскільки карбон більш електронегативний ні, ніж метали, то електронна густина в молекулах МОС завжди зміщена до атому карбону.
Слід пам’ятати, що реакційна здатність зв’язку карбон-метил зростає із зменшенням електронегативності металу, тобто із збільшенням полярності та іонности зв’язку.
Фізичні властивості МОС також залежать від типу зв’язку. Сполуки з іонним зв’язком (наприклад, С-Na) – це тверді солеподібні нелетючі сполуки. Сполуки з ковалентним зв’язком (С-Ме або С-Е: (С2Н5)4Pb або (СН3)4Si) – являють собою рідини або гази, які мають всі типові властивості органічних сполук.
Загальні методи одержання
1.Реакції елементів з галоген алканами (див. галогеналкани).
2.Реакції МОС з галогені дами більш електронегативних елементів:
3 Zn(CH3)2 + 2 BCl3  2B(CH3)3 + 3ZnCl2
2B(CH3)3 + 3ZnCl2
3. Реакції МОС з більш електронегативними металами:
Hg(C2H5)2 + 2 Na  2 C2H5Na + Hg
2 C2H5Na + Hg
4. Реакції МОС з більш сильними С-Н кислотами:
|
CH3MgBr + H3C |
|
|
|
|
C |
|
|
|
CH |
CH4 |
+ H3C |
|
C |
|
|
CMgBr |
|||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
2 CH3MgBr + |
HC |
|
|
CH |
|
2 CH4 |
+ BrMgC |
|
|
CMgBr |
|||||||||||
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|||||||||||||||||
Рушійною силою |
|
|
всіх |
реакцій є |
утворення більш типової іонної сполуки |
|||||||||||||||||
( |
ZnCl2 , C H Na , |
H C |
|
|
C |
|
CMgBr |
) та більш типової ковалентнозв’язаної органічної сполуки |
||||||||||||||
|
|
|
|
|||||||||||||||||||
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
||||||||||||||||||
2 |
5 |
3 |
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
( B(CH3)3, CH4 ) .

Як правил, всі МОС добувають у відсутності кисню та води.
Хімічні властивості МОС (загальні реакції)
Магнійорганічні сполуки
І. Розщеплення простих зв’язків
1. Реакції із сполуками, які мають активній (більш кислий) водень
(реакція Чугуєва-Черевітінова)
R MgCl + CH3OH  R H + CH3OMgCl
R H + CH3OMgCl
R |
|
MgCl + NH3 |
R |
|
H + NH2MgCl |
|
|
||||
|
R MgCl + H2O  R H + HO-MgCl
R H + HO-MgCl
2. Реакції з електронегативними елементами (О, S, Se, Te, VII-група)
2 CH3MgBr + O2  2CH3OMgBr H2O 2CH3OH + Mg(OH)Br CH3MgBr + Br2
2CH3OMgBr H2O 2CH3OH + Mg(OH)Br CH3MgBr + Br2  CH3Br + MgBr2
CH3Br + MgBr2
3. Реакції з галогеналкілами
CH3MgBr + CH3Br  CH3-CH3 + MgBr2
CH3-CH3 + MgBr2
ІІ. Приєднання по подвійним зв’язкам
1. Приєднання по карбонільній групі – утворення спиртів
CH -CO-CH |
|
|
+ C H |
MgBr |
(CH ) C H COMgBr |
|
H2O |
(CH ) C H COH + Mg(OH)Br |
|
|||||||||||||||||||||||||||||||||||||
3 |
|
|
|
|||||||||||||||||||||||||||||||||||||||||||
3 |
|
|
|
|
|
|
2 |
5 |
|
3 2 |
2 |
5 |
|
|
|
|
|
|
|
H2O |
3 2 |
2 |
5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
CH CH=O |
|
+ |
|
C H |
MgBr |
C2H5HCCH3(OMgBr) |
CH3 |
CHC2H5 |
+ Mg(OH)Br |
|
||||||||||||||||||||||||||||||||||||
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||
3 |
|
|
|
|
|
|
|
|
2 |
5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H2O |
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH =O |
+ |
|
C H |
MgBr |
|
C H CH OMgBr |
|
C H CH -OH + Mg(OH)Br |
|
|||||||||||||||||||||||||||||||||||||
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||
2 |
|
|
|
|
|
2 |
5 |
|
2 5 |
2 |
|
|
|
|
|
|
|
|
2 5 |
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
CH3 + CH3MgBr |
|
|
|
|
|
|
OMgBr |
|
CH3MgBr |
|
|
|
OMgBr |
|
|
|
|
|
|
|
|
||||||||||||||||
C2H5 |
C |
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 + CH3OMgBr |
|
|||||||||||||||||||||
|
|
|
|
|
C2H5 |
C |
|
O |
|
|
CH3 |
|
|
|
|
C2H5 |
|
C |
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
2. Взаємодія з двоокисом вуглецю – утворення кислот |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||
CH3NgBr + CO2 |
CH3CO2MgBr HBr CH3CO2H + MgBr2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||
3. Взаємодія з нітрилами – утворення кетонів |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
H2O |
CH3 |
|
|
|
|
|
|
|
|
|
|
H2O |
H3C |
|
|
C |
|
C2H5 |
+ NH3 |
||||||
CH3MgBr + C2H5C |
|
N |
|
C2H5 |
C |
|
N |
|
MgBr |
C H |
C |
|
NH + Mg(OH)Br |
|
|
|
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Кремнійорганічні сполуки
Енергія зв’язку Si-Si менша від енергії зв’язку С-С на 125 кДж/моль, тоді як енергія зв’язку С-О менша від енергії зв’язку SiO на 92,1 кДж/моль. Тому для кремнійорганічних сполук характерні не зв’язки Si-Si, а зв’язки Si-О-Si:
1. Алкілхлорсилани, алкілсилани.
SiCl4
Si
+
+
|
|
CH3MgCl |
CH MgCl |
CH3MgCl |
(CH3)4Si |
|
|
|
3 |
(CH3)3SiCl - MgCl2 |
|||
CH3MgCl |
- MgCl2 |
CH3SiCl3 |
- MgCl2 |
(CH3)2SiCl2 - MgCl |
||
|
|
2 |
|
|
||
2CH3Cl  (CH3)2SiCl2
(CH3)2SiCl2
2. Силаноли, силоксани, силікони.
|
(CH3)3SiCl + H2O + NH3 |
(CH3)3SiOH + NH4Cl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
(CH ) SiOH |
(CH3)3SiOSiC(CH3)3 + H2O |
|
|
|
|
|
|
CH3 |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|||||||
|
3 3 |
|
[(CH3)2Si(OH)2] + 2 HCl |
|
|
|
|
|
|
|
|
|
+ nH2O |
|||
|
|
|
|
|
|
|
|
|
|
|||||||
|
(CH3)2SiCl2 +2 H2O |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
O |
|
Si |
|
O |
|
|
|
|||||
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
CH3 |
|
|
n |
|||||
|
|
|
|
|
|
|
|
|
|
|||||||
Фосфорорганічні сполуки
1. Фосфіни:
2 CH3I + 2 PH3. HI + ZnO  2 CH3PH2 + ZnI2 + H2O
2 CH3PH2 + ZnI2 + H2O
|
2 CH3I + |
PH3. HI + ZnO |
|
(CH3)2PH + ZnI2 + H2O |
||||||||
|
3 CH3MgBr + PCl3 |
|
|
|
(CH3)3P + 3 MgClBr |
|||||||
2. |
Окиснення: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
||
|
CH3PH2 |
"O" |
H3C |
|
|
|
P(OH)2 |
|
|
|
||
|
"O" |
|
|
|
метилфосфонова кислота |
|||||||
|
|
|||||||||||
|
(CH ) PH |
(CH ) P(O)OH диметилфосфонова кислота |
||||||||||
|
3 2 |
|
|
3 2 |
|
|
|
|
||||
|
(CH3)3P |
"O" |
(CH3)3P |
O |
триметилфосфіноксид |
|||||||
|
|
|||||||||||
3. |
Перегрупування Арбузова: |
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
+ |
|
|
|
- |
|
|
|
OC2H5 |
|
|
|
|
|
|
|
|
|
||||
|
|
|
(C2H5O)3PCH3 |
|
|
I |
|
C2H5I + H3C |
|
|||
(C2H5O)3P + CH3I |
|
|
|
|
|
P |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
OC2H5 |
|
|
|
|
|
|
|
|
|
диметиловий ефір метилфосфонової кислоти |
|||
|
|
|
Свинецьорганічні сполуки |
|||||||||
|
4 C2H5Cl + 4 PbNa |
|
|
|
(C2H5)4Pb + 4 NaCl |
|||||||
|
4 C2H5MgCl +2 PbCl2 |
|
|
|
(C2H5)4Pb + 4MgCl2 + Pb |
|||||||
ГАЛОГЕНПОХІДНІ ВУГЛЕВОДНІВ
Галогенпохідними називають сполуки, які містять зв’язки карбон-галоген. Поділяють на
|
|
|
Аліфатичні |
|
|
|
|
|
|
Ароматичні |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Галоген в |
|||
|
|
|
|
|
Ненасичені |
|
Галоген в ядрі |
боковому |
||||||||||
Насичені |
|
|
|
|
|
|
|
|
|
|
|
|
ланцюзі |
|||||
|
|
|
|
|
|
|
|
|
|
Cl |
|
CH2Cl |
||||||
H3C |
|
CH2CH2Cl |
H2C |
|
CHCl H2C |
|
CH |
|
CH2Cl |
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
||||||||||
алкілгалогеніди |
Вінілта алілгалогеніди |
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
||||||||||
В свою чергу любий із типів галогенпохідних може мати 1, 2 і більше атомів галогену, тобто підрозділяють на моно-, ді-, три- і взагалі полігалогенпохідні. Галгенами можуть бути атоми F, Cl, Br, I.
Методи добування моногалогенпохідних І. Галогенпохідні алканів.
1.Галогенування алканів(див. тему “Алкани”).
2.Приєднання галогеноводнів до алкенів (див. тему “Алкени”).
3.Заміщення гідроксильної групи (-ОН) в молекулах спиртів на галоген: a. Взаємодія спиртів з галогеноводнями:
CH3OH + HCl  CH3Cl + H2O
CH3Cl + H2O
H2SO4
CH3CH2OH + HBr  CH3CH2Br + H2O
CH3CH2Br + H2O
b. Взаємодія спиртів з галоїдними сполуками фосфору:
3 CH3CH2OH+PCl3 |
3 CH3CH2Cl+H3PO3 |
CH3CH2OH+PCl5  CH3CH2Cl+POCl3+HCl
CH3CH2Cl+POCl3+HCl
c. Взаємодія спиртів з хлористим тіонілом (SOCl2):
CH3CH2OH + SOCl2  CH3CH2Cl+SO2 + HCl
CH3CH2Cl+SO2 + HCl
4. Обмін галогенів
Ацетон
CH3CH2Cl+NaI  CH3CH2I+NaCl
CH3CH2I+NaCl
ІІ. Галогенпохідні алкенів.
А. З атомами галогенів у подвійного зв’язку – вінілгалогеніди.
1.Приєднання галогенів до ацетиленових сполук (Дивись - Ацетилени)
2.Відщеплення галогеноводнів від гемінальних та віцинальних дигалогенідів
Спирт
ClCH2CH2Cl+NaOH  CH2
CH2  CHCl+NaCl+H2O
CHCl+NaCl+H2O
Б. Алілгалогеніди.
1.Алільне галогенування алкенів (Дивись - Алкени)
2.Приєднання галогеноводнів до супряжених дієнів (Дивись - Дієни)
ІІІ. Галогенування бокового ланцюга алкілароматичних вуглеводнів.
|
CH3 |
|
500 |
CH Сl |
Cl2 |
|
CHСl2 |
CСl3 |
|
|
2 |
|
|
Cl2 |
|||
|
+ |
Cl |
2 -HCl |
|
-HCl |
|
|
|
|
|
|
|
|
-HCl |
|||
|
|
|
хлористий бензил |
хлористий бензилїден бензотрихлорид |
||||
Механізм: |
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
Cl2 |
2 Cl |
|
|
|
|
|
|
|
|
CH3 |
|
CH2* |
* |
CH |
2 |
CH2 |
CH2 |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
Cl + |
|
HCl+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
* |
* |
|
|
|
|
|
|
|
|
|
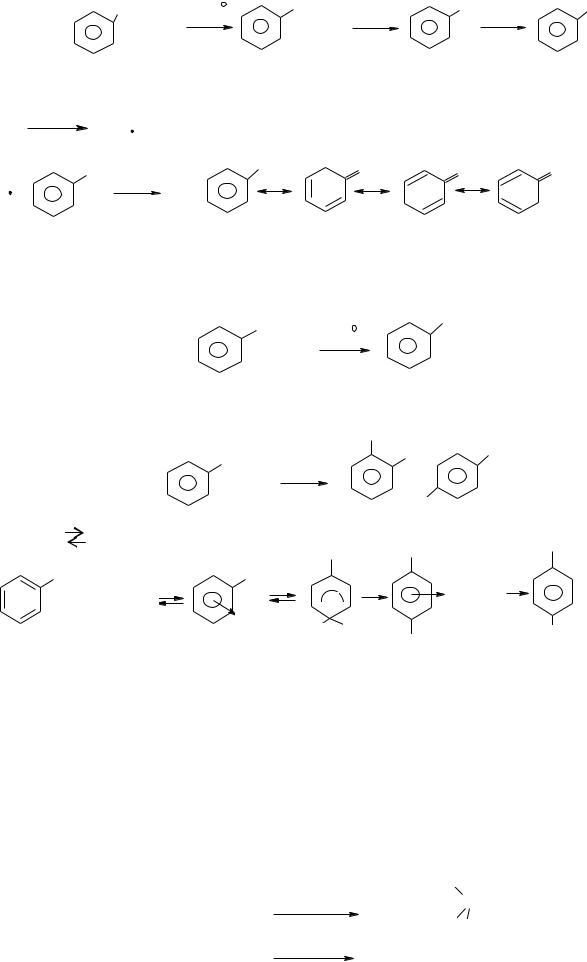
Оскільки бензильний радикал стійкіший за інші можливі за рахунок ефективної делокалізації неспареного електрону з-за супряження з ароматичним кільцем, галогенування любих алкілбензолів завжди проходить лише по α-атому вуглецю бокового ланцюга:
|
|
|
CH2CH3 500 |
CHCl-CH3 |
|
|
|
|||
|
|
|
+ |
HCl |
|
|
|
|||
|
|
|
+ |
Cl2 |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
||
ІV. Галогенування ароматичних сполук в ядро. |
|
|
|
|
|
|||||
Проходить лише каталітично: |
|
|
|
|
|
|
||||
|
|
|
|
|
CH3 |
|
CH3 |
|
|
|
|
|
|
CH3 |
AlCl3 |
|
Cl |
|
|
|
|
|
|
|
|
|
|
HCl |
|
|
||
|
|
|
+ Cl2 |
|
|
+ |
+ |
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cl |
|
|
|
|
AlCl3+Cl2 |
Al+[AlCl4]- |
|
|
|
CH3 |
|
CH3 |
|
|
|
|
|
|
|
CH |
3 |
|
|
|
||
|
|
|
CH3 |
|
|
|
|
|
|
|
CH3 |
|
|
|
|
+ |
- |
+ |
|
- |
|
+ |
|
- |
|
|
|
|||||
|
|
|
|
H AlCl 4 |
+ H [AlCl |
|
] |
|||
|
|
|
+ |
|
|
|||||
+ |
Cl [AlCl |
4 |
] |
|
4 |
|||||
|
|
Cl |
|
|
|
|
|
|
|
|
|
|
|
Cl |
|
|
|
|
|
|
|
|
|
|
|
H |
Cl |
Cl |
|
Cl |
|
|
|
|
|
|
|
|
|
|
|
|
|
Хімічні властивості
Галогенопохідні – це один з найбільш реакційно здатних класів органічних сполук. Для них найбільш характерні реакції нуклеофільного заміщення (SN) та відщеплення (Е).
І. Реакції нуклеофільного заміщення.
Нуклеофіли – це багаті електронами реагенти, які мають основні властивості. Всі нуклеофіли мають щонайменше одну неподілену пару електронів і характеризуються поняттям нуклеофільність, як основи – основність. Нуклеофільність – це здатність нуклеофільної пари нуклеофілу взаємодіяти з атомом карбону, тоді як основність – це здатність електронної пари основи взаємодіяти з протоном:
|
|
|
|
|
н |
о |
о |
|
|
|
|
|
|
||
|
Нуклеофільність |
|
: |
|
C-Cl |
||
|
|
NH3 |
+ |
|
|
||
|
|
|
|
||||
: |
|
|
н н |
|
|||
NH3 |
|
Основність |
|
: |
+ Н + |
|
|
|
|
NH |
|
|
|
||
|
|
3 |
|
|
|
||
|
|
|
|
|
|
|
|

Як правило, нуклеофільність і основність змінюються паралельно, тобто із зростанням основності збільшується нуклеофільність і навпаки. Однак, ці поняття не тотожні і не пропорційні.
При нуклеофільному заміщенні нуклеофіл атакує молекулу, віддаючи для утворення нового зв’язку свою пару електронів. Електрони старого зв’язку, що розривається, С-Наl відходять разом з атомом галогену у вигляді аніона. Оскільки іон галогену – дуже слабка основа (і слабкий нуклеофіл) він легко заміщується будь-якими більш сильними нуклеофілами. Іон галогену є хорошою заміщаючою групою.
У загальному вигляді нуклеофільне заміщення можно забразити такою схемою:
Z :+R: X Z :R + X: , наприклад:
Z :R + X: , наприклад:
CH3Cl+OH -  Сl - + CH3OH (спирт)
Сl - + CH3OH (спирт)
- |
|
- |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
(ефір) |
|||
CH3Cl+OCH3 |
Сl |
+ CH3OCH3 |
|||||||||
CH3Cl+H2O |
|
HCl + CH3OH |
(спирт) |
||||||||
CH3Cl+CN - |
- |
|
|
|
(нітрил) |
|
|||||
Сl |
+ CH3CN |
|
|||||||||
|
|
CH- |
|
|
- |
|
|
|
|
|
(алкін) |
CH3Cl+C |
|
|
Сl |
+ CH3C |
|
|
CH |
||||
|
|
|
|
||||||||
|
|
|
|
||||||||
|
|
|
|
||||||||
- |
|
- |
|
|
|
|
|
|
|
||
CH3Cl+ RCO2 |
Сl |
+ |
CH OOCR (складний ефір) |
||||||||
|
|
|
|
|
|
3 |
|
|
|
|
|
- |
|
- |
|
|
|
|
|
|
|
|
|
CH3Cl+ SH |
Сl |
+ CH3SH (меркаптан) |
|||||||||
- |
|
- |
|
|
|
|
|
|
|
||
CH Cl+SR |
Сl |
+ |
CH SR (тіоефір) |
||||||||
3 |
|
|
|
|
3 |
|
|
|
|
|
|
CH3Cl+ NH3 |
Н Сl + CH3NH2 |
(амін) |
|||||||||
-
CH3Cl+NO2  Сl + CH3NO2 (нітосполука)
Сl + CH3NO2 (нітосполука)
В аліфатичних галогенпохідних, а також в алілта бензилгалогенпохідних реакції відбуваються за механізмом SN1 та SN2.
Механізм SN2 (заміщення нуклеофільне другого порядку), в якому на лімітуючій стадії реакцій (найменш швидкій стадії, яка визначає швидкість реакції беруть участь два реагенти, тобто )
V=k[Nu][CH3 Cl]
NaOH+CH3Cl  CH3OH+NaCl
CH3OH+NaCl
Механізм:
+-
NaOH  Na+OH
Na+OH
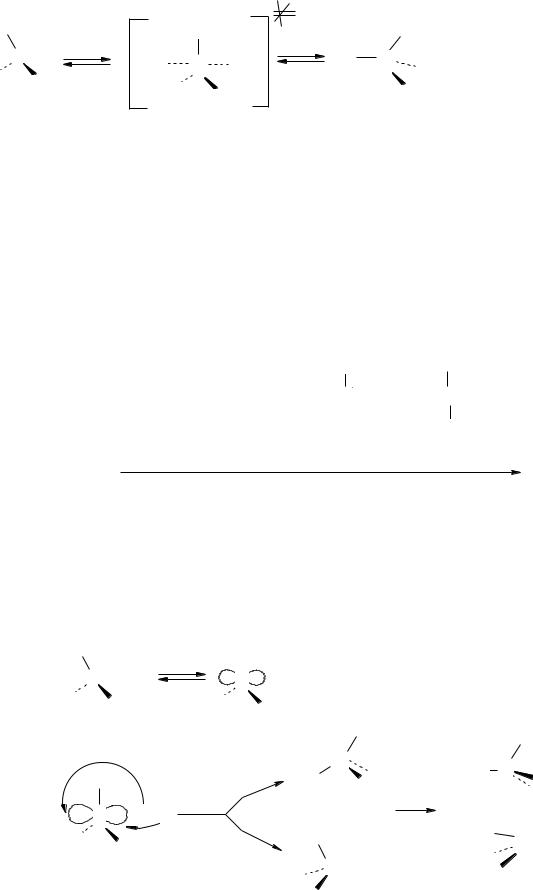
|
H |
|
|
|
H |
|
|
H |
|
|
|
|
|
|
|
|
- |
||
|
|
повільно |
- |
|
- |
|
|
|
|
HO+ C-Cl |
|
HO |
C |
|
+Cl |
||||
|
|
|
|
||||||
|
HO C Cl |
|
|||||||
|
|
|
|||||||
|
|
|
|
|
H |
||||
H |
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
H |
|
|
|
H |
|
|
|
|
|
|
H |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
Для SN2 реакцій характерні такі ознаки:
1.Швидкість реакції залежить від концентрації обох реагентів;
2.Реакції супроводжуються, як правило, інверсією конфігурації атому карбону, тобто конфігурація атому карбону в процесі реакції змінюється на протилежну – відбувається Вальденівське обертання конфігурації;
3.Оскільки в реакціях SN2 атака нуклеофілу відбувається зі сторони, протилежної зв’язку С-Hal, швидкість реакції в основному залежить від просторового (стеричного) фрагменту – із збільшенням просторових утруднень атаці нуклеофілу швидкість реакції зменшується:
CH3- X > перв. > C-X > втор. С-Х > трет.С-Х
Cl |
CH3 |
CH3- Cl > CH3-CH2Cl > CH3- CH - CH3 > CH3-C-CH3
Cl
швидкість зменшується
4. При SN2 реакціях, як правило, відсутні перегрупування.
ІІ. Механізм SN1 (заміщення нуклеофільне мономолекулярне),
в якому на лімітуючій стадії приймає участь лише один реагент – галоїдний алкіл, тобто
V=k[R-Hal]:
(CH3)3CCl+H2O  (CH3)3COH+HCl
(CH3)3COH+HCl
CH3 |
CH3 |
||
|
|
|
|
повільно |
|
|
- |
|
|||
C-Cl |
|
C |
+Cl |
|
|
|
|
|
|
|
H3C H C |
|
H C |
H3C |
|
|
|
|
|
|
|
|
3 |
|
3 |
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
A |
|
|
+ |
|
|
|
|
|
|
|
|
|
|
C |
|
|
|
|
|
|
CH3 |
|
|
H2O |
H3C |
|
HO |
C |
|
||
|
|
|
|
CH3 |
||||||
|
|
|
|
|
|
|||||
|
|
. . |
швидко |
|
|
H3C |
-H |
+ |
|
CH |
|
|
|
|
|
|
|
3 |
|||
|
|
|
|
|
|
|
|
|
|
|
C |
+ |
+H O : |
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
H3C |
|
+ |
|
|
B |
|
CH3 |
|
|
|
|
||
H3C |
|
|
|
|
|
|
|
C-OH2 |
||
H3C |
|
|
|
+ |
|
H3C |
|
|||
|
|
|
|
H C |
C-OH2 |
|
H C |
|
|
|
|
|
|
|
3 |
|
|
|
3 |
|
|
H3C
Перша стадія реакції – дисоціація – є лімітуючою стадією. Розрив зв’язку С-Hal відбувається за рахунок енергії сольватації галоген алкану розчинником. Друга стадія відбувається миттєво.
Особливості реакцій SN1:
1.Швидкість реакції залежить лише від концентрації галогену.
2.Реакції, як правило, супроводжуються повною рацемізацією оптично активних сполук, тобто із сполук з визначеною конфігурацією з рівною вірогідністю утворюються сполуки з протилежними конфігураціями. Це відбувається тому, що плоский проміжний карбокатіон з однаковою вірогідністю може атакуватися нуклеофілом з обох сторін.
3.Оскільки в реакціях SN1 на швидкість лімітуючої стадії утворюється карбокатіон, швидкість реакції перед усім залежить від відносної стійкості карбокатіону, тобто від електронних факторів: чим стійкіший утворений карбокатіон, тим більша швидкість реакції. Тому швидкість реакції за механізмом SN1 зменшується в такому ряду:
PhCH2Cl > |
CH =CH-CH Cl |
> |
(CH ) CCl > CH -CHCl-CH |
3 |
> CH -CH -Cl > CH Cl |
|||
2 |
2 |
3 3 |
3 |
3 2 |
3 |
|||
бензил |
|
аліл |
|
трет. |
втор. |
|
перв. |
|
швидкість зменшується
4. Оскільки реакції SN1 відбуваються через проміжне утворення карбокатіону, вони як правило, супроводжуються перегрупуванням:
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
S N2 |
|
|
|
|
|
|
|
|
|
CH3-C-CH2OC2H5+NaBr |
||||||
|
|
|
C2H5ONa |
||||||
CH3 |
|
|
|
|
|
|
|
||
|
|
CH3 |
|
|
|
||||
|
|
|
|
|
|
|
|||
CH3-C-CH2Br |
|
|
|
|
|
||||
|
|
CH3 |
CH |
|
|||||
|
|
|
|||||||
|
|
|
|
|
|||||
CH3 |
|
S N1 |
3 |
||||||
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
 CH3-C-CH2CH3+CH3-C
CH3-C-CH2CH3+CH3-C  CH-CH3+HBr C2H5OH
CH-CH3+HBr C2H5OH
OC2H5
ІІІ. Порівняння реакцій SN1 та SN2.
Нуклеофільне заміщення SN1 супроводжується рацемізацією та перегрупуванням, а реакційна здатність зменшується від третинних до первинних галагенопохідних. Для SN2 реакцій характерне повне обертання конфігурації, відсутність перегрупування, а реакційна здатність зменшується від первинних до третинних галагенопохідних. Оскільки порядок зміщення реакційної здатності в реакціях SN1 та SN2 різна, кожна з них зустрічається в чистому вигляді дуже рідко, в дійсності спостерігається комбінація обох реакцій з більшою або меншою часткою кожної з них. Тому для галогеналканів типовим є присутність мінімуму в реакційній здатності:
CH |
X > перв > втор < трет |
< аліл |
< бензил |
||||
3 |
|
|
|
|
|
|
|
S N2 |
S |
+ |
S |
S N2 |
S N1 |
SN1 |
|
S N2 |
N1 |
N2 |
|||||
Відзначимо загальні фактори, які впливають на механізм, по якому відбуваються реакції нуклеофільного заміщення.
1.Будова галогеналканів: із збільшенням числа замісників у атома карбону, який
несе атом галогену, полегшується реакція за механізмом SN1 та утруднюється реакція за механізмом SN2.
2.Природа залишаючої групи (нуклеофугу). В ряду FclBrI швидкість реакції за обома механізмами зростає, що обумовлено більш легкою іонізацією зв’язку С-Hal з-
за зростання його довжини (полегшується реакція за механізмом SN1) та зменшується енергія розпушуючої орбіталі σ*С-Hal (полегшується реакція за механізмом SN2).
3.Концентрація нуклеофільного реагенту: із збільшенням концентрації нуклеофілу полегшується реакція за механізмом SN2 та утруднюється реакція за механізмом SN1.
4.Сила нуклеофільного реагенту: збільшення нуклеофільності реагену сприяє механізму SN2 та протидіє механізму SN1:
5.Природа розчинника. Протонні розчинники сприяють реакціям за механізмом SN1
,так як краще соль ватують залишаючи групу (нуклеофуг) і уповільнюють реакції за
механізмом SN2, так як зменшують нуклеофільнітьь нуклеофілу за рахунок його сольватації. Апротонні розчинники сприяють реакції за механізмом SN2, так як менше соль ватують нуклеофіли. Але в цілому, полярні розчинники прискорюють реакції SN1
,так як перехідний стан цієї реакції більш полярний, ніж вихідний і тому за рахунок сольватації більш стабілізується перехідний стан менш молярний ніж вихідний, вихідний стан більше соль ватується полярними розчинниками і вони відповідно уповільнюють реакції SN2.
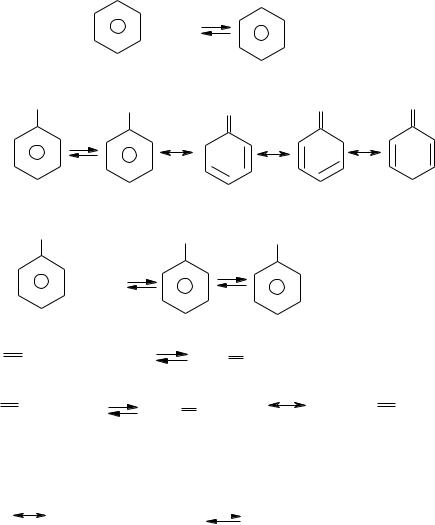
ІV. Причини підвищеної реакційної здатності алілта бензилгалогенідів в реакціях SN.
Хлористий аліл та хлористий бензил дуже легко вступають в реакції нуклеофільного заміщення за механізмом SN1 із-за високої стійкості проміжних карб катіонів внаслідок ефективного де локалізації позитивного заряду:
CH2Cl |
CH OH |
||
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ H |
O |
|
|
+ HCl |
|
||
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
CH2Cl |
|
CH2 |
+ |
|
|
CH |
|
|
CH |
CH |
|
|
|
|
|
|
|
|
|
|
2 |
2 |
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
+ |
+ Cl - |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
+ |
|
|
CH OH + |
|
|
|
|
|||
|
|
CH |
|
|
|
CH OH |
|
|||||
|
|
2 |
|
|
|
|
2 |
2 |
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
|
+ H |
2 |
O |
|
|
|
|
|
|
+ H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH2 |
CH-CH2Cl + H O |
|
CH2 |
CH-CH2OH+HCl |
|
|||||||
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
+ |
- |
|
|
|
|
|
|
|
|
|
|
|
||
CH |
2 |
CH-CH Cl |
|
CH |
2 |
|
CH-CH |
2 |
CH -CH |
CH2 + Cl |
||
|
2 |
|
|
|
|
|
|
2 |
|
|||
Для алілгалогенідів характерине алільне перегрупування. Так як спряжений алільний катіон здатний приєднувати нуклеофіл за обома атомами карбону, які несуть позитивний заряд:
|
|
|
|
+ |
+ |
|
|
|
|
|
|
|
|
|
|
|
|
+H + |
CH |
|
|
CH-CH |
CH -CH |
|
CH |
|
+ H O |
|
CH |
|
|
CH-CH OH+HOCH -CH |
|
CH |
|||
2 |
|
2 |
|
2 |
2 |
|
||||||||||||
|
|
|
|
|
||||||||||||||
|
|
|
2 |
|
|
2 |
|
|
2 |
2 |
2 |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
