
Органика часть 2
.pdf
V. Причини інертності атому галогену в вінілгалогенідах та неактивованих арилгалогенідах.
|
|
|
|
|
|
|
|
|
- |
|
|
|
|
+ |
|
|
|
|
||
|
CH2 |
|
CH-Cl |
CH2-CH |
|
|
Cl |
|||||||||||||
|
|
|
|
|||||||||||||||||
|
|
|
|
|||||||||||||||||
|
|
|||||||||||||||||||
Cl |
|
|
+ Cl |
|
|
+ Cl |
|
|
+ Cl |
|||||||||||
|
|
|
- |
|
|
|
|
|
|
|
|
|
|
- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
-
На відміну від розглянутих вище алілта бензилгалогенідах в присутності атому галогену безпосередньо при атомі карбону подвійного зв’язку в вінілта неактивованих арилгалогенідах спряження неподіленої пари електронів атому галогену з сусіднім π- зв’язком вінілгалогенідів та π-системою неактивованих арилгалогенідів, яке приводить до відповідного скорочення зв’язку С-Hal, зв’язок набуває частково подвійний характер та стає більш міцним:
|
|
|
|
|
|
|
|
|
- |
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH2 |
|
|
CH-Cl |
CH2-CH |
|
Cl |
|||||||||||||
|
|
|
|||||||||||||||||
|
|
|
|||||||||||||||||
|
|
|
|
|
+ Cl |
|
+ Cl |
|
+ Cl |
||||||||||
Cl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
- |
|
|
|
|
|
|
|
|
|
|
- |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
-
В результаті вінілгалогеніди не вступають в реакції нуклеофільного заміщення, а лише в реакції відщеплення; неактивовані арилгалогеніди вступають в реакції псевдо заміщення за механізмом відщеплення-приєднання
Сполука |
|
|
|
|
|
|
|
|
|
Cl |
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|||||||
CH3-CH2-Cl |
CH2 |
CHCl |
|||||||||
|
|
|
|
|
|
||||||
l, C-Cl, нм |
0,169 |
0,169 |
|
0,177 |
|
|
|
||||
μ, D |
1,73 |
1,44 |
|
|
2,05 |
|
|
|
|||
VI. Механізм відщеплення – приєднання в неактивованих арилгалогенідах.
До неактивованих арилгалогенідів відносять арилгалогеніди, які не мають з амісників в бензольному ядрі, які мають електронодонорні замісники (замісники І роду), а також частково арилгалогеніди, які мають електроноакцепторні замісники, які знаходяться в м- положеннях відносно атому галогену.
Реакції неактивованих арилгалогенідів відбуваються в дуже жорстких умовах:
Cl |
Cl |
Cl |
OCH
 3 SO3 Na
3 SO3 Na

|
Cl |
|
ONa |
|
|
300 |
|
1. |
+ 2 NaOH |
+NaCl+H2O |
|
|
Cl |
|
NH2 |
|
|
300 |
|
2. |
+2 NH |
3 |
+NH4Cl |
|
|
|
|
|
|
200 атм |
|
Першою стадією реакції є атака такої основи, як водний розчин лугу або амід натрію, найбільш “кислого” атому гідрогену в бензольному кільці, який знаходиться в о- положенні відносно атому галогену.
|
- |
- |
+ |
Cl |
Cl |
H+ |
|
|
H |
- |
|
|
- |
|
|
+ OH |
+ H2O |
Утворений аніон внаслідок взаємодії вільної пари аніонного центру на атомі карбону з розпушуючою орбіта ллю сусіднього зв’язку С-Hal () викидає аніон хлору з утворенням надзвичайно реакційно здатного дегідробензолу.
-
Cl
- |
- |
+ Cl
Дегідробензол має ароматичний характер, але, водночас, і потрійний зв’язок. При цьому, одна пара електронів потрійного зв’язку входить до π-електронного секстету бензольного кільця, а інша пара електронів утворює “π- зв’язок” , який розташований в площині бензольного кільця. Цей зв’язок надзвичайно реакційноздатний внаслідок слабкого перекривання двох sp2-гібридизованих електронних орбіта лей і легко вступає в реакції нуклеофільного приєднання (третю стадію реакції):
+
NH3 |
NH2 |
|
+ H2O |
- |
|
Місце входження нуклеофілу в похідних дегідробензолу, а також, і в заміщенних неактивованих арилгалогенідах визначається електронними факторами, які діють в похідних дегідробензолу, а не місцем знаходження атому галогену:
|
|
|
- |
OH2+ |
OH |
|
|
|
|
|
|
Cl |
Cl |
- |
|
- |
|
|
|
|
|
|
|
|
- |
H2O |
OCH3 |
OCH |
|
+ NaOH |
|
|
3 |
||
|
|
|
|
||
-Cl - - |
|
+ OH2 |
|
|
|
-H O, -Na + |
- |
OH |
|
||
2 |
|
|
|
|
|
OCH3 |
OCH3 |
OCH3 |
|
- |
|
|
|
|
OCH3 |
OCH |
3 |
|
|
|
|
|

Слід пам’ятати, що вплив атому галогену не реакційну здатність неактивованих арилгалогенідів обернений його впливу на реакційну здатність алкілгалгенідів. Так, якщо реакційна здатність алкілгалогенідів зменшується в ряд, то в арилгалогенідах вона зменшується в протилежному напрямку: , що пов’язано з електроноакцепторними властивостями атомів галогену. Наприклад, атом F більш електроноакцепторний від атому Cl, тому в першому випадку ми маємо більш “кислий”, а відповідно, і більш рухливий атом гідрогену в о-положенні по відношенню до атому F.
VII. Активовані арилгалгеніди. Механізм SNAr.
Активовані арилгалогеніди – це арилгалогеніди, які мають в о- або п- положеннях по відношенню до атому галогену електроноакцепторниі замісники, які полегшують атаку нуклеофілу по атому карбону зв’язку С-Hal внаслідок зростання на цьому атомі частково позитивного заряду в результаті прояву ефекту супряження.
Cl Cl Cl ONa
|
|
+ |
|
|
100 |
|
|
|
|
|
+2NaOH |
+ NaCl+H2O |
|
||||
|
|
|
|
|||||
|
- |
- |
NO2 |
|
|
NO2 |
|
|
NO2 |
O-N-O |
|
|
|
|
|||
|
|
+ |
|
|
|
|
|
|
Cl |
HO Cl |
HO Cl |
HO |
Cl |
HO Cl |
HO |
Cl |
OH |
|
|
|
|
|||||
- |
|
- |
|
- |
|
|
|
- |
+ OH |
- |
|
|
|
|
|
+ Cl |
|
|
|
|
- |
|
|
|||
|
|
|
|
|
|
|
|
|
NO2 |
NO2 |
NO2 |
NO2 |
|
NO2 |
- O-N-O - |
NO2 |
|
|
|
|
|
|
|
- |
|
|
|
|
I |
II |
|
III |
IV |
|
|
Проміжний негативно заряджений σ-комплекс стабілізується за рахунок ефективного спряження. Найбільший внесок в стабілізацію σ-комплексу вносить межова структура IV, в якій негативний заряд виноситься за межі бензольного кільця і знаходиться на найбільш електронегативному атомі оксигену. Саме утворення енергетично вигідного σ-комплексу під впливом сильного електроноакцепторного замісника є вирішальним фактором здійснення реакції за механізмом SNAr.
Для реакцій SNArшвидкість реакції зростає із зростанням електронегативності атому галогену, тобто зростає позитивний заряд на атомі карбону, який несе атом галогену.
Загалом, вплив атому галогену на швидкість реакцій галагенопохідних можна
підсумувати в такій таблиці: |
|
|
|
SN1 |
SN2 |
E-A |
SN-Ar |
Із зростанням електронегативності атомів галогену швидкість відповідних реакцій |
|||
уповільнюється внаслідок |
прискорюється внаслідок |
||
утворення більш |
збільшення енергії |
появи більш |
появи більш |
міцного зв’язку С- |
розпушуючої |
“кислого” атому |
позитивного заяду н |
Hal |
орбіталі σ*C-Hal |
водню в о- |
тоі С, якй несе том |
|
|
положенні |
Hal |

VIII. Реакції відщеплення галогеноводнів.
Існують два механізми відщеплення галгеноводнів від насичених галогеналканів:
1. Е1 – відщеплення мономолекулярне, швидкість реакції залежить лише від концентраціїгалогеналкану:
V=k[R-Hal]
|
вода |
|
|
|
|
|
(CH ) CCl+NaOH |
CH -C |
|
CH |
|
+NaCl+H O |
|
|
|
|||||
|
|
|||||
3 3 |
3 |
|
|
|
2 |
2 |
|
|
|
||||
|
|
|
|
|
|
|
CH3
H3C 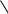
C-Cl
H3C H3C
CH3 |
CH |
3 |
|
|
повільно |
|
|
- |
швидко |
CH2+H + |
|
C + |
+Cl |
|
CH3-C |
|
CH3 |
CH |
3 |
|
|
|
|
|
|
|
|
+-
H+OH  H2O
H2O
Лімітуючи стадія реакції – утворення карбокатіону, тому швидкість реакції зростає при переході від первинних до третинних алкілгалогенідів:
Відщеплення протону за механізмом Е1 є наглядним проявом ефекту над спряження; протон відщеплюється внаслідок перекривання вакантної орбіталі карбокатіоного центру
зелектронами сусіднього зв’язку С-Н.
2.Е2 – відщеплення бімолекулярне, швидкість реакції залежить від концентрації
обох реагентів – галгеналкану та основи:
V=k[R-Hal][OH-]
CH3CH2CH2Cl+NaOH |
CH3-CH |
|
CH2 +NaCl+H2O |
|
|||
|
Механізм:
+-
NaOH  Na+OH
Na+OH
|
|
|
- |
|
|
|
|
|
|
|
|
- |
|
|
|
- |
|
|
|
|
|
|
|
|
CH2 Cl |
CH3-CH |
|
CH2 |
+Cl + H2O |
||||
CH -CH-CH -Cl + |
OH |
|
|
CH -CH |
|
|
|
|||||||||
|
|
|
|
|
||||||||||||
|
|
|
|
|||||||||||||
3 |
|
2 |
|
|
|
3 |
OH - |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
H |
|
|
|
|
H |
|
|
|
|
|
|
||||
Реакція за механізмом Е2 також прискорюється із збільшенням числа замісників при сусідньому атомі карбону. Це повязоно з утворенням термодинамічно більш вигідного більш розгалуженого Олефіру та меншою міцністю зв’язку С-Н у більш заміщеному атомі карбону.
ІХ. Конкуренція реакцій SN та Е.
Реакції заміщення завжди супроводжуються відщепленням і навпаки. Однак при переході від первинних до третинних галагенопохідних прерд усім полегшуються реакції відщеплення і останні переважають для третинних галагенопохідних. Для третинних галагенопохідних дуже важливо взагалі провести реакцію заміщення. Вона можлива

лише тоді, коли використовуються сильні нуклеофіли, які являють собою слабкі нуклеофіли:
(CH3)3CCl+NaI (CH3)3C I+NaCl
(CH3)3C I+NaCl 
Навпаки, для первинних галагенопохідних переважають реакції заміщення. Вірогідність реакцій відщеплення зростає із збільшенням основності реагентів, в свою чергу реакції заміщення – із збільшенням нуклеофільності реагенту.
Х. Реакції галогеналканів та галогенаренів з металами.
Na: 1. 2 CH3Cl+ 2Na  CH3-CH3+ 2NaCl
CH3-CH3+ 2NaCl
Li: 2. CH Cl+ 2Li |
CH Li+ LiCl |
3 |
3 |
Mg: 3. CH3Cl+ Mg  CH3MgCl
CH3MgCl
Na: |
1. 2 |
Cl +2Na |
+2Na Cl |
Li: 2. |
Cl +2Li |
Li +LiCl |
|
|
|
Mg:. 3. |
Cl +Mg |
MgCl+ |
АРОМАТИЧНІ СУЛЬФОКИСЛОТИ
Ароматичними сульфокислотами називають сполуки, в яких атом сірки сульфогрупи –SO3H сполучений з атомом вуглецю ароматичного ядра. У молекулу бензолу можна ввести одну, дві або три сульфогрупи. Прикладом ароматичної моносульфокислоти є бензолсульфокислота:
O |
O |
+ |
+ |
S OH |
S OH |
O |
O |
|
O |
+ |
OH мезомерна структура |
S |
O
У відповідності до октетної формули сульфогрупа має два ковалентних і два семіполярних зв’язків. Останні утворені за участю тільки електронів атому сірки. Однак, для сульфокислот може використовуватися формула з шістьма ковалентними зв’язками (двома одинарними та двома подвійними), так як атоми сірки мають вільні d-орбіталі, на яких можуть бути розміщені електрони (з розширенням октету).
|
.. |
|
|
|
|
O |
|
|
|
|
|
|
|
|
O |
|||
O |
|
|
|
|
|
|
|
O |
|
|
|
|||||||
** |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R. |
OH |
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
|
||
R |
S OH |
|
S |
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|||||||||||
* |
S. |
R |
|
OH |
R S |
|
OH |
|||||||||||
* |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
.**. |
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
||
.O. |
|
|
|
|
O |
|
|
|
|
|
|
O |
||||||
.. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
електронна будова |
|
|
|
|
|
|
|
|
|
|
мезомерна структура |
|||||||

Дійсна будову атому сірки – проміжна між станами, які відповідають цим двом формам (Див. “мезомерна структура”).
Ароматичні сульфокислоти добувають переважно реакцією сульфування ароматичних сполук сульфуючими реагентами (концентрована H2SO4, олеум: SO3+H2SO4; SO3 ; хлорсульфонова кислота HОSO2Cl; хлористий сульфурил SO2Cl2 , та інш.).
Сульфування – це реакція електрофільного заміщення. При сульфуванні сірчаною кислотою сульфуючою частинкою є катіон гідросульфонію, який утворюється з концентрованої кислоти за схемою:
|
H3O+ |
+ |
- |
3 H2SO4 |
+ SO3H + 2 HSO4 |
||
Треба мати на увазі, що реакція сульфування є зворотною:
+ H2SO4 |
SO3H + H2O |
|
|
|
Її механізм: |
|
|
|
|
+ |
+ |
|
H |
+ |
3 |
SO3H |
+ |
|
SO3H + H |
+ SO H |
|
SO3H |
|
|
|
|
|
|
|
|
π-комплекс |
σ-комплекс |
|
|
Подібно до сірчаної кислоти сульфокислоти є сильними кислотами.
Хімічні властивості сульфокислот визначаються наявністю сульфогрупи і їх можна розділити на три типи:
1)реакції сульфогрупи;
2)реакції заміщення сульфогрупи;
3)реакції за участю бензольного ядра.
1.Реакції сульфогрупи
утворення солей
SO2OH |
SO2ONa |
+ NaOH |
200 |
|
утворення хлорангідридів
SO OH |
|
|
|
SO2Cl |
|
|
2 |
|
t 0 |
|
|
|
|
+ |
PCl5 |
|
+ POCl |
+ |
HCl |
|
|
|
|
||||
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
утворення ефірів та амідів
SO OH |
SO2 OC2H5 |
2 |
|
+ C2H5OH |
-H2O |
|
|
SO Cl |
SO NH |
2+ NH3 |
2 + 2Cl |

SO2NH2 |
|
SO |
N Cl |
+ |
NaOH |
2 |
Cl |
Cl2 водн. |
|
|
|
|
- NaCl; -H2O |
|
|
утворення тіофенолів
SO2OH |
Zn+H2SO4 |
|
|
|
SH |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
2.Реакції заміщення сульфогрупи на групи –ОН; –CN; –NH2.
Гідроліз (при дії перегрітої водяної пари в кислому середовищі
сульфокислоти дають вихідні ароматичні вуглеводні)
SO2OH
+ H2O |
|
|
|
+ H2SO4 |
|
|
Реакції лужного плавлення
SO3Na |
|
|
OH |
+ NaOH тв. |
320O |
|
+ Na2SO3 |
лужне |
|
||
|
|
|
|
|
плавління |
фенол |
|
|
|
||
Сплавлення солей сульфокислот з ціанідами з утворенням нітрилів
SO Na |
плавління |
CN |
|
3 |
+ NaCN |
+ Na2SO3 |
|
тв. |
|
|
бензонітрил |
3.Реакції електрофільного заміщення водню: відбуваються важче, ніж у бензолі завдяки тому, що сульфогрупа виявляє негативний індукційний ефект і є орієнтантом другого роду (мета-оріентантом), пасивує бензольне ядро до реакції електрофільного заміщення.
SO H |
SO H |
3 |
3 + H2O |
+ H2SO4 ! |
SO3H
Сульфокислоти мають різноманітне застосування. Вони є основою для добування поверхнево-активних речовин, миючих засобів, барвників, дубильних речовин, йонообмінних смол тощо.

ОДНО- І БАГАТОАТОМНІ СПИРТИ
Спирти - це похідні вуглеводнів, у молекулах яких один або декілька атомів водню заміщені гідроксильними групами. У залежності від кількості гідроксильних груп спирти бувають одноатомні та багатоатомні. Молекули спиртів асоційовані внаслідок виникнення між ними водневих зв’язків, чим і пояснюються порівняно високі температури кипіння спиртів:
R |
|
R |
|
R |
R |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
. . . O |
|
H . . . O |
|
H . . . O |
|
H . . . O |
|
H. . . |
||||
|
|
|
|
|||||||||
МЕТОДИ ОДЕРЖАННЯ СПИРТІВ
І. Гідроліз галагенопохідних.
H3C |
|
Cl + H2O |
NaOH |
H3C |
|
OH + HCl |
|
||||||||||||
|
SN2 |
|
|
|
|||||||||||||||
а) |
|
|
|
|
|
метанол |
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
NaOH |
|
|
|
CH |
3 |
|
||||||||
H3C |
|
C |
|
CH3 + H2O |
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
H3C |
|
C |
|
CH3 |
+ HCl |
|||||||||
|
|
|
|
||||||||||||||||
|
|
|
SN1 |
||||||||||||||||
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
Cl |
|
|
|
|
|
|
OH |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||
б) |
|
|
|
|
|
|
|
|
|
|
2-метил-2-пропанол |
||||||||
в) Треба мати на увазі, що галоген, який знаходиться біля α-вуглецевого атома бокового ланцюга дуже рухливий і легко заміщується на нуклеофільні реагенти за
механізмом SN1: |
|
|
|
|
|
|
||||||
|
CH2 |
|
Cl |
|
CH2OH |
|||||||
|
|
|
||||||||||
|
|
|
|
|
|
+ HOH |
Na2CO3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
+ NaCl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
бензиловий спирт |
|||||
Спочатку повільно відбувається дисоціація з утворенням енергетично стійкого бензильного катіона, стійкість якого зумовлена спряженням р-орбіталей бензольного ядра з вакантною орбіталлю вуглецевого атома бокового ланцюга. На другій стадії бензильний катіон швидко реагує з нуклеофілом:
|
+ |
+ |
|
|
CH2 Cl |
CH2 |
CH2 |
CH2 |
OH |
|
|
|
||
повільно |
+ Cl , |
- |
швидко |
|
|
+ OH |
|
||
|
- |
|
|
|
ІІ. Каталітична гідратація алкенів.
|
|
+ |
|
|
- |
+ |
|
H2SO4 |
|
|
|
|
|
|
H3C CH |
|
CH2 |
H2O |
|
|
H3C CH CH3 |
||||||||
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
2-пропанол |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- |
|
|
|
|

|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
HC |
|
|
|
|
CH2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
[H+] |
|
|
HC |
|
|
|
CH3 |
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
H2O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ NaCl |
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
вінілбензол |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
метилфенілкарбінол |
|||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
стирол |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1-фенілетанол |
|
||||||||||||||||||||||||||||||||||
ІІІ. Металоорганічний синтез. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||
а) для одержання первинних спиртів) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||
CH2=O |
+ |
|
C2H5MgBr |
|
|
|
|
|
|
|
|
|
|
|
|
|
C2H5CH2OMgBr |
|
H2O |
|
C2H5CH2-OH |
+ Mg(OH)Br |
|||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
етанол |
|
||||||
б) для одержання вторинних спиртів |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||
CH3CH=O |
+ |
|
C2H5MgBr |
|
|
|
|
|
|
|
|
|
|
C2H5HCCH3(OMgBr) |
|
H2O |
|
CH3CHC2H5 |
+ Mg(OH)Br |
||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2-бутанол |
|
||||||||||
в) для одержання третинних спиртів |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OMgBr |
H2O |
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ Mg(OH)Br |
|||||||||
CH3-CO-CH3 |
+ C2H5MgBr |
|
|
|
|
|
|
|
C2H5 |
|
C |
|
|
CH3 |
C2H5 |
C |
|
|
|
CH3 |
|||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2-метил-2-бутанол |
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OMgBr |
|
|
CH3MgBr |
|
|
|
|
|
|
|
|
OMgBr |
|
||||||||||||||||
C H |
|
C |
|
|
O |
|
CH |
|
+ CH MgBr |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 + CH3OMgBr |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C2H5 |
|
C O |
CH3 |
|
|
|
|
|
|
C2H5 |
|
C |
|
|||||||||||||||||||||||||||||||||||
2 5 |
|
|
|
|
|
|
|
|
3 |
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
OMgBr |
|
H2O |
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
C2H5 |
C |
|
|
CH3 |
|
|
|
|
|
|
|
|
CH3 + Mg(OH)Br |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
C2H5 |
|
|
C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
ІV. Гідрування альдегідів та складних ефірів. |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H C |
|
|
CH=O + H2 |
Ni, Pt, Pd |
|
C H CH -OH |
|
|||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
t |
|
|
|
|
|
|
|
2 |
|
5 |
|
2 |
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
етанол |
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
V. Гідрування кетонів. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3-CO-CH3 + H2 |
Ni, Pt, Pd |
|
|
|
CH3 |
|
CHCH3 |
|
||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
t |
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
2-пропанол |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
Хімічні властивості спиртів зумовлені присутністю групи –ОН. Спирти – амфотерні сполуки. Виявляють властивості дуже слабких кислот: у реакції з металічним натрієм утворюють солі – алкоголяти:
2 C2H5OH + 2 Na |
2 C2H5ONa + H2 |
У реакціях з галогеноводневими кислотами спирти виявляють властивості основ і реагують за механізмами SN2 у первинних спиртів, SN1 у вторинних і третинних. Реакції нуклеофільного заміщення супроводжуються реакціями дегідратації з утворенням алкенів:

|
|
CH3 |
|
|
|
|
|
|
|
|
CH3 |
|
|
CH3 |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
. . |
|
|
|
|
|
|
|
. .+ |
|
|
|
|
|||
CH3 |
|
|
|
|
+ HCl |
|
CH3 |
|
|
H2O + CH3 |
|
C + |
||||||||
|
C |
|
|
OH |
|
|
C |
|
OH |
|
||||||||||
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
. . |
|
|
Cl |
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|||
|
|
CH3 |
|
|
|
|
|
|
|
|
CH3 |
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
Стабілізація карбокатіону проходить у двох напрямках: а) приєднання нуклеофіла (1)
б) відщеплення протона (2)
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
||||||
|
|
|
|
|
|
+ Cl |
|
CH3 |
|
|
|
|
Cl |
(1) |
||||
|
|
CH3 |
|
|
|
C |
|
|||||||||||
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
CH3 |
|
|||||||||||||
CH3 |
|
C + |
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
CH3 |
|
|
|
+ |
|
|
|
|
|
|
|
|
(2) |
|||
|
|
|
|
|
|
|
|
H |
+ |
|
CH3 |
|
C |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
CH2
Внутрішньота міжмолекулярна дегідратація спиртів
Внутрішньомолекулярна дегідратація спиртів
І) Для вторинних і третинних спиртів за механізмом Е1 (при нагріванні з надлишком сульфатної кислоти за правилом Зайцева)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H2SO4 |
|
|
|
H2C |
|
|
CH |
|
|
|
CH3 + H2O |
|
|
|
|
|
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
H3C |
|
|
|
CH |
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
t |
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
пропен |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
2-пропанол |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
Механізм: Е1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
|
H2O |
|
|
|
|
|
||||||||||||||||||||||||||||||||
. . |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
. .+ |
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||
CH3 |
|
CH |
|
|
|
OH |
+ H+ |
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
CH |
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
CH3 |
|
|
CH |
|
|
|
|
|
|
H C |
|
CH |
|
CH |
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||
|
|
|
. . |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
- H2O |
|
|
|
- H3O+ |
2 |
3 |
|||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
пропен |
|||||||||||||||||||||||||||||||
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
йон диметилоксонію |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||
ІІ) для первинних спиртів за механізмом Е2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
H3C |
|
CH2 |
OH |
|
H2SO4 |
|
|
H2C |
|
|
|
|
CH2 + H2O |
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
t |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
етанол |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
етен |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||
Міжмолекулярна дегідратація спиртів |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||
І) Для вторинних і третинних спиртів за механізмом SN1 |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
OH + HO |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H2SO4 |
|
|
H3C |
|
|
|
|
CH |
|
|
O |
|
CH |
|
CH3 + H2O |
||||||||||||||||||||||||||||||||||
|
H3C |
|
CH |
|
|
CH |
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
t |
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
CH3 |
|
|
|
|
|
|||||||||||||||||||||||
|
2-пропанол |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
діізопропіловий ефір |
|
|
|
|
|
|||||||||||||||||||||||||||||||
ІІ) для первинних спиртів за механізмом SN2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
2 H3C |
|
|
|
CH2 |
OH |
H2SO4 |
|
|
H3C |
|
|
CH2 |
O |
|
|
|
CH2 |
CH3 + H2O |
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
t |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
етанол |
|
|
|
|
|
|
|
|
|
|
|
діетиловий ефір |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
Спирти утворюють також естери при реакції з мінеральними та карбоновими кислотами:
