
- •6.0929 „ Промислова біотехнологія ”
- •6.0929 „ Промислова біотехнологія ”
- •Розділ 1. Якісний аналіз
- •Якісний аналіз неорганічних катіонів
- •Лабораторна робота №1 Якісні реакції катіонів і-іі груп.
- •Контрольні питання.
- •Якісний аналіз неорганічних аніонів
- •Реакції аніонів I аналітичної групи Реакції сульфат-іонів sо42-
- •Реакції карбонат-іонів со32-
- •Реакції фосфат-іонів ро43-
- •Реакції аніонів II аналітичної групи
- •Реакції хлорид-аніонів Сl-
- •Реакції бромід-іонів Вr-
- •Реакції йодид-іонів і-
- •Реакції аніонів III аналітичної групи
- •Реакції нітрат-аніонів no3-
- •Лабораторна робота №2 Якісні реакції катіонів ііі групи. Якісні реакції аніонів
- •Контрольні питання.
- •Лабораторна робота №3 Контрольний аналіз суміші катіонів і аніонів (невідома сіль)
- •Аналіз речовини або суміші речовин невідомого складу
- •Розділ 2. Титриметричні методи аналізу
- •Кислотно-основне титрування (метод нейтралцзації)
- •Лабораторна робота № 4 Приготування розчину соляної кислоти. Визначення концентрації соляної кислоти за титрованим розчином NаОн.
- •Контрольні питання.
- •Лабораторна робота № 5 Визначення концентрації соляної кислоти за натрій тетраборатом.
- •Контрольні питання.
- •Лабораторна робота № 6 Приготування робочого розчину натрію гідроксиду з наважки та визначення його концентрації за оксалатовою кислотою. Визначення масової частки лимонної (винної) кислоти.
- •Контрольні питання.
- •Перманганатометрія
- •Лабораторна робота № 7 Приготування та стандартизація робочого розчину kMnO4
- •Контрольні питання.
- •Йодометрія
- •Лабораторна робота № 8 Приготування титрованого розчину йоду за точною наважкою хімічно чистого препарату.
- •Лабораторна робота № 9 Приготування титрованого розчину натрію тіосульфату та визначення його точної концентрації за розчином калію біхромату.
- •Контрольні питання.
- •Лабораторна робота № 10 Йодометричне визначення міді
- •Контрольні питання.
- •Комплексонометрія
- •Лабораторна робота № 11 Приготування титрованого розчину комплексону ііі
- •Контрольні питання.
- •Лабораторна робота № 12 Трилонометричне визначення цинку
- •Контрольні питання.
- •Лабораторна робота № 13 Комплексонометричне визначення загальної жорсткості води
- •Контрольні питання.
- •Розділ 3. Фізико-хімічні методи аналізу Потенціометричний метод
- •Лабораторна робота № 14 Визначення заліза в солі Мора
- •Результати титрування заліза р-ном к2Сr2o7 концентрацією 0,1 m
- •Контрольні питання.
- •Лабораторна робота № 15 Потенціометричне титрування хлорид - та йодид - іонів
- •Контрольні питання.
- •Вольтамперометричний метод аналізу
- •1. Визначення концентрації металів за рівняння м Ільковича
- •2. Визначення концентрації методом стандартних розчинів
- •3. Визначення концентрації речовини за методом калібрувального графіка
- •4. Визначення концентрацій речовин методом добавок
- •Лабораторна робота № 16 Визначення концентрації гідрохінона
- •Контрольні питання.
- •Амперметричне титрування
- •Лабораторна робота № 17 Визначення заліза ванадатом амонію
- •Контрольні питання.
- •Фотометричний метод аналізу
- •Прилади, які використовуються для фотометрії
- •Лабораторна робота № 19 Визначення заліза (III) із сульфосаліциловою кислотою диференційним методом
- •Контрольні питання.
- •Розділ 4. Використання фізико-хімічних методів в аналізі біооб’єктів Лабораторна робота № 20 Кількісне визначення вмісту білків за нінгідриновим методом
- •Контрольні питання.
- •Хроматографічні методи
- •Список літератури
Реакції аніонів III аналітичної групи
До третьої аналітичної групи відносять іони NO3-, NO2-, CH3COO-, MnO4-. Солі аніонів третьої групи з іонами барію та срібла розчинні у воді, тому ці аніони не мають групового реагенту. Іони III аналітичної групи безбарвні, окрім перманганат іону.
Реакції нітрат-аніонів no3-
Нітрат-іон є аніоном азотної кислоти НNO3 Індивідуальна (чиста) НNО3-безбарвна рідина, густина якої складає 1,54 г/см3 при температурі 20°С. У воді азотна кислота необмежено розчиняється, утворюючи водні розчини НNО3. У водних розчинах НNО3 повністю дисоціює, НNО3 відноситься до найбільш сильних мінеральних кислот.
Азотна кислота - сильний окиснювач, тому її широко використовують в аналізі для переведення в розчин речовин, що потребують окиснення. Концентрована HNО3 відновлюється при окисненні різних сполук до NO2, розведена НNОз до вільного азоту N2 і навіть до аміаку NН3.
Солі азотної кислоти називаються нітратами. Всі солі азотної кислоти, нітрати, за винятком основних солей вісмуту і ртуті, а також деяких солей органічних основ, добре розчиняються у воді.
Реакція з міддю і сірчаною кислотою. Металічна мідь Сu в сірчанокислому середовищі окиснюється нітрат-іонами NО3- з утворенням іонів Сu2+ голубого кольору і виділенням газу NО, який на повітрі окиснюється і утворюється NО2 бурого кольору:
![]()
Реакція з FeSO4 Солі заліза (II) відновлюють нітрат-іони в кислому середовищі до NО, оксид aзоту NО утворює з залізом (II) нестійку комплексну сполуку [Fе(NО)]2+ бурого кольору:
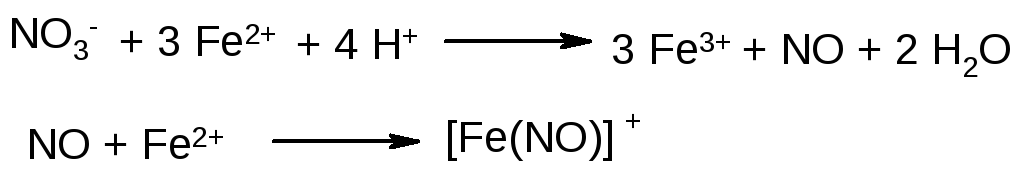
Виконання реакції. До 10-15 крапель розчину, в якому виявляють іони NОз-, добавляють 5-7 крапель розчину FеSО4, перемішують. Потім в нахилену з розчином пробірку обережно добавляють по стінці концентровану Н2SО4 так, щоб розчини не змішувалися. Поява на межі стикання двох розчинів коричневого кільця [Fе(NО)]2+-іонів свідчить про присутність іонів NО3- в розчині.
Іони NО2- в аналогічних умовах також утворюють комплексні іони [Fе(NО)]2+ бурого кольору, тому вони заважають виявленню іонів NО3-.
Реакції відновлення NО3- іонів алюмінієм, магнієм, цинком в лужному середовищі. Металічні алюміній, магній, цинк, сплав Деварда в лужному середовищі відновлюють нітрат-іони до аміаку:
![]()
Аміак виявляють за запахом або за допомогою змоченого водою червоного лакмусового папірця.
Реакції заважають всі аніони, до складу яких входить азот: NО2- SCN-, [Fе(СN)6]4-, [Fе(СN)6]3-. Ці аніони також відновлюються алюмінієм до NН3.
Відновлення NO3-іонів до NO2- -іонів. Металічний цинк в оцтовокислому середовищі відновлює нітрат-іони до нітрит-іонів:
![]()
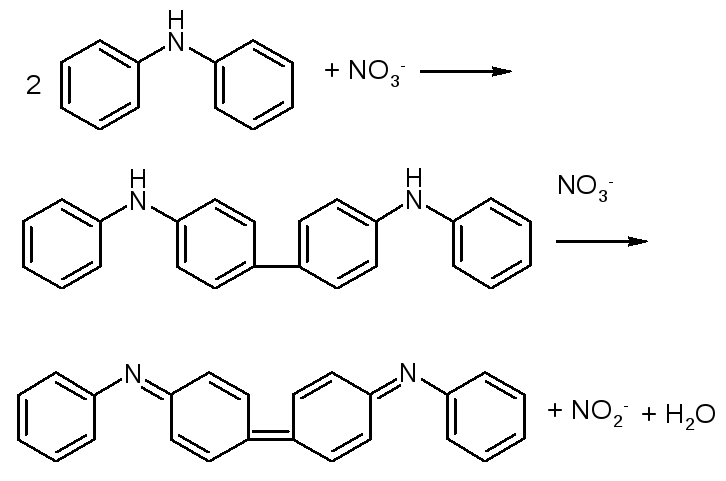
Реакція з дифеніламіном (C6H5)2NH. Нітрат-іони NО3-окиснюють дифеніламін в розчині концентрованої Н2SО4 до дифенілбензидину синього кольору:
Виконання реакції. На чисте годинникове скло наносять 4-5 крапель розчину дифеніламіну в концентрованій Н2SО4 і на кінчику скляної палички зовсім небагато розчину, в якому виявляють іони, перемішують. В присутності NO3-іонів з являється інтенсивно синє забарвлення внаслідок утворення окисненого дифенілбензидину.
Лабораторна робота №2 Якісні реакції катіонів ііі групи. Якісні реакції аніонів
Мета: ознайомитися із якісними реакціями на катіони ІІІ групи та аніони у розчинах.
Обладнання та посуд: набір реактивів для проведення якісних реакцій на катіони та аніони, пробірки, предметне скло, скляна паличка, мікроскоп, центрифуга, електрична плитка.
Завдання:
1. У даній лабораторній роботі пропонується виконати наступні якісні реакції катіонів IІІ групи та якісні реакції на аніони.
2. Провести систематичний аналіз суміші катіонів IІІ групи. Рівняння реакцій записати в лабораторний журнал.
