
- •6.0929 „ Промислова біотехнологія ”
- •6.0929 „ Промислова біотехнологія ”
- •Розділ 1. Якісний аналіз
- •Якісний аналіз неорганічних катіонів
- •Лабораторна робота №1 Якісні реакції катіонів і-іі груп.
- •Контрольні питання.
- •Якісний аналіз неорганічних аніонів
- •Реакції аніонів I аналітичної групи Реакції сульфат-іонів sо42-
- •Реакції карбонат-іонів со32-
- •Реакції фосфат-іонів ро43-
- •Реакції аніонів II аналітичної групи
- •Реакції хлорид-аніонів Сl-
- •Реакції бромід-іонів Вr-
- •Реакції йодид-іонів і-
- •Реакції аніонів III аналітичної групи
- •Реакції нітрат-аніонів no3-
- •Лабораторна робота №2 Якісні реакції катіонів ііі групи. Якісні реакції аніонів
- •Контрольні питання.
- •Лабораторна робота №3 Контрольний аналіз суміші катіонів і аніонів (невідома сіль)
- •Аналіз речовини або суміші речовин невідомого складу
- •Розділ 2. Титриметричні методи аналізу
- •Кислотно-основне титрування (метод нейтралцзації)
- •Лабораторна робота № 4 Приготування розчину соляної кислоти. Визначення концентрації соляної кислоти за титрованим розчином NаОн.
- •Контрольні питання.
- •Лабораторна робота № 5 Визначення концентрації соляної кислоти за натрій тетраборатом.
- •Контрольні питання.
- •Лабораторна робота № 6 Приготування робочого розчину натрію гідроксиду з наважки та визначення його концентрації за оксалатовою кислотою. Визначення масової частки лимонної (винної) кислоти.
- •Контрольні питання.
- •Перманганатометрія
- •Лабораторна робота № 7 Приготування та стандартизація робочого розчину kMnO4
- •Контрольні питання.
- •Йодометрія
- •Лабораторна робота № 8 Приготування титрованого розчину йоду за точною наважкою хімічно чистого препарату.
- •Лабораторна робота № 9 Приготування титрованого розчину натрію тіосульфату та визначення його точної концентрації за розчином калію біхромату.
- •Контрольні питання.
- •Лабораторна робота № 10 Йодометричне визначення міді
- •Контрольні питання.
- •Комплексонометрія
- •Лабораторна робота № 11 Приготування титрованого розчину комплексону ііі
- •Контрольні питання.
- •Лабораторна робота № 12 Трилонометричне визначення цинку
- •Контрольні питання.
- •Лабораторна робота № 13 Комплексонометричне визначення загальної жорсткості води
- •Контрольні питання.
- •Розділ 3. Фізико-хімічні методи аналізу Потенціометричний метод
- •Лабораторна робота № 14 Визначення заліза в солі Мора
- •Результати титрування заліза р-ном к2Сr2o7 концентрацією 0,1 m
- •Контрольні питання.
- •Лабораторна робота № 15 Потенціометричне титрування хлорид - та йодид - іонів
- •Контрольні питання.
- •Вольтамперометричний метод аналізу
- •1. Визначення концентрації металів за рівняння м Ільковича
- •2. Визначення концентрації методом стандартних розчинів
- •3. Визначення концентрації речовини за методом калібрувального графіка
- •4. Визначення концентрацій речовин методом добавок
- •Лабораторна робота № 16 Визначення концентрації гідрохінона
- •Контрольні питання.
- •Амперметричне титрування
- •Лабораторна робота № 17 Визначення заліза ванадатом амонію
- •Контрольні питання.
- •Фотометричний метод аналізу
- •Прилади, які використовуються для фотометрії
- •Лабораторна робота № 19 Визначення заліза (III) із сульфосаліциловою кислотою диференційним методом
- •Контрольні питання.
- •Розділ 4. Використання фізико-хімічних методів в аналізі біооб’єктів Лабораторна робота № 20 Кількісне визначення вмісту білків за нінгідриновим методом
- •Контрольні питання.
- •Хроматографічні методи
- •Список літератури
Контрольні питання.
Які вихідні речовини використовують для встановлення нормальності кислот? Їх переваги та недоліки.
Розрахуйте яку наважку натрію тетраборату потрібно взяти для встановлення молярності ~0,5 М розчину соляної кислоти.
За яким методом концентрація НСl буде визначена точніше – методом пипетування чи методом окремих наважок?
Обчисліть рН в точці еквівалентності.
Чи впливає температура на результати титрування?
Лабораторна робота № 6 Приготування робочого розчину натрію гідроксиду з наважки та визначення його концентрації за оксалатовою кислотою. Визначення масової частки лимонної (винної) кислоти.
Мета: Приготувати розчин натрію гідроксиду з наважки та визначити його концентрацію за оксалатовою кислотою. Визначити масову частку лимонної (винної) кислоти.
Обладнання та посуд:.
Бюретка, 25 мл.
Мірна колба, 250 (200) мл.
Піпетка, 25 (20) мл.
Колба для титрування, 300мл.
Оксалатова кислота.
Індикатор – фенолфталеїн.
Завдання:
Приготувати розчин натрію гідроксиду.
Визначити концентрацію натрію гідроксиду за оксалатовою кислотою.
Визначити масову частку лимонної (винної) кислоти.
Приготування розчину натрію гідроксиду. Приготувати титрований розчин натрій гідроксиду розчиненням точної наважки NaOH неможливо, оскільки NaOH не відповідає вимогам вихідної речовини.
Їдкий натр являє собою кристалічну речовину білого кольору, яка поглинає вологу (тому на повітрі розпливається) і легко реагує з CO2 повітря з утворенням Na2CO3. Тобто, склад натрію гідроксиду невідомий, тому що він забруднений деякою кількістю карбонату натрію і води.
Для приготування титрованого розчину натрію гідроксиду спочатку готують розчин приблизної концентрації, а точну концентрацію визначають за вихідною речовиною, або за титрованим розчином кислоти. Для визначення органічних кислот зазвичай готують приблизно 1 М розчин натрію гідроксиду. Наважку NaOH, необхідну для приготування розчину, розраховують за формулою:
m(NaOH)=![]() ;
M(NaOH)=40
;
M(NaOH)=40![]()
Якщо необхідно приготувати 500 мл 1 М розчину NaOH, то:
Vконц(NaOH)=![]()
Розчин NaOH потрібної концентрації можна отримати і шляхом розбавлення більш концентрованого розчину лугу. В цьому випадку спочатку вимірюють густину концентрованого розчину лугу, за таблицею (довідник) знаходять молярну концентрацію розчину лугу і розраховують об'єм за формулою:
Визначення концентрації розчину натрій гідроксиду за оксалатовою кислотою Оксалатова кислота задовольняє вимогам вихідних речовин і реагує з NaOH за рівнянням:
Н2С2О4+2NaOH→Na2C2O4+2Н2О
Оксалатова кислота є слабкою кислотою (К1=6,5∙10-2, К2=6,1∙10-5). Вона титрується як двоосновна кислота, але на кривій титрування помітний лише один стрибок рН, так як К1⁄К2<104. Визначення концентрації розчину натрій гідроксиду за оксалатовою кислотою здійснюють методом піпетування. Наважку кислоти розраховують з огляду на рівність кількості моль-еквівалентів Н2С2О4 ·2Н2О та NaOH
n(H2C2O4)=n(NaOH)
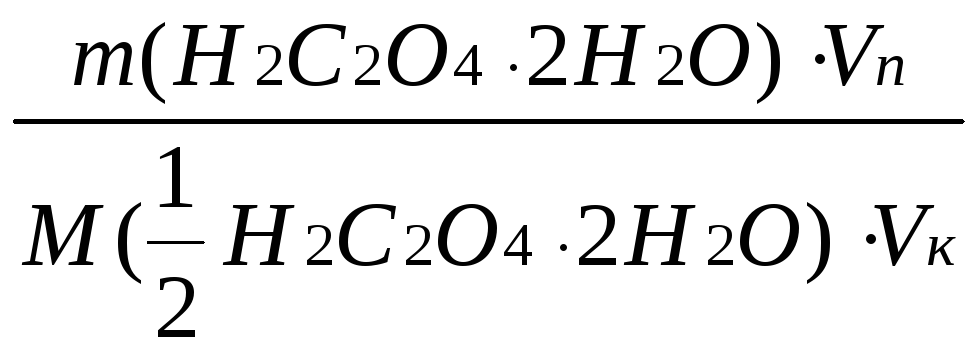 =
=![]()
Молярна маса еквівалента оксалатової кислоти дорівнює половині молярної маси, тобто 126,07⁄2=63,04 г⁄моль.
Якщо Vk (об'єм колби)=250 мл, а Vп (об'єм піпетки)=25 мл, і титрують із бюретки 25,0 мл, то
m(H2C2O4
∙2H2O)=![]() =12,5г.
=12,5г.
При титруванні оксалатової кислоти розчином натрій гідроксиду у точці еквівалентності розчин містить натрій оксалат, який гідролізує за першим ступенем, що обумовлює відповідну кислотність розчину:
С2O42- + H2O → HC2O4- + OH-
Гідроліз за другим ступенем незначний, тому
pH=7+![]() lgK2
lgK2
![]() +
+![]() lgCсолі
lgCсолі
Таким чином, для фіксації точки еквівалентності при титруванні оксалатової кислоти розчином натрій гідроксиду слід використовувати фенолфталеїн (рТ=9) як індикатор.
Хід аналізу. Наважку оксалатової кислоти (Н2С2О4·2Н2О) близько 12,5 г зважують на аналітичних терезах, переносять у мірну колбу і розчиняють у дистильованій воді. Після повного розчинення оксалатової кислоти розчин доводять водою до мітки, ретельно перемішують. Відбирають піпеткою 20 (25) мл аліквотну частку (Vп) розчину, переносять її в колбу для титрування, розбавляють водою приблизно до 50 мл, добавляють 7-8 крапель фенолфталеїну і титрують розчином NaOH, концентрацію якого визначають, до появи рожевого забарвлення, яке не зникає протягом 20-30с. Титрування повторюють 3-4 рази. Концентрацію NaOH розраховують за формулою.
C(NaOH)=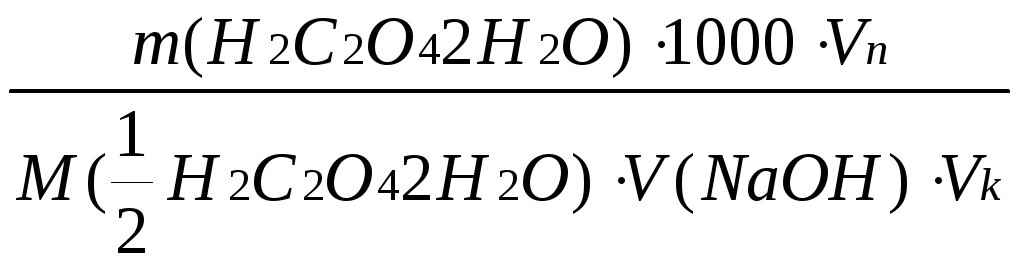
Визначення масової частки лимонної (винної) кислоти. Метод заснований на нейтралізації лимонної (винної) кислоти 1 н. розчином натрію гідроксиду в присутності фенолфталеїну.
Хід аналізу: на аналітичних терезах зважують приблизно 2 г наважки кислоти з точністю 0,0002г. Наважку кількісно переносять в конічну колбу місткістю 250см3 і розчиняють в 50 см3 дистильованої води. Додають до розчину 3-5 крапель фенолфталеїну і титрують 1М розчином натрію гідроксиду до появи слабко рожевого забарвлення, яке не зникає протягом 1 хвилини.
Масову частку кислоти W (у %) розраховують за формулою:
W(кислоти)=![]() ;
;
