
- •6.0929 „ Промислова біотехнологія ”
- •6.0929 „ Промислова біотехнологія ”
- •Розділ 1. Якісний аналіз
- •Якісний аналіз неорганічних катіонів
- •Лабораторна робота №1 Якісні реакції катіонів і-іі груп.
- •Контрольні питання.
- •Якісний аналіз неорганічних аніонів
- •Реакції аніонів I аналітичної групи Реакції сульфат-іонів sо42-
- •Реакції карбонат-іонів со32-
- •Реакції фосфат-іонів ро43-
- •Реакції аніонів II аналітичної групи
- •Реакції хлорид-аніонів Сl-
- •Реакції бромід-іонів Вr-
- •Реакції йодид-іонів і-
- •Реакції аніонів III аналітичної групи
- •Реакції нітрат-аніонів no3-
- •Лабораторна робота №2 Якісні реакції катіонів ііі групи. Якісні реакції аніонів
- •Контрольні питання.
- •Лабораторна робота №3 Контрольний аналіз суміші катіонів і аніонів (невідома сіль)
- •Аналіз речовини або суміші речовин невідомого складу
- •Розділ 2. Титриметричні методи аналізу
- •Кислотно-основне титрування (метод нейтралцзації)
- •Лабораторна робота № 4 Приготування розчину соляної кислоти. Визначення концентрації соляної кислоти за титрованим розчином NаОн.
- •Контрольні питання.
- •Лабораторна робота № 5 Визначення концентрації соляної кислоти за натрій тетраборатом.
- •Контрольні питання.
- •Лабораторна робота № 6 Приготування робочого розчину натрію гідроксиду з наважки та визначення його концентрації за оксалатовою кислотою. Визначення масової частки лимонної (винної) кислоти.
- •Контрольні питання.
- •Перманганатометрія
- •Лабораторна робота № 7 Приготування та стандартизація робочого розчину kMnO4
- •Контрольні питання.
- •Йодометрія
- •Лабораторна робота № 8 Приготування титрованого розчину йоду за точною наважкою хімічно чистого препарату.
- •Лабораторна робота № 9 Приготування титрованого розчину натрію тіосульфату та визначення його точної концентрації за розчином калію біхромату.
- •Контрольні питання.
- •Лабораторна робота № 10 Йодометричне визначення міді
- •Контрольні питання.
- •Комплексонометрія
- •Лабораторна робота № 11 Приготування титрованого розчину комплексону ііі
- •Контрольні питання.
- •Лабораторна робота № 12 Трилонометричне визначення цинку
- •Контрольні питання.
- •Лабораторна робота № 13 Комплексонометричне визначення загальної жорсткості води
- •Контрольні питання.
- •Розділ 3. Фізико-хімічні методи аналізу Потенціометричний метод
- •Лабораторна робота № 14 Визначення заліза в солі Мора
- •Результати титрування заліза р-ном к2Сr2o7 концентрацією 0,1 m
- •Контрольні питання.
- •Лабораторна робота № 15 Потенціометричне титрування хлорид - та йодид - іонів
- •Контрольні питання.
- •Вольтамперометричний метод аналізу
- •1. Визначення концентрації металів за рівняння м Ільковича
- •2. Визначення концентрації методом стандартних розчинів
- •3. Визначення концентрації речовини за методом калібрувального графіка
- •4. Визначення концентрацій речовин методом добавок
- •Лабораторна робота № 16 Визначення концентрації гідрохінона
- •Контрольні питання.
- •Амперметричне титрування
- •Лабораторна робота № 17 Визначення заліза ванадатом амонію
- •Контрольні питання.
- •Фотометричний метод аналізу
- •Прилади, які використовуються для фотометрії
- •Лабораторна робота № 19 Визначення заліза (III) із сульфосаліциловою кислотою диференційним методом
- •Контрольні питання.
- •Розділ 4. Використання фізико-хімічних методів в аналізі біооб’єктів Лабораторна робота № 20 Кількісне визначення вмісту білків за нінгідриновим методом
- •Контрольні питання.
- •Хроматографічні методи
- •Список літератури
Контрольні питання.
Опишіть оптимальні умови фотометричного визначення заліза у вигляді роданідного та сульфосаліцилового комплексу.
Яким чином підібрати світлофільтр для фотометричного визначення?
Які фактори впливають на величину молярного коефіцієнта поглинання?
Чому молярний коефіцієнт поглинання є найбільш об’єктивною характеристикою чутливості фотометричного методу?
Розділ 4. Використання фізико-хімічних методів в аналізі біооб’єктів Лабораторна робота № 20 Кількісне визначення вмісту білків за нінгідриновим методом
Необхідні прилади і реактиви:
1.Фотоколориметр і кювети;
2.Мірні колби місткістю 25мл - 2 шт.;
3.Стандартний розчин гліцину, що містить 50мг гліцину у 1 мл;
4. 0,1% р-н нінгідрину в 95% ацетоні.
Принцип методу. В результаті взаємодії α-амінокислот з нінгідрином (трикетогідрінденом) утворюється забарвлена комплексна сполука. При нагріванні до 70○С α-амінокислоти окислюються нінгідрином та вступають в реакції окисного дезамінування з утворенням аміаку, диоксиду вуглецю та альдегіду, а нінгідрин відновлюється.
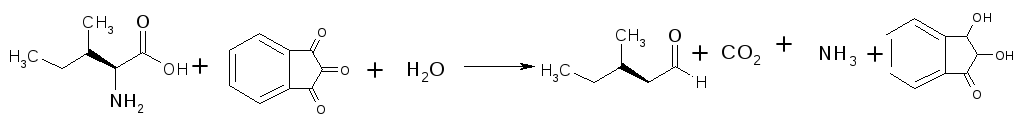 Відновлений
нінгідрин, конденсується з аміаком та
окисненим нінгідрином, утворюючи єнольну
сполуку, що має синьо-фіолетове
забарвлення.
Відновлений
нінгідрин, конденсується з аміаком та
окисненим нінгідрином, утворюючи єнольну
сполуку, що має синьо-фіолетове
забарвлення.
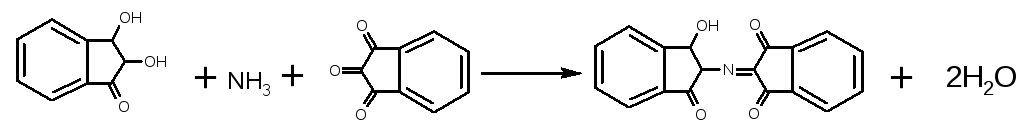
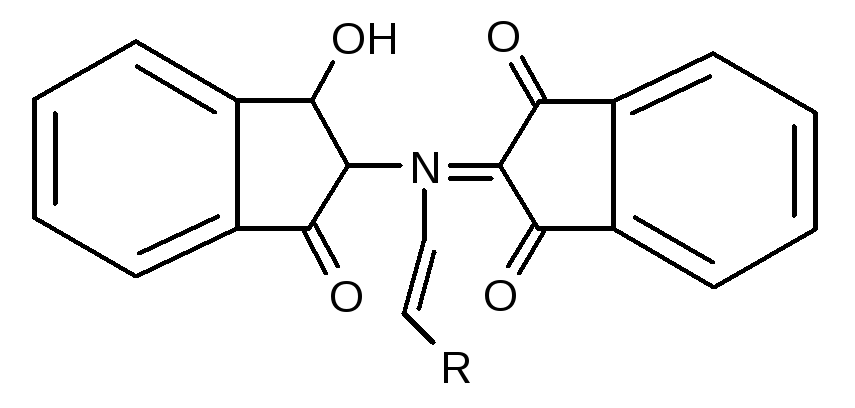
В присутності органічних розчинників (ацетон, етиловий спирт) можливе протікання побічного процесу з утворенням сполуки, що має в своєму складі радикал амінокислоти, і забарвлена вона у червоний, жовтий, голубий колір. Гліцин з нінгідрином має синьо-фіолетове забарвлення.
Хід роботи. В одну колбу на 25 мл вносять 20 розчину гліцину з концентрацією 50 мг/мл, доводять до мітки дистильованою водою, отримують стандартний розчин порівняння. В другу колбу вносять досліджуваний розчин з невідомим вмістом гліцину. В обидві колби додають по 10-15 крапель розчину нінгідрину, перемішують, нагрівають на протязі 5 хвилин при 700С, охолоджують доводять до риски дистильованою водою і через 30 хв спостерігають екстинкцію за допомогою фотоколориметру у кюветі з товщиною 10 мм при червоному світлофільтрі (750 нм). Як розчин порівняння використовують дистильовану воду. Потім проводять визначення оптичної густини в задачі. Знаходять невідому концентрацію гліцину в задачі за формулою:
![]()
Контрольні питання.
Принцип методу кількісного визначення вмісту білків за нінгідриновим методом.
Які побічні реакції можуть протікати в присутності органічних розчинників при фотометричному визначенні амінокислот за нінгідриновим методом?
Які фактори впливають на величину молярного коефіцієнта поглинання при визначенні гліцину за нінгідриновим методом?
Хроматографічні методи
Хроматографічний метод аналізу відкритий російським вченим Цвітом М.С. Це фізико-хімічний метод аналізу, який використовують для розділення і аналізу складних сумішей та визначення властивостей індивідуальних хімічних сполук. Метод дозволяє проводити як якісний так і кількісний аналіз об’єктів, вивчати фізико-хімічні властивості сполук.
Широке розповсюдження хроматографічні методи отримали завдяки їх універсальності (можливо використовувати їх для розділення та визначення твердих, рідких та газоподібних органічних та неорганічних речовин в широкому інтервалі концентрацій), селективності та ефективності (дозволяє проводити розділення сполук із близькими властивостями), простоті експерименту, експресності, можливості автоматизації (що особливо важливо при контролі та регулюванні технологічних процесів), а також використанні їх з іншими фізико-хімічними методами.
Хроматографічні методи розділення основані на сорбційних процесах. Отже хроматографія – це динамічний сорбційний спосіб розділення сумішей, який оснований на розподілі речовин між двома фазами, одна з яких рухома, а інша нерухома та пов’язаний із багаторазовим повторенням сорбційних та десоорбційних процесів.
При класифікації різних хроматографічних методів враховують природу рухомої та нерухомої фаз, механізм взаємодії між фазами і речовинами, що розділяються та техніку експерименту. Так за домінуючим механізмом розділення хроматографію класифікують на адсорбційну, розподільчу, іонообмінну, осадову, дифузійно-молекулярну. За типами стаціонарних та рухомих фаз хроматографію класифікують на газо-рідинну, газо-твердофазну, розподільчу, паперову, тонкошарову, гель-хроматографію та інші. За методом проходження рухомої фази хроматографію класифікують на три типи: висхідна, низхідна та радіальна.
Основні поняття хроматографії.
Адсорбція – розчинених чи газоподібних речовин поверхнею твердого тіла або рідини. При цьому відбувається концентрування речовини (адсорбату, адсорбтиву) з об’єму фаз на поверхні розділу між ними.
Адсорбенти – високодисперсні штучні чи природні тіла із великою зовнішньою (непористі) або внутрішньою (пористі) поверхнею, на якій проходить адсорбція речовин із газів чи розчинів, які із нею стикаються. Органічні адсорбенти, які найчастіше використовують в фармацевтичні хімії – це сахароза, інулін, молочний цукор, целюлоза, крохмаль. Неорганічні адсорбенти – алюмінію оксид, кальцію карбонат, кальцію оксид, силікагель, цинку або магнію оксид, активоване вугілля, деякі природні мінерали, різні сорти глини.
Будь-який сорбційний процес характеризується константою (коефіцієнтом) розподілення (Rf), який являє собою відношення рівноважної концентрації речовини в одній визначуваній формі у нерухомій фазі (с1) до концентрації речовини у тій же формі в рухомій фазі (с2).
Rf= с1/с2
Коефіцієнт розподілення залежить від природи визначуваної речовини, природи рухомої та нерухомої фази, температури, рН, концентрації та іонної сили розчину.
Найпростішими за технікою виконання є паперова та тонкошарова хроматографії, тому в фармацевтичній хімії та біохімії ці методи використовуються найчастіше.
Розподілення в тонкошаровій хроматографії проходить у шарі тонкодисперсного адсорбенту, який нанесено на скляну пластинку або алюмінієву фольгу.
Адсорбенти в тонкошаровій хроматографії – це алюмінію оксид, силікагель, діатоміти або подрібнена целюлоза.
Для отримання тонкошарової хроматограми пробу наносять на один кінець пластини, вносять у закритий посуд (хроматографічну камеру) та занурюють її у розчинник. В цьому випадку потік розчинника рухається знизу догори і таким чином можна отримати висхідну хроматограму. Після закінчення хроматографування пластину виймають висушують та визначають положення різних компонентів. Для цієї цілі найчастіше використовують реагенти (проявники), які утворюють забарвлені сполуки в присутності визначуваних речовин (функціональних груп). Так, розчин нінгідрину забарвлює на хроматограмі аміни або амінокислоти.
В тонкошаровій хроматографії коефіцієнт розподілення знаходять за формулою:
Rf= h1/h2
де h1 – відстань від лінії старту визначуваної речовини до загальної відстані проходження цієї речовини, мм
h2 – відстань проходження розчинника від лінії старту до лінії фронту, мм
Для ідентифікації речовин дуже часто використовують розчин стандартного зразку речовину–свідка (СЗРС) – це розчин речовини, яка повинна знаходитися у визначуваному розчині.
Лабораторна робота №21. Ідентифікація амінокислот методом тонкошарової хроматографії.
Мета: Оволодіти технікою тонкошарової хроматографії (ТШХ).
Завдання:
Методом ТШХ ідентифікувати невідому речовину.
Методика визначення:
1 мл розчину невідомої речовини переносять в мірну колбу місткістю 25 мл, додають 0,5 мл розчину хлоридної кислоти, доводять об'єм розчину водою до мітки і перемішують. На лінію старту пластинки “Silufol” або “Sorbfil” дозатором наносять по 20 мкл (30 мкг) випробуваного розчину і розчину стандартних зразків речовин-свідків кислоти аспарагінової та гліцину. Пластинку з нанесеними пробами висушують на повітрі впродовж 10 хвилин, вміщують в хроматографічну камеру із сумішшю розчинників: спирт н-бутиловый - спирт етиловий - кислота оцтова - вода (3:7:1:3) і хроматографують висхідним методом. Коли фронт розчинників пройде 10 см, пластину виймають з камери, висушують на повітрі впродовж 10 хвилин, обприскують розчином нінгідрину і витримують в сушильній шафі при температурі від 100 до 1050С 2 хвилини.
На хроматограмі досліджуваного розчину повинна виявлятися пляма або плями на рівні плям СЗРС кислоти аспарагінової та гліцину з коефіцієнтом розподілу Rf = 0,4-0,8. Не повинні бути присутніми сторонні плями з Rf менше за 0,20. Допустимі плями на рівні старту.
Примітки:
1. Приготування розчину СЗРС кислоти аспарагінової. 0,025 г кислоти аспарагінової вміщують в склянку, додають 2 мл розчину кислоти хлоридної (1 мл концентрованої хлоридної кислоти розводять водою до 100 мл) і 10 мл води, нагрівають на електроплитці до розчинення і охолоджують. Отриманий розчин кількісно переносять в мірну колбу місткістю 50 мл, доводять водою до мітки і перемішують.
2. Приготування розчину нінгідрину. 0,2 г нінгідрину вміщують в мірну колбу місткістю 100 мл і розчиняють при перемішуванні в 50 мл ацетону, доводять об'єм розчину ацетоном до мітки і перемішують.
Контрольні питання:
Суть хроматографічних методів, їх класифікація, межі використання.
Дайте поняття адсорбенту, рухомої фази, коефіцієнту розподілу.
Техніка виконання тонкошарової хроматографії.
