
- •6.Биноминальное распределение. Распределения Пуассона и Гаусса. Флуктуации.
- •8.Распределение Максвелла по абсолютному значению скорости. Характерные скорости.
- •12.Процессы переноса в газах. Теплопередача, диффузия и трение. Взаимодиффузия в газе из различных молекул. Основные особенности явлений переноса в твердых телах и жидкостях.
- •13.Физические явления в разреженных газах. Явления в сосудах, сообщающихся через пористую перегородку.
- •16.Броуновское движение.Вращательное броуновское движение
- •17 Степени свободы молекул. Теорема о равнораспределении энергии по степеням свободы. Внутренняя энергия идеального газа.
- •18.Теплоемкость идеального газа.Расхождение теории теплоемкостей.
- •19.Внутренняя энергия тел.Теплоемкость изотропных и однородных тел.Количество теплоты.
- •21.Работа.Первое начало термодинамики.Равновесные и неравновесные процессы.
- •23. Скорость звука в газах. Уравнение Бернулли.
- •24.Тепловая машина.Кпд цикла.Холодильная Машина.Цикл Карно.Кпд Карно.
- •25.Формулировка Клаузиуса и Томсона(Кельвина) второго начала темодинамики.Первая теорема Карно.Равенство Клаузиуса.
- •26.Энтропия,Энтропия идеального.Вторая теорема Карно.Неравенство Клаузиуса.Изменени энтропии при необратимых процессах.
- •27.Формулировка второго начала темодинамики с помощью энтропии.Роль энтропии в производстве.Статистический характер.
- •28.Термодтнамическое равновесие. Эмпирические шкалы температур Международная практическая шкала Термодинамическая шкала Отрицательные абсолютные температуры
- •29.Понятие о термодинамич потенциалах.Принцип Ле-Шателье-Брауна.
- •30.Силы межмолекулярного взаимодействия.Ионная связь.Ковалентная связь.Силы Ван-дер-Ваальса.Потенциал Ленарда-Джонса.
- •31.Ураынение Ван-дер-Вальса. Изотермы газа Ван-дер-Вальса. Правило Максвела. Метостобильное состояние
- •32. Приведенное уравнения Ван-дер-Вальса. Внутрения энергия газа ванн-дер-Вальса.
- •33. Эффект Джоуля-Томсана
- •34.Переход из газообразного в жидкое. Экспериментальные изотермы.
- •35. Поведение 2-х фазной сис-мы. Ур Клапейрона-Клаузиуса
- •36.Зависимость свойств реальных газов от идеальных..
- •37.Вириальное ур состояния.
- •38.Сжижение газов. Свойство веществ при температуре близктй к 0.
- •39.Свойства и структура жидкостей жидкие кристаллы. Теплоёмкость жидкостей.
- •40.Поверхностное натяжение. Условия равновесия на границе двух жидкостей и на границе жидкость – твердое тело.
- •41.Давление под искривленной поверхностью жидкости. Капиллярные явления.
- •43.Кипение. Перегретая жидкость. Пузырьковая камера. Переохлажденный пар. Камера Вильсона.
- •44.Жидкие растворы. Растворимость. Теплота растворения.
- •45.Идеальные растворы. Закон Рауля. Закон Генри. Зависимость растворимости от температуры.
- •46. Диаграмма состояния раствора. Кипение жидких растворов.
- •48. Фазовые переходы первого и второго рода. Кристаллизация и плавление. Сублимация. Фазовые диаграммы. Полиморфизм.
- •49.Симметрия твердых тел. Кристаллические решетки. Примитивная решетка. Элементы симметрии решетки. Обозначения атомных плоскостей и направлений.
- •50.Теплоёмкость твёрдых тел. Физические процессы в кристаллах при деформациях. Дислокации.
19.Внутренняя энергия тел.Теплоемкость изотропных и однородных тел.Количество теплоты.
При сообщении системе теплоты бQ ее температура изменяется на dT. Величина
![]() называется
теплоемкостью. Теплоемкость измеряется
количеством теплоты, затрачиваемым для
повышения температуры тела на один
кельвин. Теплоемкость зависит, очевидно,
от массы тела. Теплоемкость, отнесенная
к массе тела, называется удельной.
Теплоемкость зависит от условий, в
которых телу сообщается теплота и
изменяется его температураТеплоемкость
при постоянном объеме. Она определяется
как.
называется
теплоемкостью. Теплоемкость измеряется
количеством теплоты, затрачиваемым для
повышения температуры тела на один
кельвин. Теплоемкость зависит, очевидно,
от массы тела. Теплоемкость, отнесенная
к массе тела, называется удельной.
Теплоемкость зависит от условий, в
которых телу сообщается теплота и
изменяется его температураТеплоемкость
при постоянном объеме. Она определяется
как.
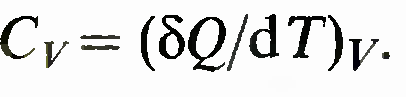
при V= const — полный дифференциал. Формула принимает вид
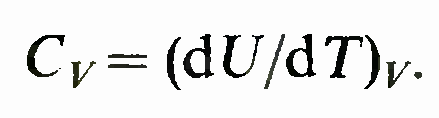
Теплоемкость при постоянном давлении. При р = const уравнение может быть
записано в виде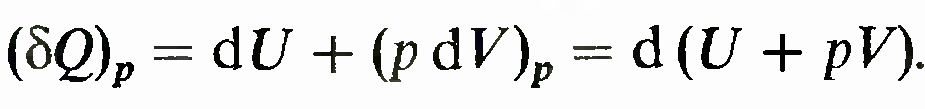
Это означает, что (бQ)Р — полный дифференциал, а
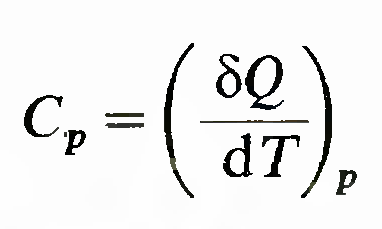 —функция состояния
—функция состояния
Теплота. Из эксперимента известно, что при соприкосновении двух тел их тепловое
состояние выравнивается. Говорят, что от более теплого тела к более холодному
переходит теплота. Теплота — это энергия в специфической форме — форме молекулярного движения. Бесконечно малое количество этой энергии, имеющей указанную специфическую форму, обозначим bQ. Энергия в этой форме, т. е. в виде теплоты, может как сообщаться системе, так и забираться от нее. Условились, что SQ положительна, если она сообщается системе, и отрицательна, если она забирается от нее. Внутренняя энергия. Энергия, которая связана со всевозможными движениями частиц
системы и их взаимодействиями между собой, включая энергию, обусловленную
взаимодействием и движением частиц, составляющих сложные частицы, называется внутренней. Из этого определения следует, что к внутренней энергии не относятся кинетическая энергия, связанная с движением центра масс системы, т. е. с движением системы как целого, и потенциальная энергия системы во внешних полях. Все остальные виды кинетической и потенциальной энергий частиц системы, включая и энергии частиц, составляющих сложные частицы, относятся к внутренней энергии. Бесконечно малое изменение внутренней энергии обозначается dU. Условились, что dU считается положительной величиной, если внутренняя энергия системы увеличивается, и отрицательной, если — уменьшается.
21.Работа.Первое начало термодинамики.Равновесные и неравновесные процессы.
Работа. Для того чтобы уменьшить объем, занимаемый газом, надо совершить работу по преодолению сил давления газа. Представим себе газ, заключенный в
цилиндрический объем с поршнем, движением которого изменяется объем газа . Сила, создаваемая давлением р газа на поршень площади S, равна pS,
следовательно, работа, совершаемая при перемещении поршня, равна pSdx = pdV, где dV— изменение объема газа. Условились, что работа, производимая внешними силами над газом, имеет отрицательный знак, а работа,
производимая газом при увеличении его объема, имеет положительный знак. Поэтому работа бА газа при изме-
нении его объема на dV
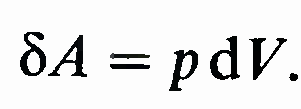
Параметры, изменение
которых обусловливает совершение
работы, обозначим
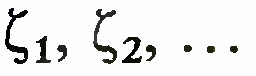 При бесконечно
При бесконечно
малом изменении
параметра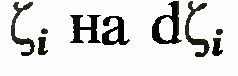 совершается работа
совершается работа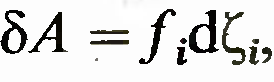 где fi
— обобщенная сила. : если работа
совершается над системой, то знак бА
должен быть положительным.
где fi
— обобщенная сила. : если работа
совершается над системой, то знак бА
должен быть положительным.
Полная работа, совершаемая при изменении всех параметров,
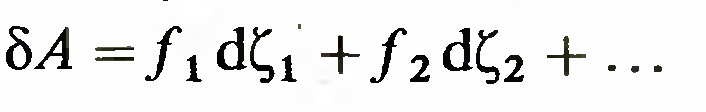
При переносе заряда dq между двумя точками с разностью потенциалов ф
совершается работа
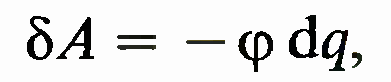
где ф — абсолютное значение разности потенциалов; заряд dq переносится в направлении роста потенциала. Этот пример иллюстрирует то положение, что обобщенные силы и координаты могут ничем не напоминать обычные силы и координаты. Первое начало термодинамики. Закон сохранения энергии для теплоты как формы энергии, внутренней энергии и совершаемой работы с учетом условия о знаках этих
величин может быть записан в следующей очевидной форме:

Закон сохранения энергии в виде называется первым началом термодинамики. В большей части последующего изложения рассматривается работа, связанная с силами давления и изменения объема, и поэтому первое начало будет записываться в виде
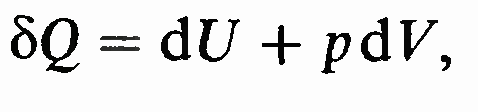
Процессы. Процессом называется переход системы из одного равновесного состояния в другое. Неравновесные процессы. Пусть, например, надо перейти в состояние с другим объемом. Ясно, что если это сделать не очень медленно, то постоянство давления по объему нарушится и нарушится также постоянство температуры. Нельзя будет
вообще говорить о каких-либо определенных давлении и температуре, поскольку они во всех точках будут различными. Больше того, распределение давления и температуры по объему зависит не только от начального и конечного объемов, но и от способа, которым этот переход осуществляется. Таким образом, промежуточные состояния при таком процессе являются неравновесными. Такой процесс называется неравновесным.
Равновесные процессы. Можно осуществить переход другим способом — бесконечно медленно. После каждого бесконечно малого изменения параметров следующее изменение не производится до тех пор, пока система не придет в равновесное состояние, когда все макроскопические параметры примут во всей системе постоянные значения. После этого совершается следующий шаг и т. д. Таким образом, весь процесс состоит из последовательности равновесных состояний. Такой процесс называется равновесным Его можно изображать на диаграммах в виде непрерывных кривых. В уравнении состояния идеальных газов pVm = RT любые из двух параметров могут считаться независимыми параметрами, характеризующими
процесс. Например, некоторый процесс перехода от состояния р1V1, в состояние р2, К2 . Температура в каждой точке процесса однозначно определяется
уравнением состояния. Обратимые и необратимые процессы. Обратимым называется процесс, для которого
возможен обратный переход из конечного состояния в начальное через те же промежуточные состояния, что и в прямом процессе. Необратимым называется процесс, когда обратный переход через геже промежуточные состояния невозможен. Очевидно, что неравновесный процесс в принципе не может быть обратимым; он всегда необратим. С другой стороны,равновесный процесс является всегда обратимым.
Однако не следует думать, что понятие обратимого процесса равнозначно понятию бесконечно медленного процесса. Можно указать бесконечно медленные необратимые процессы, например пластическая деформация твердых тел может происходить бесконечно медленно и тем не менее не является обратимым процессом.
22.Изопроцессы в идеальном газе.Работа при изопроцессах. Изобарический процесс. Это процесс, происходящий при постоянном давлении: р = = const. Температуры в точках р1V1 и p2V2 определяются уравнением состояния и равны соответственно Т1 = PiV1/R, Т2 = P2V2/R. При этом процессе с увеличением объема к системе необходимо подводить теплоту, для того чтобы обеспечить
постоянство давления. Работа в процессе определяется интегралом
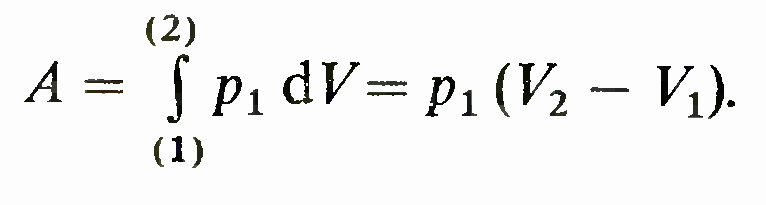 \
\
Изохорическии процесс. Это процесс, осуществляемый
при постоянном объеме: V— const .Работа в этом процессе равна нулю:
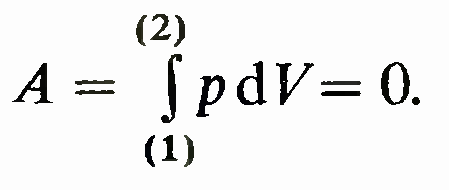
Изотермический процесс. Это процесс, осуществляемый при постоянной температуре: Т= const

В этом процессе внутренняя энергия идеального газа не изменяется, так как Т— const и, следовательно, dU = 0.
Поэтому на основе первого начала термодинамики бQ = бА Это означает, что в изотермическом процессе
все количество теплоты, подводимое извне, идет на совершение работы.
Адиабатический процесс. Это процесс, при котором отсутствует теплообмен с окружающей средой. Поэтому
первое начало термодинамики для этого процесса записывается в виде
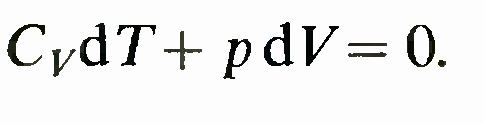
После проведения расчетов работа при адиабатическом процессе будет равна.

Политропический процесс. Процесс, в котором теплоемкость является постоянной
величиной, называется политропическим. Уравнение политропы. Из требования, чтобы теплоемкость С была постоянной
в процессе, следует, что первое начало термодинамики должно иметь вид

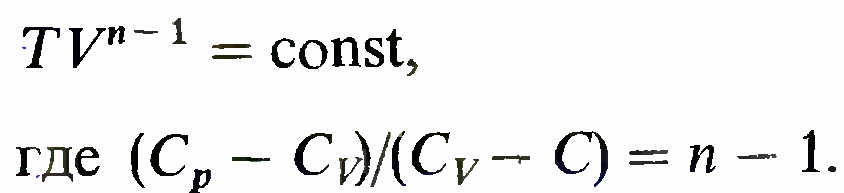
Это уравнение политропы в переменных Т, V.
Исключая из него Т с помощью равенства Т= pV/R, находим
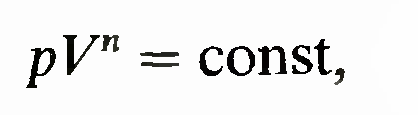
Где
 -показатель
политропы.
-показатель
политропы.
