- •6.Биноминальное распределение. Распределения Пуассона и Гаусса. Флуктуации.
- •8.Распределение Максвелла по абсолютному значению скорости. Характерные скорости.
- •12.Процессы переноса в газах. Теплопередача, диффузия и трение. Взаимодиффузия в газе из различных молекул. Основные особенности явлений переноса в твердых телах и жидкостях.
- •13.Физические явления в разреженных газах. Явления в сосудах, сообщающихся через пористую перегородку.
- •16.Броуновское движение.Вращательное броуновское движение
- •17 Степени свободы молекул. Теорема о равнораспределении энергии по степеням свободы. Внутренняя энергия идеального газа.
- •18.Теплоемкость идеального газа.Расхождение теории теплоемкостей.
- •19.Внутренняя энергия тел.Теплоемкость изотропных и однородных тел.Количество теплоты.
- •21.Работа.Первое начало термодинамики.Равновесные и неравновесные процессы.
- •23. Скорость звука в газах. Уравнение Бернулли.
- •24.Тепловая машина.Кпд цикла.Холодильная Машина.Цикл Карно.Кпд Карно.
- •25.Формулировка Клаузиуса и Томсона(Кельвина) второго начала темодинамики.Первая теорема Карно.Равенство Клаузиуса.
- •26.Энтропия,Энтропия идеального.Вторая теорема Карно.Неравенство Клаузиуса.Изменени энтропии при необратимых процессах.
- •27.Формулировка второго начала темодинамики с помощью энтропии.Роль энтропии в производстве.Статистический характер.
- •28.Термодтнамическое равновесие. Эмпирические шкалы температур Международная практическая шкала Термодинамическая шкала Отрицательные абсолютные температуры
- •29.Понятие о термодинамич потенциалах.Принцип Ле-Шателье-Брауна.
- •30.Силы межмолекулярного взаимодействия.Ионная связь.Ковалентная связь.Силы Ван-дер-Ваальса.Потенциал Ленарда-Джонса.
- •31.Ураынение Ван-дер-Вальса. Изотермы газа Ван-дер-Вальса. Правило Максвела. Метостобильное состояние
- •32. Приведенное уравнения Ван-дер-Вальса. Внутрения энергия газа ванн-дер-Вальса.
- •33. Эффект Джоуля-Томсана
- •34.Переход из газообразного в жидкое. Экспериментальные изотермы.
- •35. Поведение 2-х фазной сис-мы. Ур Клапейрона-Клаузиуса
- •36.Зависимость свойств реальных газов от идеальных..
- •37.Вириальное ур состояния.
- •38.Сжижение газов. Свойство веществ при температуре близктй к 0.
- •39.Свойства и структура жидкостей жидкие кристаллы. Теплоёмкость жидкостей.
- •40.Поверхностное натяжение. Условия равновесия на границе двух жидкостей и на границе жидкость – твердое тело.
- •41.Давление под искривленной поверхностью жидкости. Капиллярные явления.
- •43.Кипение. Перегретая жидкость. Пузырьковая камера. Переохлажденный пар. Камера Вильсона.
- •44.Жидкие растворы. Растворимость. Теплота растворения.
- •45.Идеальные растворы. Закон Рауля. Закон Генри. Зависимость растворимости от температуры.
- •46. Диаграмма состояния раствора. Кипение жидких растворов.
- •48. Фазовые переходы первого и второго рода. Кристаллизация и плавление. Сублимация. Фазовые диаграммы. Полиморфизм.
- •49.Симметрия твердых тел. Кристаллические решетки. Примитивная решетка. Элементы симметрии решетки. Обозначения атомных плоскостей и направлений.
- •50.Теплоёмкость твёрдых тел. Физические процессы в кристаллах при деформациях. Дислокации.
36.Зависимость свойств реальных газов от идеальных..
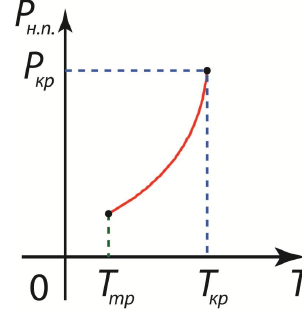
Фазовая диаграмма жидкость-пар
Фазовая диаграмма жидкость-пар Поскольку V’п > V’ж , то dP/dT>0 и давление равновесного состояния фаз увеличивается с ростом температуры.
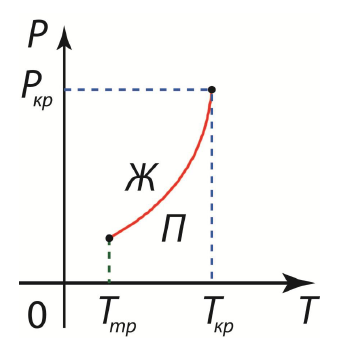
Давление насыщенного пара Давление насыщенного пара Pн.п. соответствует тому давлению, которое образуется в равновесном двухфазном состоянии. Это давление не зависит от объема, при его изменении в V0ж <V0< V0п. Давление насыщенного пара зависит от температуры.
Tтр – температура,
соответствующая тройной точке (когда все три фазы (жидкая,твердая и газообразная) находятся в равновесии).
37.Вириальное ур состояния.
Вириальное уравнение состояния
Уравнение Ван-дер-Ваальса - не единственное возможное уравнение, описывающее состояние реальногогаза. Вид уравнения состояния зависит от закона взаимодействия между молекулами. Никакого точного уравнения для газов с межмолекулярным взаимодействием не существует. Наиболее общая форма уравнения состояния реального газа, называемая вириальным уравнением состояния, имеет вид
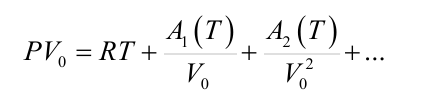
где Ai(T) – вириальные коэффициенты (i=1, 2, …).
38.Сжижение газов. Свойство веществ при температуре близктй к 0.
Сжижение газов
Эффект Джоуля-Томсона используется для сжижения газов, путем их охлаждения. Широко известен промышленный метод Линде.
39.Свойства и структура жидкостей жидкие кристаллы. Теплоёмкость жидкостей.
Свойства и структура жидкостей
В твердом теле каждая частица (атом) колеблется около своего положения равновесия, причем в идеальной решетке кристалла все возможные «места» для частиц заняты. Жидкость обладает более «рыхлой» структурой, чем твердое тело, в ней имеются свободные места - «дырки»,благодаря чему молекулы могут перемещаться,покидая свое место и занимая одну из соседних свободных «дырок». Тепловое движение в жидкостях носит следующий характер: каждая молекула в течение некоторого промежутка времени колеблется около определенного места равновесия. Молекула меняет место равновесия, перемещаясь на отрезок порядка размеров самих молекул. Таким образом, молекулы медленно перемещаются внутри жидкости, пребывая часть времени около определенных мест, находясь в «оседлом» состоянии (теория Я.И. Френкеля). В газе средняя кинетическая энергия теплового движения молекул достаточна, чтобы преодолеть силы притяжения между молекулами. Это ведет к тому, что молекулы в газе разлетаются во все стороны, и газ распространяется на весь предоставленный ему объем. В жидкостях, наоборот, средней кинетической энергии теплового движения не хватает, чтобы преодолеть силы сцепления. Благодаря этому жидкость представляет собой тело определенного объема. Из жидкости вырываются лишь наиболее быстрые молекулы, что ведет к процессу испарения жидкости. Взаимная потенциальная энергия двух молекул газа имеет при некотором расстоянии r0 между молекулами минимум. Однако глубина образующейся потенциальной ямы u невелика и меньше средней кинетической энергии (1/2)kT, приходящейся на одну степень свободы. Поэтому молекулы в газе не удерживаются друг около друга, но, сблизившись, снова разлетаются. Для молекул жидкости средняя кинетическая энергия теплового движения недостаточна, чтобы преодолеть силы взаимного притяжения молекул друг к другу. В результате молекулы располагаются достаточно близко друг к другу, и каждая молекула окружена другими.Каждая молекула пребывает в потенциальной яме около своего положения равновесия. Однако дляжидкости средняя энергия (1/2)kT не на много меньше глубины ямы u, в результате чего кинетическая энергия отдельной молекулы, благодаря наличию флуктуации, иногда оказывается достаточной, чтобы молекула выскочила из потенциальной ямы и заняла новое место между другой парой молекул. Указанный характер движения молекул в жидкостях объясняет как медленность диффузии в жидкостях, так и большую, по сравнению с газами, вязкость жидкостей.
Жидкие кристаллы
Жидкие кристаллы проявляют упорядоченность, которая является промежуточной между упорядоченностью жидкости и твердых тел, приводящей к соответствующей анизотропии их свойств. В соответствии с этим жидкие кристаллы делятся на две группы. Первая группа жидких кристаллов, называемых смектиками, характеризуется одномерной пространственной упорядоченностью. Жидкость представляется состоящей из параллельных жидких слоев, регулярно следующих друг за другом и отличающихся друг от друга упорядоченностью структуры. Вторая группа жидких кристаллов, называемых нематиками, не имеет пространственной упорядоченности, а характеризуется ориентационной упорядоченностью их молекул. Их молекулы
сильно вытянуты, и ориентационная упорядоченность возникает из-за преимущественной ориентации этих длинных молекул. У смектиков молекулы также сильно вытянуты. Поэтому можно сказать, что особенностью жидких кристаллов с молекулярной точки зрения является вытянутая структура их молекул, приводящая к анизотропии свойств.
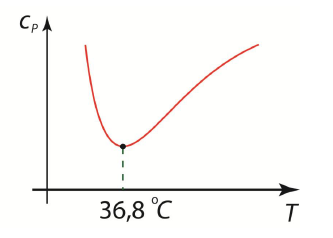
Теплоемкость жидкостей
Внутренняя энергия жидкостей определяется не только кинетической энергией тепловых движений молекул, но и их потенциальной энергией взаимодействия. Опыт показывает, что теплоемкость жидкостей зависит от температуры, причем вид зависимости у разных жидкостей различный. У большинства из них теплоемкость с повышением температуры увеличивается, но есть и такие, у которых, наоборот, - уменьшается. У воды удельная теплоемкость с повышением температуры сначала падает, а затем, пройдя через минимум, начинает расти.