
- •6.Биноминальное распределение. Распределения Пуассона и Гаусса. Флуктуации.
- •8.Распределение Максвелла по абсолютному значению скорости. Характерные скорости.
- •12.Процессы переноса в газах. Теплопередача, диффузия и трение. Взаимодиффузия в газе из различных молекул. Основные особенности явлений переноса в твердых телах и жидкостях.
- •13.Физические явления в разреженных газах. Явления в сосудах, сообщающихся через пористую перегородку.
- •16.Броуновское движение.Вращательное броуновское движение
- •17 Степени свободы молекул. Теорема о равнораспределении энергии по степеням свободы. Внутренняя энергия идеального газа.
- •18.Теплоемкость идеального газа.Расхождение теории теплоемкостей.
- •19.Внутренняя энергия тел.Теплоемкость изотропных и однородных тел.Количество теплоты.
- •21.Работа.Первое начало термодинамики.Равновесные и неравновесные процессы.
- •23. Скорость звука в газах. Уравнение Бернулли.
- •24.Тепловая машина.Кпд цикла.Холодильная Машина.Цикл Карно.Кпд Карно.
- •25.Формулировка Клаузиуса и Томсона(Кельвина) второго начала темодинамики.Первая теорема Карно.Равенство Клаузиуса.
- •26.Энтропия,Энтропия идеального.Вторая теорема Карно.Неравенство Клаузиуса.Изменени энтропии при необратимых процессах.
- •27.Формулировка второго начала темодинамики с помощью энтропии.Роль энтропии в производстве.Статистический характер.
- •28.Термодтнамическое равновесие. Эмпирические шкалы температур Международная практическая шкала Термодинамическая шкала Отрицательные абсолютные температуры
- •29.Понятие о термодинамич потенциалах.Принцип Ле-Шателье-Брауна.
- •30.Силы межмолекулярного взаимодействия.Ионная связь.Ковалентная связь.Силы Ван-дер-Ваальса.Потенциал Ленарда-Джонса.
- •31.Ураынение Ван-дер-Вальса. Изотермы газа Ван-дер-Вальса. Правило Максвела. Метостобильное состояние
- •32. Приведенное уравнения Ван-дер-Вальса. Внутрения энергия газа ванн-дер-Вальса.
- •33. Эффект Джоуля-Томсана
- •34.Переход из газообразного в жидкое. Экспериментальные изотермы.
- •35. Поведение 2-х фазной сис-мы. Ур Клапейрона-Клаузиуса
- •36.Зависимость свойств реальных газов от идеальных..
- •37.Вириальное ур состояния.
- •38.Сжижение газов. Свойство веществ при температуре близктй к 0.
- •39.Свойства и структура жидкостей жидкие кристаллы. Теплоёмкость жидкостей.
- •40.Поверхностное натяжение. Условия равновесия на границе двух жидкостей и на границе жидкость – твердое тело.
- •41.Давление под искривленной поверхностью жидкости. Капиллярные явления.
- •43.Кипение. Перегретая жидкость. Пузырьковая камера. Переохлажденный пар. Камера Вильсона.
- •44.Жидкие растворы. Растворимость. Теплота растворения.
- •45.Идеальные растворы. Закон Рауля. Закон Генри. Зависимость растворимости от температуры.
- •46. Диаграмма состояния раствора. Кипение жидких растворов.
- •48. Фазовые переходы первого и второго рода. Кристаллизация и плавление. Сублимация. Фазовые диаграммы. Полиморфизм.
- •49.Симметрия твердых тел. Кристаллические решетки. Примитивная решетка. Элементы симметрии решетки. Обозначения атомных плоскостей и направлений.
- •50.Теплоёмкость твёрдых тел. Физические процессы в кристаллах при деформациях. Дислокации.
18.Теплоемкость идеального газа.Расхождение теории теплоемкостей.
.Теплоемкость идеального газа. Если частица идеального газа простая, то она имеет лишь три степени свободы
поступательного движения. Ее энергия равна 3/2кТ. Если же частица идеального газа сложная, то она обладает большим числом степеней свободы и, следовательно, большей энергией. Например, если сложная частица состоит
из двух точечных частиц, то имеются две возможности. Если точечные частицы между собой жестко связаны и
ведут себя наподобие твердой гантели , то сложная частица имеет пять степеней свободы: три поступательные и две вращательные (вращение вокруг оси, проходящей через точечные частицы, по определению, невозможно). В этом случае энергия частицы равна 5/2кТ. Если же
наряду с этим связь между частицами не жесткая и они могут совершать колебательное движение вдоль соединяющей их линии, то добавляются кинетическая энергия 1/2кТ и потенциальная энергия 1/2 k/T колебаний, т.е. еще две степени свободы. Всего при этом на одну сложную частицу приходится энергия 7/2 кТ. Аналогично можно рассчитать энергию более сложных частиц. Если сложная частица имеет i степеней свободы, то ее энергия 1/2 кТ.
В моле имеется Na частиц и, следовательно, внутренняя энергия моля идеального газа равна
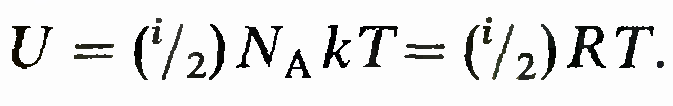
формулам получаем
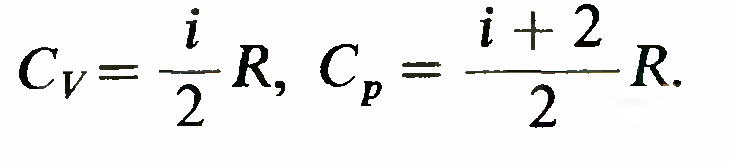
Расхождение теории теплоемкостей идеального газа с экспериментом. Эти простые формулы дают хорошее совпадение с экспериментом для одноатомных и многих двухатомных газов при комнатной температуре, например
водорода, азота, кислорода и др. Для них теплоемкость оказывается весьма близкой к Cv = 5/2R. Однако у двухатомного газа хлора С12 теплоемкость равна примерно 6/2R, что невозможно объяснить (у двух-
атомной молекулы в принципе Cv может быть равно либо 5/2R, либо 1/2R).
У трехатомных газов наблюдаются систематические отклонения от предсказаний теории. У жестких молекул трехатомных газов, если только
молекулы не лежат на одной прямой, теплоемкость должна быть 6/2R.
Эксперимент показал, что теплоемкость зависит от температуры, что находится в полном противоречии с формулами
Рассмотрим для примера более подробно теплоемкость молекулярного водорода. Молекула водорода двухатомна.
Достаточно разреженный водородный газ очень близок к идеальному и является удобным объектом для проверки
теории. Для двухатомного газа Cv равно либо 5/2R, либо 7/2R, но от температуры теплоемкость не должна зависеть, однако в действительности теплоемкость
молекулярного водорода зависит от температуры : при низкой температуре (в области 50 К) его теплоемкость
равна 3/2 R> ПРИ комнатной — 5/2R, а при очень высокой температуре теплоемкость становится равной 1/2R- Таким образом, молекула водорода ведет себя при низкой температуре как точечная частица, у которой отсутствуют
внутренние движения, при нормальной температуре — как жесткая гантель и наряду с поступательным движением
также совершает вращательные движения, а при очень высокой температуре к этим движениям добавляются. также колебательные движения атомов, входящих в молекулу. Дело происходит так, как будто благодаря изменению температуры происходит включение (или выключение) различных степеней свободы: при малой температуре включены лишь поступательные степени свободы, затем при повышении температуры включаются вращательные, а затем и колебательные степени свободы.
