
- •Введение
- •История изучения ферментов
- •Классификация
- •Скорость ферментативной реакции. Факторы, влияющие на ферментативную активность
- •Концентрация субстрата
- •Строение ферментов
- •Неорганические ионы (активаторы ферментов)
- •Простетические группы (фад, фмн, биотин, гем)
- •Коферменты (над, надф, кофермент а, атф)
- •Механизм действия ферментов Энергия активации. Принцип действия ферментов
- •Способы увеличения скорости реакции ферментами
- •Активный центр
- •Гипотеза “ключа и замка”. Гипотеза индуцированного соответствия
- •Свойства ферментов
- •Ферментативная кинетика Модель Михаэлиса-Ментен
- •График Лайнуивера-Бэрка в двойных обратных координатах
- •Ингибирование
- •Обратимое ингибирование
- •Конкурентное ингибирование
- •Неконкурентное ингибирование
- •Необратимое ингибирование
- •Аллостерические ферменты
- •Ингибирование конечным продуктом (ингибирование по принципу отрицательной обратной связи — ретроингибирование)
- •Регуляция активности фермента
- •Зимоген
- •Ковалентная модификация
- •Ингибирование по типу отрицательной обратной связи
- •Кооперативные эффекты
- •Симметричная модель
- •Последовательная модель
- •Аллостерическая регуляция
- •Глоссарий
- •Список использованной литературы
Симметричная модель
В этой модели предполагается, что каждый мультимерный ферментный комплекс может существовать по крайней мере в двух разных состояниях с неодинаковой четвертичной структурой, причем в каждом состоянии все субъединицы имеют одинаковую третичную.
В простейшей модели рассматриваются два состояния, находящиеся в равновесии друг с другом. В одном из них белок имеет высокое сродство с субстратом (R-состояние, от англ. relax — ослаблять), а в другом — низкое (T-состояние, от англ. tense — напрягать). Добавленный субстрат будет предпочтительно связываться с R-конформерами фермента, а связывание его с T-конформером приведет к возникновению напряжения в субъединицах фермента, что вызовет одновременный переход всех субъединиц в R-состояние (в котором напряжение отсутствует).
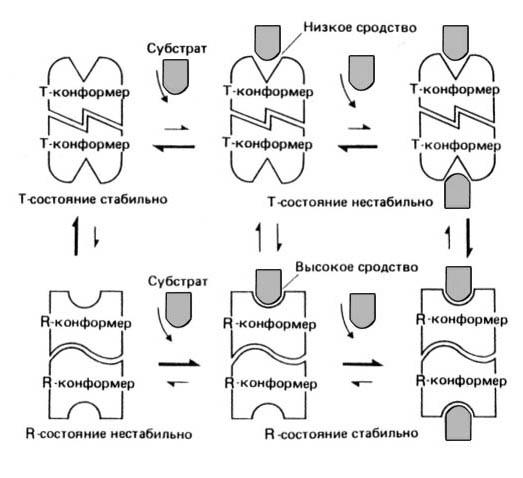
Рис. 17
При таком согласованном переходе сохраняется молекулярная симметрия каждой мультимерной молекулы. При дальнейшем добавлении субстрата все больше и больше молекул будет переходить из Т- в R-состояние. Такой сдвиг равновесия в присутствии субстрата представляет собой эффект положительной кооперативности. В результате этого эффекта график зависимости V от [S] будет иметь S-образную форму.
Последовательная модель
В этой модели предполагается, что отдельные субъединицы мультимерной молекулы могут в одно и то же время иметь разные третичные структуры. При этом связывание субстрата одной субъединицей может вызвать изменение третичной структуры соседней субъединицы (или соседних субъединиц) и в результате увеличивать (положительная кооперативность) или уменьшать (отрицательная кооперативность) их сродство к субстрату.
Аллостерическая регуляция
Представляет собой эффект, наблюдаемый в тех случаях, когда небольшие молекулы (эффекторы), связываясь с ферментом не в области активного центра, изменяют скорость реакции.
Подобная регуляция может быть гомотропной, когда молекула субстрата, взаимодействуя с ферментом, изменяет его сродство к молекулам того же субстрата, и гетеротропной, когда сродство к субстрату изменяется при взаимодействии фермента с молекулой, не похожей на молекулы субстрата.
Эффекторы активаторы ингибиторы
Активатор, действующий на фермент, описываемый симметричной моделью, будет связываться предпочтительно с R-конформером, стабилизируя его состояние. В результате активатор будет увеличивать начальную концентрацию R-конформеров по сравнению с концентрацией T-конформеров и, следовательно, увеличивать сродство фермента к своему субстрату (положительная кооперативность).
Ингибитор, наоборот, предпочтительно связывает и стабилизирует фермент, находящийся в T-состоянии, вызывая таким образом уменьшение сродства фермента к своему субстрату (отрицательная кооперативность).
В целом роль аллостерических эффекторов заключается в том, чтобы либо расширить (в случае ингибитора), либо сузить (в случае активатора) диапазон концентраций субстрата, в котором фермент способен увеличивать скорость реакции.
Глоссарий
ΔG‡ — энергия активации.
ΔG0 — свободная энергия.
Активный центр фермента — это особый участок молекулы белка, где может связываться субстрат (или субстраты) с образованием фермент-субстратного комплекса. Активный центр почти всегда состоит всего лишь из нескольких аминокислотных остатков.
Бесконкурентный ингибитор — молекула, которая связывается только с фермент-субстратным комплексом и не может связаться со свободным ферментом. В односубстратных ферментных системах этот тип ингибирования встречается довольно редко.
Ингибитор — молекула, которая, связываясь с ферментом, блокирует какую-то стадию ферментативной реакции.
Конкурентный ингибитор — молекула, настолько похожая по своей структуре на молекулу субстрата, что фермент не может различить их, она связывается с активным фермента.
Неконкурентный ингибитор — молекула, связывающаяся не с активным центром фермента, а с каким-то другим участком.
Субстрат — молекула (обозначаемая S), которая после взаимодействия с ферментом (Е) превращается в продукт (Р).
Фермент — белок, который увеличивает скорость биохимических реакций.
Энергия активации — энергия необходимая для того, чтобы заставить субстраты вступить в реакцию.
