
- •Введение
- •История изучения ферментов
- •Классификация
- •Скорость ферментативной реакции. Факторы, влияющие на ферментативную активность
- •Концентрация субстрата
- •Строение ферментов
- •Неорганические ионы (активаторы ферментов)
- •Простетические группы (фад, фмн, биотин, гем)
- •Коферменты (над, надф, кофермент а, атф)
- •Механизм действия ферментов Энергия активации. Принцип действия ферментов
- •Способы увеличения скорости реакции ферментами
- •Активный центр
- •Гипотеза “ключа и замка”. Гипотеза индуцированного соответствия
- •Свойства ферментов
- •Ферментативная кинетика Модель Михаэлиса-Ментен
- •График Лайнуивера-Бэрка в двойных обратных координатах
- •Ингибирование
- •Обратимое ингибирование
- •Конкурентное ингибирование
- •Неконкурентное ингибирование
- •Необратимое ингибирование
- •Аллостерические ферменты
- •Ингибирование конечным продуктом (ингибирование по принципу отрицательной обратной связи — ретроингибирование)
- •Регуляция активности фермента
- •Зимоген
- •Ковалентная модификация
- •Ингибирование по типу отрицательной обратной связи
- •Кооперативные эффекты
- •Симметричная модель
- •Последовательная модель
- •Аллостерическая регуляция
- •Глоссарий
- •Список использованной литературы
Строение ферментов
Фермент Белковая часть (апофермент) Небелковая часть (кофактор) неорганический ион коферменты простетические группы апофермент + кофактор = голофермент
Роль кофакторов могут играть различные вещества — от простых неорганических ионов до сложных органических молекул; в одних случаях они остаются неизменными в конце реакции, в других — регенерируют в результате того или иного последующего процесса.
Если кофактор представлен в виде органической молекулы (некоторые из таких молекул близки к витаминам), то последняя может быть прочно связана с ферментом (в этом случае ее называют простетической группой) или слабо с ним связана (и тогда ее называют коферментом).
Неорганические ионы (активаторы ферментов)
Ионы заставляют молекулы фермента или субстрата принять форму, способствующую образованию E-S-комплекса. Тем самым увеличиваются шансы на то, что фермент и субстрат действительно прореагируют друг с другом, а следовательно, возрастает и скорость реакции, катализируемой данным ферментом.
Пример. Активность амилазы слюны повышается в присутствии хлорид-ионов.
Простетические группы (фад, фмн, биотин, гем)
Данная органическая молекула занимает такое положение, в котором она может эффективно содействовать каталитической функции своего фермента.
Пример 1. Флавинадениндинуклеотид (ФАД) содержит рибофлавин (витамин B2), который является водород акцепторной частью его молекулы. Функция ФАД связана с окислительными путями клетки, в частности с процессом дыхания, в котором ФАД играет роль одного из переносчиков в дыхательной цепи:

Конечный результат: 2H переносятся к A и B. В качестве связующего звена между A и B действует голофермент.

Рис. 8 Витамин как компонент простетической группы (представлена структура ФАД — флавинаденин динуклеотид).
Пример 2. Гем — это железосодержащая простетическая группа. Его молекула имеет форму плоского кольца, в в центре которого находится атом железа (порфириновое кольцо, такое же, как у хлорофилла). Гем выполняет в организме ряд биологически важных функций. Перенос электронов. В качестве простетической группы цитохромов гем выступает как переносчик электронов. Присоединяя электроны, железо восстанавливается до Fe(II), а отдавая их, окисляется до Fe(III). Гем, следовательно, принимает участие в окислительно-восстановительных реакциях за счет обратимых изменений валентности железа. Перенос кислорода. Гемоглобин и миоглобин — два гемсодержащих белка, осуществляющих перенос кислорода. Железо находится в них в восстановленной форме. Каталитическая функция. Гем входит в состав каталаз и пероксидаз, катализирующих расщепление перекиси водорода и воды.
Коферменты (над, надф, кофермент а, атф)
Пример. Никотинамидадениндинуклеотид (НАД), производная никотиновой кислоты, может существовать как в окислительной, так и в восстановительной форме. В окислительной форме НАД при катализе играет роль акцептора водорода:
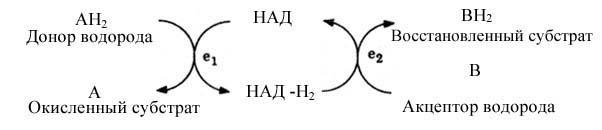
Здесь E1 и E2 — две различные дегидрогеназы. Конечный результат: 2H переносятся от A к B. Здесь в качестве связующего звена между двумя различными ферментными системами E1 и E2 действует кофермент.

Рис. 9 Витамин как компонент кофермента (представлены структуры НАД, НАДФ и АТФ).
