
- •Глава 4. Электрометаллургия кремния и карбида кремния
- •4.1. Свойства кремния и его соединений
- •4.2. Теоретические основы восстановления кремния углеродом
- •4.3. Сортамент кристаллического кремния и качество исходных шихтовых материалов
- •4.4. Технология выплавки кристаллического кремния
- •4.5. Технология производства карбида кремния
4.2. Теоретические основы восстановления кремния углеродом
Балансовая реакция, характеризующая процесс восстановления кремния из кремнезема углеродом, при получении кристаллического кремния может быть представлена в следующем виде:
SiО2
+
2С
= Si
+
2СО;
KP
=
![]() ;
;
∆G![]() = 697390 – З59,07Т,
Дж/моль.
= 697390 – З59,07Т,
Дж/моль.
Теоретическая
температура начало реакции (∆G![]() = 0) 1942 K
(1669оС).
= 0) 1942 K
(1669оС).
Однако реально процесс восстановления кремния углеродом при различных температурах протекает через стадии образования промежуточных продуктов SiОгаз и SiСт, которые необходимо учитывать при термодинамическом анализе для правильного прогнозирования параметров технологии выплавки кристаллического кремния. Поэтому термодинамический анализ реакций восстановления Si из SiO2 углеродом может быть сведен к задаче выявления особенностей фазовых равновесий в системе Si–О–С.
Диаграмма фазовых равновесий в системе Si–О–С с учетом термодинамического анализа минимально необходимого комплекса простых реакций была рассчитана Н.В. Толстогузовым, И.С. Рябчиковым, С.М. Мазмишвили и др., что позволило уточнить термодинамику процессов в этой системе. Приняты следующие основные реакции, описывающие равновесие конденсированных фаз с газовой:
1) SiO2 + С = SiОгаз + СОгаз;
lgK1 = lg(pSiOpCO) = –35444/Т + 17,19,
2) 2SiO2 + SiС = ЗSiОгаз + СОгаз;
lgK2
=
lg![]() = –75294/Т
+
34,45,
= –75294/Т
+
34,45,
3) SiОгаз + 2С = SiС + СОгаз;
lgK3 = lg(pCO/pSiO) = 4583/Т – 0,141,
4) SiО2 + Siж = 2SiОгаз;
lgK4
=
lg![]() = –33020/Т
+ 15,05,
= –33020/Т
+ 15,05,
5) SiОгаз + SiС = 2Siж + СОгаз;
lgK5 =lg(pCO/pSiO) = –9239/Т + 4,36,
6) SiОгаз + С = Siж + СОгаз,
lgK6
=
lg![]() =
–2424/Т
+
2,14.
=
–2424/Т
+
2,14.
Используя эти уравнения для констант реакций, отношение рSiO/pCO для реакций 3, 5, 6 определяют из выражения: pSiO/pCO = 1/KP, для реакции 4 из уравнения:
![]() ,
,
для реакций 1 и 2 нужны решения системы уравнений:
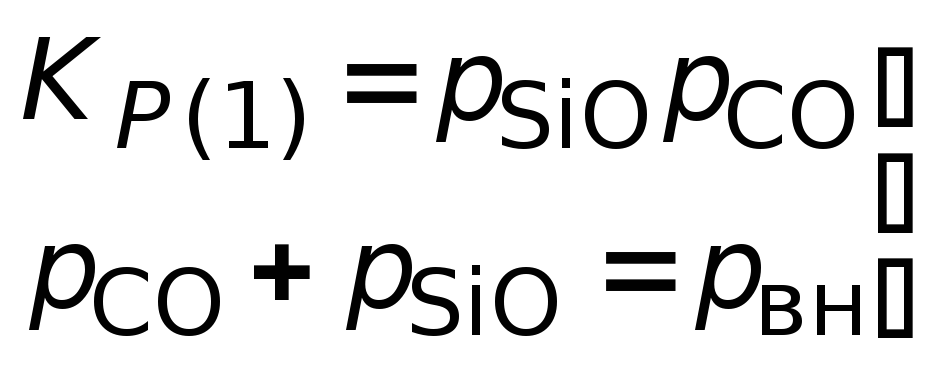 для
реакции 1.
для
реакции 1.
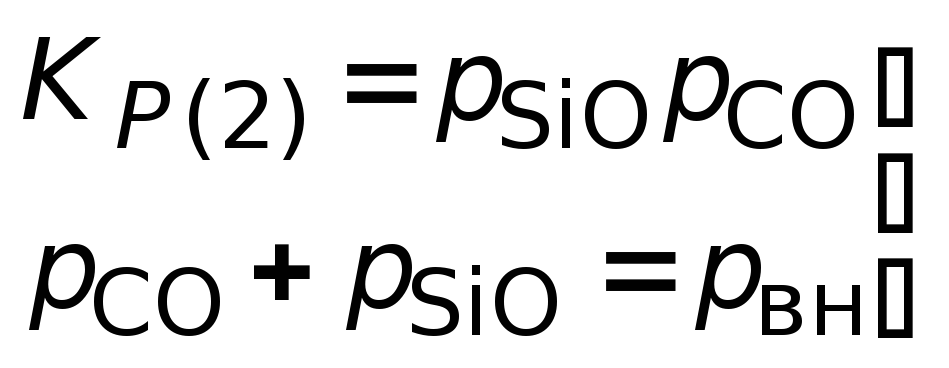 для
реакции 2.
для
реакции 2.
Результаты расчетов представлены в виде диаграммы в координатах рSiO/pCO = f(1/Т) для случая рвн = 101 кПа (рис. 4.7).

Рис. 4.7. Диаграмма зависимости lg(pSiO/pCO) от температуры
в системе Si–O–С
На рис. 4.7 кривые 1–6 описывают равновесие соответствующих реакций и характеризуют условия сосуществования (при определенных значениях lg(pSiO/pCO) и температур) следующих конденсированных фаз: 1 – SiO2 и С; 2 – SiO2 и SiС; 3 – SiС и С; 4 – SiО2 и Si; 5 – SiС и Si; 6 – С и Si.
В отличие от реакций 1, 2 и 4 для реакций 3, 5, 6 зависимости lg(pSiO/pCO) от температуры характеризуются прямыми линиями 3, 5 и 6. Пересечением линий поле диаграммы разграничивается на области устойчивости следующих конденсированных фаз: I – SiO2; II – С; III – SiС; IV – Si.
Характеристика нонвариантного равновесия в точках А, Б, В, Г с газовой фазой SiOгаз – CO:
А – нонвариантное стабильное равновесие трех конденсированных фаз SiO2, Si и С; координаты точки Т = 1796 K (1523оС); pSiO/pCO = 0,00575 при pвн = 101,3 кПа.
Б – нонвариантное стабильное равновесие конденсированных фаз SiO, SiC и Si; координаты точки Б: Т = 2090 K (1817оС); pSiO/pCO = 1,6.
В – нонвариантное стабильное равновесие конденсированных фаз Si, SiC, C; координаты точки В: Т = 3193 K (2920оС); pSiO/pCO = 0,0578.
Г – метабильное равновесие конденсированных фаз SiO2, C, Si; ее положение при pвн = 101,3 кПа характеризуется координатами Т = 1929 K (1656оС).
