
- •«Амінокислотний склад і структура білків»
- •Теоретичне обґрунтування теми:
- •Амінокислоти
- •Таблиця 1. Класифікація амінокислот за полярністю радикалу Неполярний радикал
- •5.2. Пептидний зв'язок. Пептиди
- •Деякі гормони пептидної природи
- •Структура білків
- •Первинна структура
- •Фактори, які викликають специфічний гідроліз пептидних зв’язків
- •Вторинна структура
- •Третинна структура
- •Четвертинна структура
- •Фізико-хімічні властивості білків
- •Класи білків. Структурно-функціональна характеристика окремих представників
- •Структура та властивості фібрилярних білків
- •Лабораторна робота «Кольорові реакції на білки і амінокислоти»
- •Запитання і завдання для самоконтролю
- •Література
Структура білків
За хімічною будовою білки є поліпептидами. Внаслідок взаємодії функціональних груп поліпептиду між собою і з оточуючим середовищем він набуває специфічної просторової форми. Тільки в цій формі він є біологічно активним. Для спрощення опису просторової форми білкових молекул користуються поняттям про рівні структурної організації (Ліндерстрем-Ланг).
Первинна структура
Первинна структура білків - це порядок розташування амінокислотних залишків в нерозгалуженому поліпептидному ланцюгу:
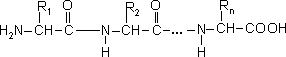
В ланцюгу білка чергуються пептидні групи і a-вуглецеві атоми. Амінокислотні радикали не беруть участі в утворенні зв’язків на цьому рівні. Однак порядок їх розташування має вирішальне значення для просторової форми молекули. Дипептид, який складається з двох різних амінокислот (А і Б), може мати дві різні послідовності "АБ" і "БА". Для трьох амінокислот число варіантів складає 6. Із 20 різних амінокислот можна побудувати 10130 різних послідовностей по 100 залишків в кожній. Уявимо, що хоч по одній із таких молекул є в природі. Скручені в компактні клубочки, вони зайняли б 1027 (тисяча квадрильйонів) об'ємів Всесвіту. Зрозуміло, що лише мала частка можливих комбінацій послідовностей використовується природою.
Розшифровка амінокислотної послідовності стала дуже важливим етапом у вивченні білків. Першим дослідженим білком став інсулін - гормон підшлункової залози (Ф. Сенгер, 1945 – 1954 р.р.). Як показав Сенгер, молекула бичачого інсуліну, складається з двох ланцюгів: А (21 амінокислотний залишок) і В (30 амінокислотних залишків), з’єднаних між собою дисульфідними містками між залишками цистеїну. Ще один такий місток утворюється всередині ланцюга А:
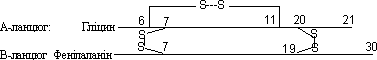
Методичні основи аналізу первинної структури, розроблені Ф. Сенгером, полягають в дії на чистий білок різних факторів (кислот, ферментів), які специфічно гідролізують лише певні пептидні зв'язки (Табл.3). В кожному випадку одержується декілька пептидів, для яких визначити склад і послідовність амінокислотних залишків легше, ніж для великої молекули. Співставлення послідовностей коротких фрагментів дозволяє виявити місця перекривання. N-кінцеві залишки амінокислот визначаються за допомогою динітрофторбензолу.
Таблиця 3.
Фактори, які викликають специфічний гідроліз пептидних зв’язків
|
Фактор |
Зв’язок -СН(R1)-CO-½-NH-CH(R2)- |
|
Фермент трипсин |
R1 – ліз, арг |
|
Фермент хімотрипсин |
R1 - фен, тир, три |
|
Фермент пепсин |
R2 – фен, три, асп, тир, лей, глу |
|
Бромціан |
R1 - мет |
|
Фермент карбоангідраза |
R2 – С-кінцевий залишок |
Пояснимо цей підхід на простому прикладі. Нехай при гідролізі пентапептиду невідомої будови трипсином (а) і хімотрипсином (б) одержали два різних набори фрагментів: а) H2N-лей-фен-глі-СООН і H2N-ала-ліз-СООН; б) H2N ала-ліз-лей-фен-СООН і глі. Як видно, спільною послідовністю є -лей-фен-. Вона не може бути N кінцевою, так як розташовується в кінці пептиду (б). Зіставимо результати двох дослідів:
H2N-ала-ліз-СООН + H2N-лей-фен-глі-СООН
H2N ала-ліз-лей-фен-СООН + глі
Отже, структура пентапептиду така: H2N ала-ліз-лей-фен-глі-СООН.
Зараз .первинна структура білків визначається з використанням автоматичного приладу - секвенатора, в якому від поліпептидного ланцюга послідовно відщеплюються N-кінцеві амінокислоти та ідентифікуються. Для цього визначення не можна використовувати реактив Сенгера, так як при його дії гідролізується весь ланцюг. Тому застосовують фенілізотіоціанат (реактив Едмана), який, на відміну від реактиву Сенгера, дозволяє відщеплювати послідовно кожну кінцеву амінокислоту у вигляді фенілтіогідантоїнового похідного, не руйнуючи всього ланцюга, і визначати її хроматографічно.
На наш час з’ясована первинна структура більше двох тисяч природних білків. При порівнянні первинних структур гомологічних білків, тобто тих, які виконують однакові функції у різних видів організмів, виявилось, що вони подібні за величною і в багатьох положеннях містять однакові (інваріантні) залишки амінокислот. Поряд з цим, інші залишки (варіабельні) можуть істотно відрізнятись у різних видів. Це свідчить про вирішальну роль інваріантних ділянок для просторової структури і біологічної функції білків-гомологів. Крім того, виявилось, що ступінь відмінності в первинній структурі гомологічних білків пропорційний ступеню філогенетичної відмінності між видами. Таким чином, порівняння первинної структури гомологічних білків можна використовувати для побудови еволюційного дерева, яке відображає послідовність появи і розвитку організмів
