
- •2. За характером прояву:
- •12.1. Сутність методу. Осаджувана і гравіметрична форми
- •1. Методи кислотно-основного титрування (методи нейтралізації).
- •2. Методи осадження.
- •2. Методи комплексоутворення.
- •3. Методи окислення-відновлення (редоксиметрія).
- •3. Титрування замісника (або титрування по заміщенню).
1. Методи кислотно-основного титрування (методи нейтралізації).
Сюди відносяться визначення, основані на взаємодії кислот і основ,
тобто на реакції нейтралізації:
H+ + OH– = H2O
Якщо титрант – кислота, то метод називається ацидиметрія, а якщо основа – алкаліметрія.
2. Методи осадження.
Наприклад, метод аргентометрії застосовується для визначеннягалогенід-іонів і срібла:
Ag+ + X– = AgX↓,
де X– – Cl–, Br–, I–
2. Методи комплексоутворення.
Методи меркуриметрії і комплексонометрії засновані на реакціяхутворення координаційних сполук:
Hg2+ + 2Cl– = HgCl2
Mе2+ + H2Y2- = MеY 2- + 2H+
3. Методи окислення-відновлення (редоксиметрія).
Якщо титрантом є KMnО4 – перманганатометрія, K2Cr2O7 – дихроматометрія, бромат калію KBrО3 – броматометрія, солі Се4+ – церіметрія і т.д.
20.Способи титриметричного аналізу
1. Пряме титрування –визначувана речовина безпосередньо реагуєз титрантом.
Зворотне титрування.
До аналізованого розчину спочатку додають відомий надлишок титрованого розчину. Наприклад, при осаджувальному аргентометричному титруванні до аналізованого розчину спочатку додають надлишок розчинуAgNO3:
Аg+ + Cl– = АgCl↓
Залишок AgNO3 титрують розчином роданіду амонію
Ag+ + SCN– = AgSCN↓
3. Титрування замісника (або титрування по заміщенню).
До визначуваної речовини додають спеціальний реагент, що вступає з нею у реакцію. Один із продуктів взаємодії титрують робочим розчиномтитранта. Наприклад, при йодометричному визначення міді титрують йод,який утворюється в реакції:
2Cu2+ + 4I– = 2CuI↓ + I2
Йод, що виділився, титрують розчином тіосульфату натрію:
I2 + 2S2O32– = 2I– + S4O62-
21.Характеристика методу кислотно-основного титрування
У кислотно-основному титруванні як робочі розчини використовують розчини сильних кислот (HCl, H2SO4) або сильних основ (NaOH, KOH, Ba(OH)2) концентрації від 0,05 до 1 моль/л. Розчини кислот стійкі і можуть довго зберігатися. Розчини лугів зберігають у парафінованому або фторопластовому посуді, щоб не допустити взаємодії зі склом. Розчини лугів поглинають CO2 з повітря.
22.Робочі розчини в кислотно-основному титруванні, їх приготування та стандартизація.
Приготувати розчин точної концентрації кислоти або лугу із продажних реактивів не можна. Точну концентрацію розчинів установлюють по одному з первинних стандартів.
23.Первинні та вторинні стандарти. Фіксанали.
До первинних стандартів висувають жорсткі вимоги:
1) речовина повинна бути хімічно чистою;
2) склад речовини повинен строго відповідати хімічній формулі (наприклад, повинна бути певна кількість кристалізаційної води H2C2O4·2H2O);
речовина повинна бути стійкою при зберіганні;
бажано можливо більша величина молярної маси еквівалента.
Стандартизація кислот
Для стандартизації розчинів кислот частіше використовується Na2CO3 або Na2B4O7·10H2O. Фактор еквівалентності декагідрата тетрабората натрію (бури) дорівнює ½:
Na2B4O7+2HCl+5H2O ↔ 4H3BO3+2NaCl
Стандартизація лугів
Розчини лугів стандартизують за щавлевою і бензойною кислотами, гідрофталатом калію:
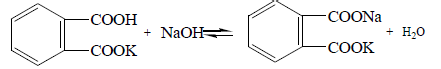
Значно скорочують час при готуванні титрованих розчинів фіксанали.Фіксанали містять у спеціальних ампулах точно відомукількість речовини. Розчинення або розведення вмісту фіксаналу в мірній колбі дозволяє відразу одержати титрований розчин.
24.Способи встановлення точки еквівалентності
Способи фіксування точки еквівалентності:
візуальні – за допомогою індикаторів і без індикаторів;
з використанням фізико-хімічних методів.
Для вибору методу виявлення точки еквівалентності треба побудувати криву титрування. Крива титрування – це графічне зображення залежності якого- небудь параметра системи, пов'язаного з концентрацією визначуваного іона, від об'єму доданого титранта. У кислотно-основному титруванні цим параметром є рН, тобто крива титрування – це залежність рН розчину, що титрують, від об'єму титранта.
25.Індикатори кислотно-основного титрування. Природні та синтетичні індикатори
Першими індикаторами були розчини рослинних екстрактів. Наприклад, один з найвідоміших реактивів лакмус – це витяжка із квіток фіалки ( фіалковий сироп – роцелла красильна). Використовували також витяжку з волошки, кошенілі. Лакмус містить азолітмінову кислоту, що і є індикатором. Багато рослинних пігментів можуть бути використані як кислотно-основні індикатори.
Першим синтетичним індикатором був фенолфталеїн
26.Іонна та хромофорна теорії індикаторів.
Іонна теорія індикаторів
За хімічною природою кислотно-основні індикатори являють собою слабкі органічні кислоти або основи, що частково дисоціюють в розчині. Тобто у розчинах індикатори можуть існувати в іонізованій і неіонізованій формах.
Хромофорна теорія індикаторів
Зміна кольору індикатора пов'язана з істотною зміною його молекулярної структури. Колір сполуки пов'язаний з наявністю в її молекулі так званих хромофорних груп.
27.Інтервал переходу забарвлення, показник титрування індикатора у кислотно-основному титруванні. Принцип вибору індикатора.
Інтервал переходу забарвлення індикатора повинен повністю або частково перекриватися стрибком титрування . Якщо такогоперекривання немає, то індикатор для даного титрування не підходить.
Індикатори кислотно-основного титрування змінюють будову і властивості при зміні рН середовища.
28.На чому ґрунтуються методи окисно-відновного титрування? Класифікація методів
Окисно-відновне титрування засноване на використанні в якості титрантів розчинів окислювачів або відновників, що вступають у редоксреакції з визначуваною речовиною. Класифікують методи окисно-відновного титрування за природою речовини, яку використовують у якості титранту
29.Перманганатометрія. Характеристика методу. Способи фіксування точки еквівалентності.
Перманганатометричний метод аналізу заснований на реакціях перманганату калію з відновниками.
Титрування проводять як у кислому, так і в нейтральному і лужному
Однак з міркувань простоти розрахунку до точки еквівалентності потенціал системи доцільно розраховувати за першим рівнянням, а після точки еквівалентності – за другим
30.Індикатори окисно-відновного титрування. Інтервал переходу забарвлення окисно-відновних індикаторів. Вибір індикаторів
Стан у розчині та, отже, колір кислотно-основних індикаторів, залежить від рН середовища. Аналогічно окисно-відновні індикаторизмінюють свій колір при зміні окисно-відновного потенціалу розчину, який титрують.
Індикатор підбирають таким чином, щоб потенціал переходу індикатора перебував у межах стрибка потенціалу на кривій титрування. Багато індикаторів окисно-відновного титрування мають кислотні або основні властивості і можуть змінювати свою поведінку залежно від pН розчину. Тобто титрування треба вести при певному значенні pН (наприклад, дифеніламін застосовують у кислому середовищі)
31.Що складає основу йодометричних методів? Які речовини визначають цим методом?
Основу йодометричних методів становить напівреакція:
I2 + 2℮ = 2I–; E°I2/2I− = 0,545B
Це рівняння записане схематично, тому що в практиці для збільшення розчинності йоду використовують розчини йоду в KI, а в цій системі утворюються йодидні комплекси I3–.
Цим методом можна визначати як окисники, так і відновники, тому що значення редокспотенціалу даної пари займає проміжне положення серед інших потенціалів.
32.Робочі розчини йодометрії, їх приготування та стандартизація. Фактори, які впливають на стійкість цих розчинів.
1. Визначення арсеніту.
AsО2– + I2 + 2H2O ↔ HAsО42– + 2I– + 3H+
Титрування проводять у середовищі близькому до нейтрального в присутності гідрокарбонату натрію NaHCO3.
2. Визначення олова проводять у солянокислому середовищі в атмосфері CO2 для запобігання окислювання олова(II) киснем повітря. Перед титруванням олово відновлюють металевим алюмінієм.
SnCl+ + I2 + 3Cl–↔SnCl4 + 2I–
3. Визначення формальдегіду, цукрів, ацетону, спиртів.
HCOH + I2 + 2OH–↔ HCOOH + 2I– + H2O
формальдегід
СH3COCH3 + 3I2 + 4OH– = CHI3 + CH3COO– + 3I– + 3H2O
ацетонйодоформ
У більшості методик окислювання органічної речовини йодом проводять у лужному розчині, а потім розчин підкислюють і надлишок йоду титрують тіосульфатом натрію.
4. Визначення води.
Для йодометричного визначення води в органічних розчинниках і інших матеріалах використовують реактив Фішера, що складається з йоду, двооксиду сірки та піридину в метанолі. Аналізовану пробу вносять у метиловий спирт і визначають воду титруванням зазначеним реактивом. Спрощено реакція титрування може бути представлена рівнянням:
SO2 + I2 + H2O + CH3OH + 3SC5H5N = 2C5H5NHI + C5H5NHOSO2OCH3
Кінець титрування можна помітити візуально по появі коричневого забарвлення комплексу йоду з піридином.
33.Основні умови йодометричних визначень.
1. Титрування не можна проводити в лужному розчині. У лужномурозчині йод утворює гіпойодит- і йодид-іони:
I2 + 2OH– = IO– + I– + H2O
pН повинен бути <7.
2. Титрування ведуть на холоді.
Йод – летка речовина. Крім того, з підвищенням температури знижується чутливість крохмалю як індикатора.
Розчинність йоду у воді мала, тому застосовують значний надлишок KI.
Швидкість реакції між визначуваним окисником і I–-іонами часто недостатня. Тому до титрування йоду приступають лише через деякий час після додавання окислювача.
Реакційну суміш зберігають у темряві, тому що світло прискорює в кислих розчинах побічну реакцію окиснення I–-іонів до I2:
I– + 4H+ + O2↔ 2I2 + 2H2O
34.Які титранти використовують в комплексонометричному титруванні? Які органічні реактиви називають комплексонами?
сполук (хелатів) металів зі спеціальними органічними комплексоутворюючими реактивами – амінополікарбоновими кислотами (комплексонами).
Хоча число різних комплексонів зараз становить не одну сотню, під терміном «комплексонометричне титрування» зазвичай мають на увазі титрування солями етилендіамінтетраоцтової кислоти (ЕДТА), найчастіше розчином її двохзаміщеної натрієвої солі Na2H2Y·2H2O (комплексон III), що широко відомий під торговою назвою трилон Б.
35.Особливості протікання реакцій катіонів металів з комплексонами.
Зауважимо, що катіони багатьох важких двовалентних металів можна титрувати у помірно кислих розчинах, а іони заліза(III) – у сильнокислому середовищі
36.Металохромні індикатори і вимоги до них. На чому основана їх дія?
У комплексонометрії використовують різні індикатори. Але частіше інших – металохромні індикатори. Вони у вільному стані мають один колір, а в комплексі з металом – інший.
Вимоги до металохромних індикаторів:
комплекс металу з індикатором, що утворюється, повинен бути слабкіше, ніж комплекс металу з ЕДТА (приблизно в 10-100 разів);
інтервал переходу індикатора повинен перебувати в межах стрибка титрування.
Було помічено, що коли після роботи з урамілдіоцтовою кислотою колбу мили водопровідною водою, відбувалася різка зміна кольору.
37.Яких умов необхідно додержуватись при комплексонометричному титруванні?
