
- •2. За характером прояву:
- •12.1. Сутність методу. Осаджувана і гравіметрична форми
- •1. Методи кислотно-основного титрування (методи нейтралізації).
- •2. Методи осадження.
- •2. Методи комплексоутворення.
- •3. Методи окислення-відновлення (редоксиметрія).
- •3. Титрування замісника (або титрування по заміщенню).
12.1. Сутність методу. Осаджувана і гравіметрична форми
Гравіметричний аналіз заснований на визначенні маси речовини. У ході гравіметричного аналізу визначувана речовина або відганяється увигляді якої-небудь леткої сполуки (метод відгону), або осаджується з розчину у вигляді малорозчинної сполуки (метод осадження
Аналітичний сигнал – маса.
Гравіметрія – безеталонний метод.
Похибка визначення складає 0,1 – 0,2 %.
8.Схема гравіметричного визначення речовин методом осадження
Осадження сполуки, що містить визначувану речовину (при цьому одержують осаджувану форму). Сполука, у вигляді якої осаджуваний компонент осаджується з розчину, називається осаджуваною формою.
Фільтрування отриманої суміші для відділення від надосадової рідини.
Промивання осаду для видалення адсорбованих домішок з його поверхні.
Висушування або прожарювання при високій температурі для перетворення осаду в більш відповідну для зважування форму. Сполука, у вигляді якої проводять зважування, називається гравіметричною формою.
Зважування отриманого осаду.
9.Осаджувальна і гравіметрична форми осадів та вимоги до них
Вимоги до осаджуваної форми:
1. Мала розчинність, тому що визначуваний елемент повинен виділятися в осад кількісно (ДР < 10-8).
Осад повинен виділятися у формі, зручній для його відділення від розчину і промивання. Бажано отримати крупнокристалічний осад.
Осад повинен бути чистим.
Форма, що осаджується, повинна легко і повністю перетворюватися в гравіметричну форму.
Вимоги до гравіметричної форми:
1.Точна відповідність її складу хімічній формулі.
Однак багато осадів не задовольняють цим вимогам. Наприклад, Fe(OH)3 містить змінну кількість води і осад треба прожарити до одержання сполуки цілком певного складу:
2 Fe(OH)3 = Fe2O3 + 3H2O
2. Хімічна стійкість гравіметричної форми.
Якщо гравіметрична форма буде поглинати CO2 або пари води, окислюватися і т.д., то неможливо буде вести розрахунок, і важко буде працювати.
3. Бажано, щоб вміст визначуваного елемента в гравіметричній формі був як можна меншим. Тобто щоб молекулярна маса сполуки, яка зважується, була якнайбільше. Тоді помилки при зважуванні або втрати від розчинності осаду будуть менше.
10.Осаджувачі в гравіметричному аналізі.
Осаджувач по можливості повинен бути леткою речовиною.Осаджувач частково залишається на осаді. Якщо осаджувач летка речовина, то його не видалена частина при прожарюванні випаровується.
11.Аморфні та кристалічні осади. Схема утворення осадів.
За формою осади можна розділити на кристалічні і аморфні (існують також скритнокристалічні осади, структура яких чітко видна придослідженнях рентгенографічними методами , але зовні вони нагадують аморфні осади, наприклад, AgCl). Утворення чистих крупнокристалічних осадів є необхідною умовою одержання точних результатів у гравіметричному аналізі. Крупнокристалічні осади виходять більш чистими, ніж дрібнокристалічні або аморфні, тому що мають менш розвинену поверхню і тому адсорбують менше домішок і, крім того, крупнокристалічні осади легко фільтруються.
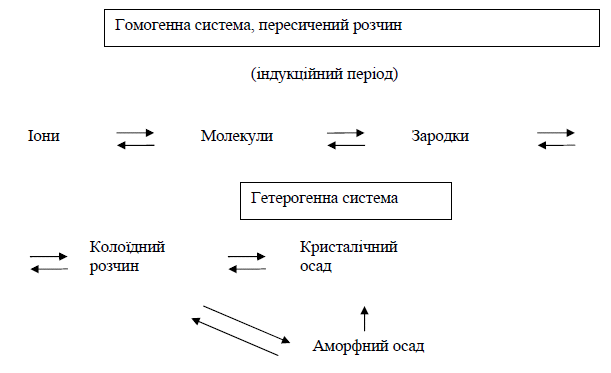
12.Умови утворення аморфних осадів
Сполуки з ковалентним або малополярним зв'язком, з обмеженою розчинністю, а також схильні до гідратації, утворюють аморфні осади(SiО2·nH2O, Fe2O3·nH2O)
13.Умови утворення кристалічних осадів
Сполуки з полярним зв'язком, що мають порівняно високу розчинність, проявляють схильність до утворення кристалічних осадів,наприклад, BaSO4, CaС2O4·H2O, MgNH4PO4·6H2O.
14.Забруднення осадів та способи його запобігання
Дрібнокристалічні осади можуть забивати пори фільтра, і тоді швидкість фільтрування падає практично до нуля. Таким чином, для одержання чистих осадів, які легко фільтруються , необхідно передбачити умови осадження, при яких утворюються саме крупні кристали.
15.Електрогравіметричний аналіз. Принцип методу.
Електрогравіметричний аналіз заснований на електролітичномувиділенні металів і зважуванні отриманого на електроді осаду металу.
Метод заснований на законі Фарадея:
![]()
де m – маса речовини, що виділилася при електролізі, г;
I – сила струму, А; t – час електролізу, сек;
Q = I·t – кількість електрики, витраченої на електрохімічну реакцію, Кл;
96500 Кл/моль – число Фарадея, рівне кількості електрики, яка потрібна для виділення моля речовини ;
M – молярна маса речовини;
n – число електронів,
η – вихід за струмом.
16.У чому суть термогравіметричного аналізу?
Термогравіметричні методи засновані на вимірі маси аналізованоїречовини при її безперервному нагріванні в заданому температурному інтервалі (найчастіше від кімнатної температури до заданої). Вимір звичайно проводять на спеціальних приладах – дериватографах, обладнаних спеціальними термотерезами безперервного зважування, електропіччю для нагрівання зразка, термопарами для виміру температури, еталоном для порівняння і самописом, що безупинно записує зміну маси речовини, яка нагрівається.
17.На чому ґрунтується метод титриметричного аналізу?
Титриметричний аналіз заснований на точному вимірі об'ємів розчинів 2-х речовин, що вступають між собою в реакцію. В основі методу лежить закон еквівалентів – речовини реагують між собою в еквівалентних кількостях:
C1·V1 = C2·V2
18.Вимоги до реакцій, які використовуються в титриметричному аналізі.
Вимоги до реакцій, які застосовують у титриметричному аналізі:
Реакція повинна протікати кількісно, тобто її константа рівноваги повинна бути досить велика.
Реакція повинна протікати з великою швидкістю.
Реакція не повинна ускладнюватися протіканням побічних реакцій.
Повинен існувати спосіб визначення закінчення реакції, тобто точки еквівалентності.
19.Класифікація методів титриметрії
