
- •Министерство сельского хозяйства рф
- •Раздел 1 Техническая термодинамика
- •Глава 1 Законы термодинамики
- •1.2. Законы термодинамики
- •Глава 2 термодинамические свойства рабочих тел
- •2.1. Рабочее тело тепловых машин
- •2.2. Теплоемкость гав и газовых смесей
- •2.3. Термодинамические процессы
- •Глава 3 пар и влажный воздух
- •3.1. Парообразование жидкостей
- •3.2. Влажный воздух
- •Глава 4 термодинамика газового потока
- •4.1. Уравнения и параметры движущегося газа
- •4.2. Течение газа в каналах
- •Глава 5 Циклы тепловых машин
- •5.1. Цикл Карно
- •5.2. Идеальные циклы поршневых двс
- •5.3. Идеальный цикл газотурбинного двигателя
- •15.4. Цикл паросиловой установки
- •5.5. Цикл универсальной тепловой машины Стирлинга
- •5.6. Циклы компрессоров
- •5.7. Циклы холодильных машин
- •Раздел II Основы теории теплообмена
- •Глава 6. Теплопроводность
- •6.1. Терминология теплообмена
- •6.2. Сущность теплопроводности
- •6.3. Стационарная теплопроводность
- •6.4 Понятие о решении задач нестационарной теплопроводности
- •Глава 7 Конвективный теплообмен
- •7.1. Теплоотдача
- •7.2. Основы теории теплового подобия
- •7.3. Теплоотдача при естественной конвекции
- •7.4. Теплоотдача при вынужденной конвекции
- •7.5. Теплоотдача при изменении агрегатного состояния
- •Глава 8 Лучистый теплообмен
- •8.1. Закономерности лучистого теплообмена
- •8.2. Лучистый теплообмен между телами, разделенными
- •8.3. Лучистый теплообмен в камерах сгорания
- •Теплопередача и теплообменные аппараты
- •9.1. Уравнение теплопередачи
- •9.2. Теплопередача через плоскую и цилиндрическую стенки
- •9.3. Теплопередача через оребренную стенку
- •9.4. Интенсификация теплопередачи
- •9.5. Тепловая защита
- •9.6. Теплообменные аппараты
- •9.7 Тепловые трубы
- •Приложение
- •Соотношения между единицами давления
- •Теплофизические свойства металлов и сплавов
2.3. Термодинамические процессы
2.3.1. Понятие термодинамического процесса
Общее представление о состоянии системы и ее изменениях (процессах) изложено в подпункте 1.1.3.
Термодинамический процесс – это определенная последовательность изменения параметров состояния рабочего тела системы.
Термодинамические процессы могут быть равновесными и неравновесными, обратимыми и необратимыми. Если изменение состояния термодинамической системы протекает с нарушением ее внутреннего равновесия, то имеет место неравновесный термодинамический процесс. Реальные процессы, наблюдаемые в природе, в эксперименте, в машинах, являются неравновесными, их описание методами термодинамики невозможно.
С целью изучения основных свойств систем при обмене энергией с окружающей средой используют подход научной абстракции, идеализируют реальные процессы, принимая их за равновесные.
Термодинамический процесс, протекающий с бесконечно малым
отклонением состояния системы от равновесного, называется
р а в н о в е с н ы м.
Понятие об обратимых и необратимых процессах изложено в подпункте 1.1.5. Ниже рассматриваются только равновесные и обратимые термодинамические процессы идеального совершенного газа.
Для равновесной термодинамической системы связь между термодинамическими параметрами устанавливается уравнением состояния идеального газа (2.9). Следовательно, это уравнение справедливо и для равновесного термодинамического процесса не только в начальном и конечном состояниях системы, но и в любом промежуточном ее состоянии.
В общем случае в процессе могут изменяться произвольно (независимо) два термодинамических параметра из трех. Изучение работы тепловых машин показывает, что наибольший интерес для практики представляют конкретные термодинамические процессы, а именно изменения состояния, протекающие при постоянных давлении, объеме, и температуре, а также без теплообмена с окружающей средой. Их характерной особенностью является то, что для совершенного газа величина теплоемкости на всем протяжении процесса остается неизменной.
В термодинамике широко используются графические методы анализа процессов. При этом удобнее использовать не пространственные трехмерные изображения линий, описываемых функцией f(p,v,T), а их двухмерные проекции на одну из трех координатных плоскостей. Как правило, используется графическое изображение термодинамических процессов в координатах pv и Ts, а в особых случаях – в координатах i s; p i; id и др.
В pv и Ts – координатах на рис.2.3 и 2.4 показан произвольный
термодинамический процесс изменения параметров от состояния 1 до состояния 2.
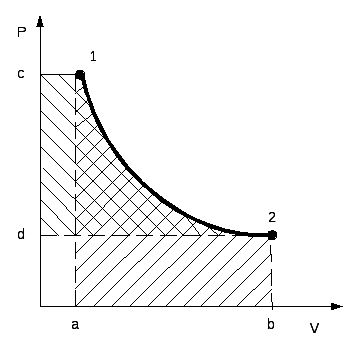
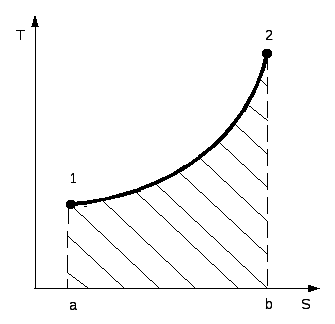
Рис 2.3 Рис. 2.4
На рис. 2.3 площадь, ограниченная кривой процесса 1-2, осью абсцисс и крайними ординатами a и b , как было показано в 1.2.5, численно равна работе расширения, а площадь, ограниченная кривой процесса, осью ординат и крайними абсциссами c и d, – технической работе.
В Ts - координатах площадь, ограниченная кривой процесса 1-2, осью абсцисс и крайними ординатами а и b, выражается интегралом:
Fа-1-2-
б =![]()
Поскольку
dq
= Tds
или q
=
![]() , тоFа-1-2-б
численно равна подведенной теплоте в
процессе.
, тоFа-1-2-б
численно равна подведенной теплоте в
процессе.
Так как указанные площади зависят от характера процесса, то теплота и работа являются его функциями.
Независимо от особенностей процесс их анализа проводится в определенной последовательности, заключающейся в следующем:
– устанавливается характер процесса, назначается постоянный параметр;
– с использованием первого закона термодинамики и конкретных особенностей процесса выводится его уравнение;
– из уравнения процесса и уравнения состояния выводятся соотношения между термодинамическими параметрами;
– указывается способ построения графиков в координатах pv и Ts;
– определяется изменение внутренней энергии, энтальпии и энтропии рабочего тела;
– записываются выражения для работы расширения; работы технической и теплоты процесса;
– устанавливается количественное соотношение между теплотой, изменением внутренней энергии и работой в процессе.
Используя указанную последовательность, проведем анализ обобщенного для всех возможных процессов – п о л и т р о п н о г о.
2.3.2. Политропный процесс
Определение процесса
Термодинамический процесс, протекающий при неизменной теплоёмкости, называется п о л и т р о п н ы м.
Название “политропный” происходит от греческих слов “поли” – много и “тропос” – направление, путь. В политропном процессе в общем случае могут изменяться все термодинамические и калорические параметры кроме теплоёмкости, которую обозначают через cп.
Вывод уравнения процесса.
Для вывода уравнения используем выражение первого закона термодинамики, записанное через энтальпию и внутреннюю энергию:
dq = di - vdp и dq = du + pdv.
Выразив через теплоемкости записанные выражения, получим:
cп dT = cp dT – vdp и cпdT = cv dT + pdv.
Отсюда
(сп – сp)dT = -vdp и (cп –cv)dT = pdv.
Разделим почленно первое уравнение на второе:
![]()
![]() .
.
Здесь левая часть равенства определяется только теплоемкостью рабочего
Разделим почленно первое уравнение на второе:
![]() .
(2.43)
.
(2.43)
Проведя разделение переменных, получим:
n![]()
![]() .
.
После интегрирования этого соотношения в пределах от начала до конца процесса и антилогарифмирования, будем иметь:
p1 v1n = p2 v2n.
Отсюда следует, что
р vn = const. (2.44)
 Выражение
(2.44) называется у р а в н е н и е м п о
л и т р о п н ог о п р о ц е с с а.
Оно устанавливает связь между
параметрами состояния в процессе
с теплоемкостью
Выражение
(2.44) называется у р а в н е н и е м п о
л и т р о п н ог о п р о ц е с с а.
Оно устанавливает связь между
параметрами состояния в процессе
с теплоемкостью
cn = const. Показатель степени n в уравнении называют п о к а з а т е - л е м п о л и р о п ы.Он принимает для каждого сn конкретное числовое значение и, как изображено на рис.2.5, может меняться от - ∞ до +∞. Здесь зависимость теплоемкости политропного процесса от показателя n получена из (2.43) в виде
![]() .
(2.45)
.
(2.45)
Рис. 2.5
Соотношение между термодинамическими параметрами
И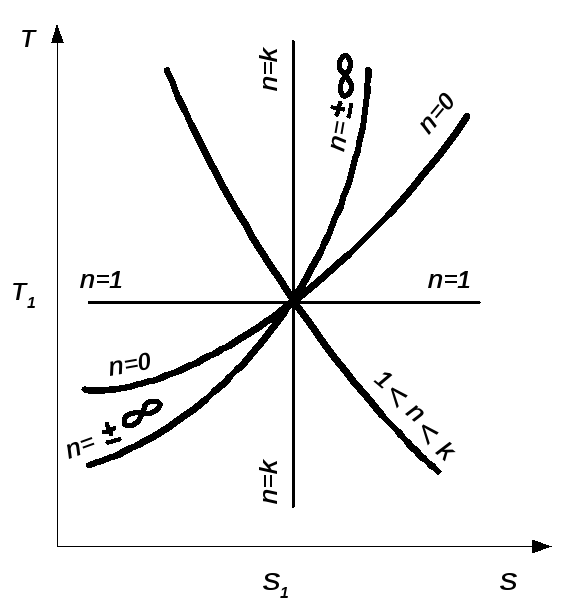 спользуя
уравнения (2.9) и (2.44), получим следующие
соотношения:
спользуя
уравнения (2.9) и (2.44), получим следующие
соотношения:
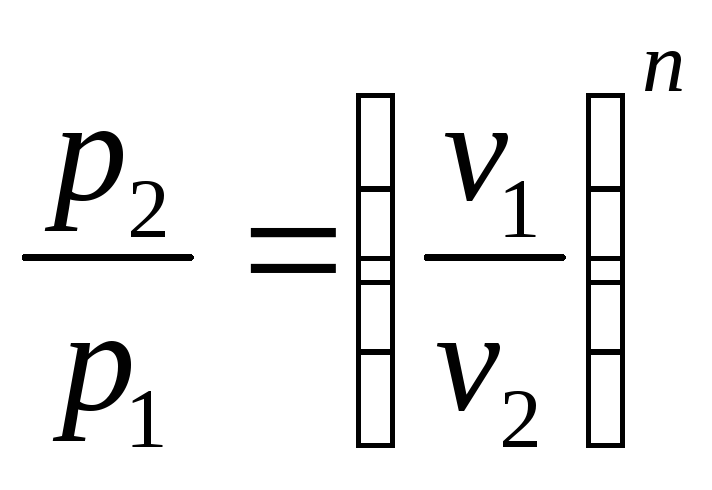 и
и
![]()
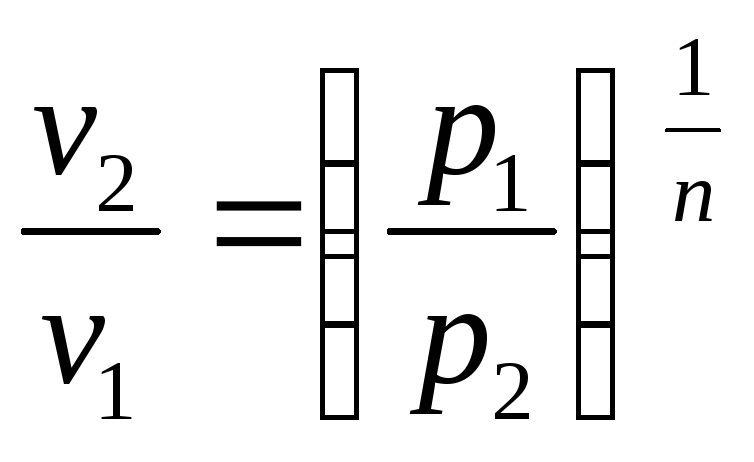 ;
(2.46)
;
(2.46)
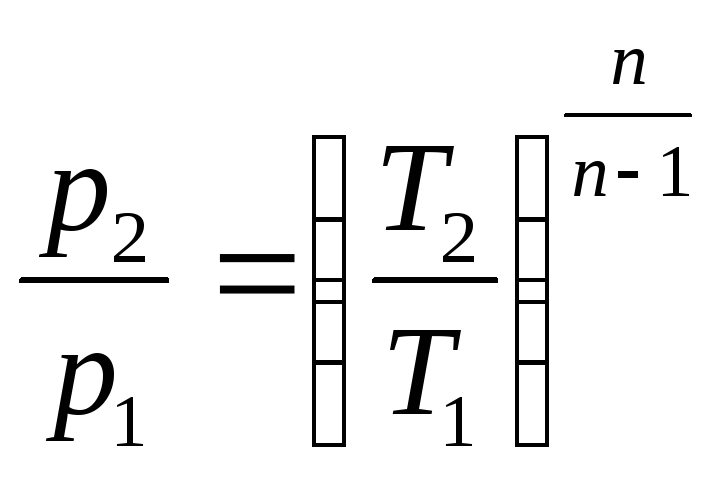 и
и
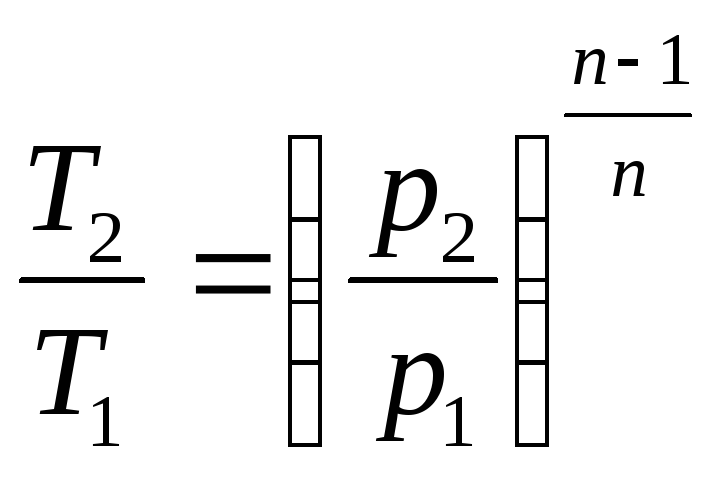 ;
(2.47)
;
(2.47)
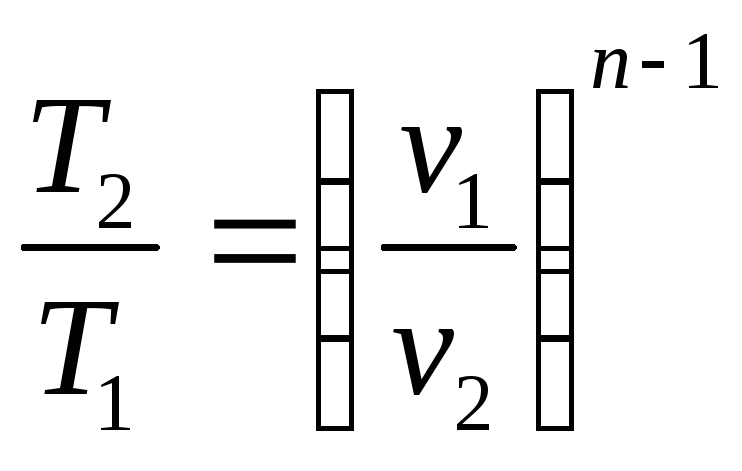 и
и
![]()
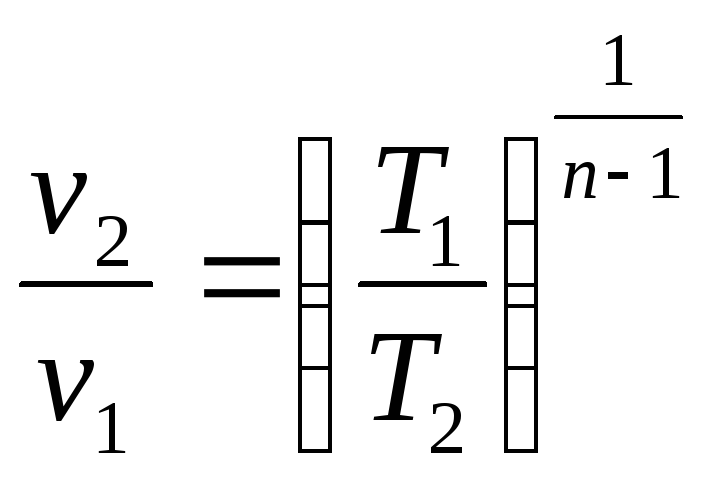 .
(2.48)
.
(2.48)
Уравнения (2.46) – (2.48) при заданном показателе политропы n и известном одном из состояний процесса позволяют определить любое другое состояние, если в нем известен хотя бы один из параметров.
При анализе процессов часто возникают задачи определения показателя политропы по параметрам двух известных состояний. Выражение для вычисления n получим из уравнения (2.46) в виде:
n
=![]()
![]() =
=![]()
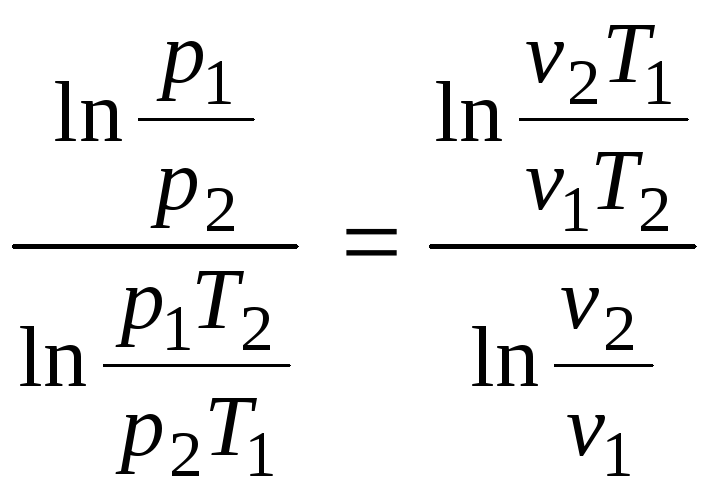 .
(2.49)
.
(2.49)
Графическое изображение процесса
Графическое изображение политропного процесса в координатах pv или Ts называется п о л и т р о п о й,
Построение кривой процесса в координатах pv проводится с использованием уравнения (2.46), записанного в виде:
![]() ,
где
pi
и vi
– текущие значения давления и удельного
объема;
,
где
pi
и vi
– текущие значения давления и удельного
объема;
p1 и v1 – исходные значения указанных параметров.
На рис. 2.6 изображены некоторые политропные процессы в pv - координатах.
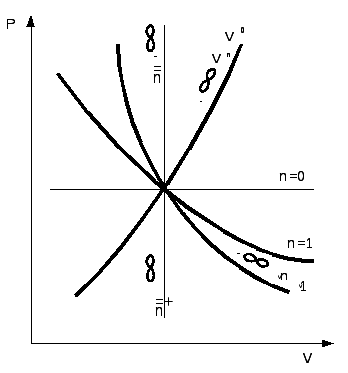

Рис.2.6 Рис. 2.7
Для построения процесса в координатах Ts, рис. 2.7, используют уравнение второго закона термодинамики, так
![]() .
(2.50)
.
(2.50)
Связь параметров начального состояния с текущим получим путем
интегрирования выражения (2.50) в пределах от 1 до i,
si
= s1
+ cv
![]() .
(2.51)
.
(2.51)
Справедливы и следующие выражения:
si = s1 + cpln Ti /T1 – R ln pi /p1 и si = s1 + cvln Ti /T1 + R ln vi /v1 .
Работа процесса.
Используя уравнение политропы, выразим работу расширения (1.9) через начальные и конечные параметры процесса
lрасш
=
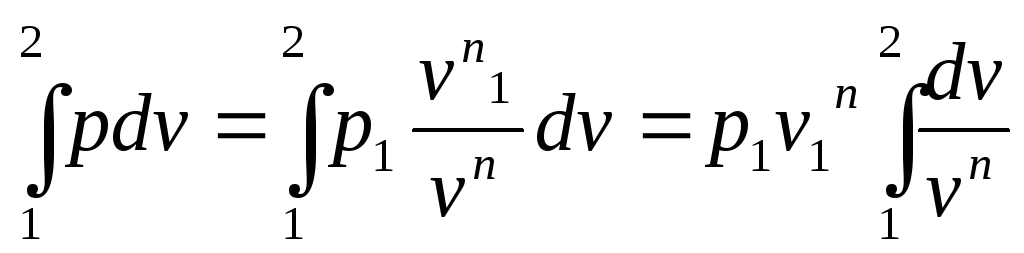 .
.
После интегрирования и некоторых преобразований получим:
lрасш
=
![]() =
=![]() .
.
Заменив отношение температур отношением давлений, будем иметь:
lрасш=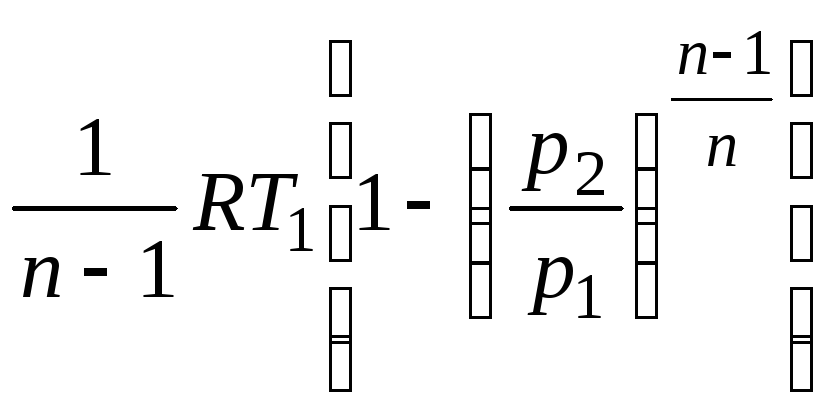 .
(2.52)
.
(2.52)
Проводя те же операции, что и при выводе lрасш получим уравнение для технической работы в виде
lтех
= -![]()
или
lтех
=
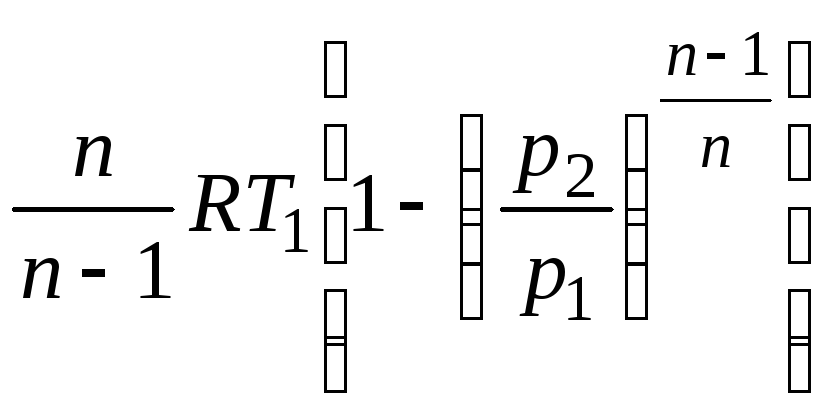 .
(2.53)
.
(2.53)
Сравнивая выражения (2.52) и (2.53), видим, что техническая работа в n раз больше работы расширения, т.е.
lтех = n lрасш.
Теплота процесса.
Теплоту политропного процесса выражают через теплоемкость, либо используют для этого выражение первого закона термодинамики:
q
= cп
(Т2
– Т1)
= cv![]() ,
,![]()
q
= ∆u
+ lрасш
= cv
(Т2
– Т1)
-
![]() ,
,
q
=
![]() i
+ lmex
=
cp
(T2
– T1)
-
i
+ lmex
=
cp
(T2
– T1)
-
![]() R
(T2
– T1
).
R
(T2
– T1
).
Соотношение между теплотой, работой и внутренней энергией.
Для оценки доли теплоты, затраченной на изменение внутренней энергии, в термодинамике при исследовании циклов вводят коэффициент α , которым обозначают отношение
α
=![]() .
(2.54)
.
(2.54)
Долю
тепла, расходуемую на совершение работы
расширения, обозначают через![]()
![]() ,
тогда
,
тогда
![]() или
или
![]() .
(2.55)
.
(2.55)
Выразив изменение внутренней энергии и теплоту через теплоемкости, получим:
α
=
![]() и
и
![]() .
.
Таким образом, распределение теплоты между внутренней энергией и работой в процессе можно оценить по известному показателю политропы.
В теплотехнике часто используются так называемые и з о п а р а м е т- р и ч е с к и е процессы: изобарный, изохорный, изотермический и адиабатный.
2.3.3. Изобарный процесс
Процесс, протекающий при постоянном давлении, называют и з о-
б а р н ы м.
Уравнение процесса записывается в виде p = const или cn = cp.
Из уравнения политропы следует, что для изобарного процесса n = 0.
Соотношение параметров в начальном и конечном состояниях процесса устанавливается с использованием уравнений состояния, записанных для этих точек: p1v1 = RT1 и p2v2 = RT2. Поделив одно уравнение на другое, получим:
![]() .
.
В изобарном процессе объемы одного и того же количества газа изменяются прямо пропорционально абсолютным температурам.
График процесса называется и з о б а р о й. В pv–координатах (рис.2.8) изобара – прямая линия, параллельная оси удельных объемов. В координатах Ts изобара – логарифмическая кривая (рис.2.9), так как она описывается уравнением, полученным из (2.51) при n = 0:
si
= s1
+ cp
ln![]() .
(2.56)
.
(2.56)
Крутизна изобары в Ts-координатах для каждой температуры определяется тангенсом угла наклона кривой к оси абсцисс, т.е.
tg
β
=![]() ..
..
Принимая во внимание, что для изобарного процесса справедливы уравнения dq = T ds и dq = cp dT, получим:
tg
β =
![]() .
(2.57)
.
(2.57)
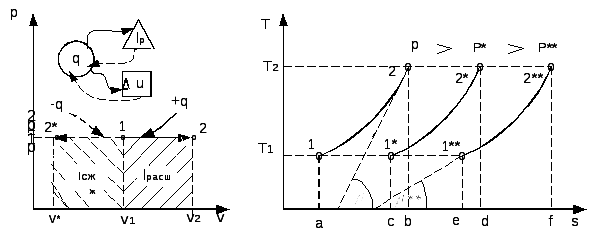
Рис. 2.8 Рис. 2.9
Отсюда следует, что с увеличением температуры и уменьшением теплоемкости крутизна изобары растет. Подкасательная к изобаре в любой точке определяет значение истинной теплоемкости cp при температуре T .
Все изобары являются эквидистантными кривыми (на рис.2.9 изобары при р, р* и р**), так как при одной и той же температуре они имеют одинаковые угловые коэффициенты. Кроме того, расстояние между двумя изобарами вдоль оси абсцисс при разных температурах одинаково. Так при температуре T1 отрезок ce между изобарами р* и р** определяется выражением:
 .
.
Аналогично найдем отрезок d f межу теми же изобарами при температуре Т2.
![]() .
.
В
итоге получили
![]() илиc
e
= d
f.
илиc
e
= d
f.
Изменение внутренней энергии запишем через теплоемкость при постоянном давлении, используя для этой цели уравнение Майера:
∆u = (cp – R) (T2 – T1).
Изменение энтальпии в процессе вычисляется как
∆i = cp(T2 - T1).
Приращение энтропии можно записать и через cp, и через cv:
s2 – s1= cp ln (T2/T1) и s2 – s1 = cv ln (T2/T1) + R ln (v2 /v1).
Работа расширения выражается следующим образом:
lрасш
=![]() .
.
При изменении температуры на один градус работа расширения численно равна величине газовой постоянной.
Техническая работа будет равна нулю, так как dp = 0:
lтех
= -
![]() .
.
Количество теплоты, сообщаемое газу в изобарном процессе, вычисляется по уравнению:
q = cp (Т2 – Т1) = i2 – i1.
Часть сообщенной теплоты идет на изменение внутренней энергии, а другая часть – на работу расширения.
α
=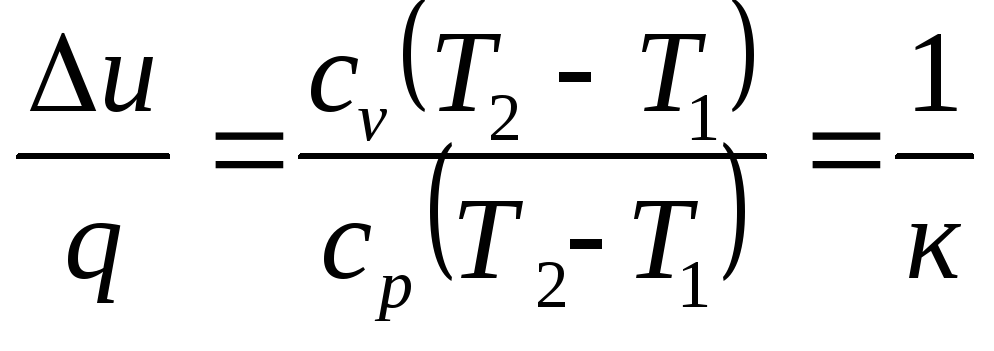 ,
,
![]() .
.
2.3.4. Изохорный процесс
Процесс, протекающий при постоянном объеме, называется
и з о х о р н ы м.
Уравнение процесса записывается в виде v = const или cn = cv.
Показатель политропы для изохорного процесса получим из уравнения политропы, если раскроем его относительно удельного объема:
v
=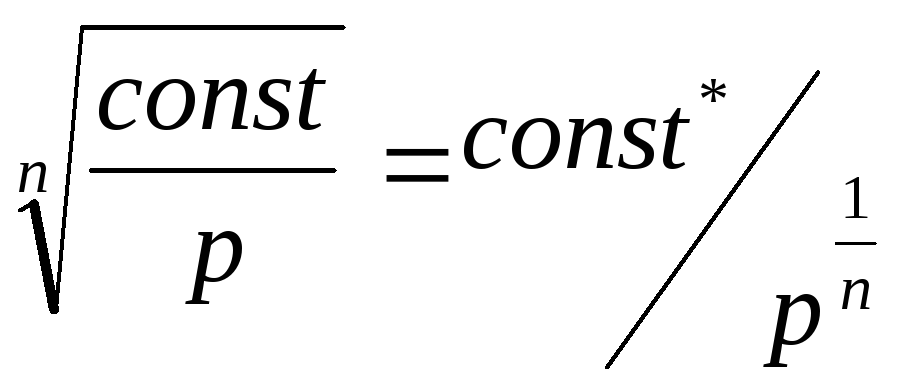 .
.
Из этого следует, что удельный объем может быть постоянным только при показателе политропы, равном n= ±∞.
Из уравнения состояния при v=const получим связь между параметрами в конечных точках процесса:
![]() .
.
Это значит, что при постоянном объеме давление газа изменяется прямо пропорционально изменению абсолютной температуры.
График процесса называется и з о х о р о й. В pv–координатах (рис.2.10) изохора – прямая линия, параллельная оси давлений. В координатах Ts изохора (рис.2.11) – логарифмическая кривая, так как текущие значения энтропии и температуры связаны уравнением:
si
- s1
=
![]() .
(2.58)
.
(2.58)
Как и в изобарном процессе, крутизна изохоры в Ts-координатах определяется угловым коэффициентом
tg γ = T/cv .
Из последнего выражения следует, что крутизна изохоры растет с увеличением температуры и уменьшением теплоемкости. Сравнение угловых коэффициентов изохоры и изобары показывает, что при одной и той же температуре изохора проходит круче, так как cp>cv.
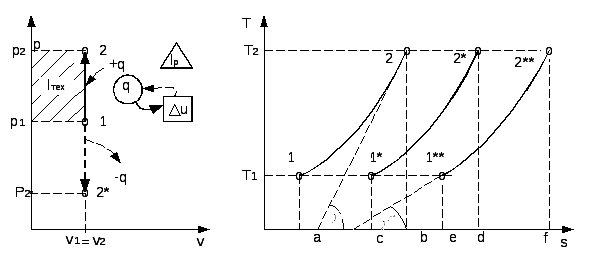
Рис. 2.10 Рис. 2.11
Изохоры, так же как и изобары, эквидистанты (рис.2.11). Как и в изобарном процессе, можно показать, что ac = bd.
Для вычисления изменения внутренней энергии, энтальпии и энтропии в процессе от начального до конечного состояний используются уравнения:
∆u
= cv(Т2
– Т1),
∆i
= cp(Т2
–Т1)
и
![]() .
.
Работа расширения в изохорном процессе равна нулю.
Техническая работа определится по формуле:
lтех=
-![]() .
.
Так как lрасш = 0, то из первого закона термодинамики следует, что все подведенное тепло расходуется на изменение внутренней энергии:
q = u2 – u1= cv (T2 – T1).
Значения α и ξ для изохорного процесса будут равны:
α
=![]() и ξ =1 – α =0.
и ξ =1 – α =0.
2.3.5. Изотермический процесс
Процесс, протекающий при постоянной температуре, называется и з о т е р м и ч е с к и м.
Уравнение процесса записывается в виде Т = const или
pv = const. (2.59)
Следовательно,
показатель процесса n
= 1, а теплоемкость сT
= ±![]() .
.
Отсюда же: отношение удельных объемов обратно пропорционально отношению давлений, т.е.
![]() .
.
График процесса, построенный по уравнению (2.59), называют и з о-
т е р м о й. В pv– координатах (рис.2.12) изотерма – равнобочная гипербола.
В координатах Ts изотерма – прямая линия параллельная оси абсцисс, рис.2.13..
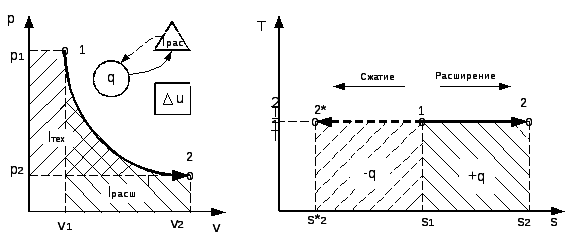
Рис. 2.12 Рис. 2.13
Изменения внутренней энергии и энтальпии в процессе равны нулю, т.е. du = cvdT = 0 и di =cpdT = 0.
Изменения энтропии в изотермическом процессе можно выразить через удельный объем и через давление:.
ds
=
![]() .
.
Интегрируя данное выражение от первого состояния до второго, получим :
∆ѕ=ѕ2
–ѕ1=R
ln![]() .
.
.
.
Для изотермического процесса работа расширения равна технической работе:
lрасш
=![]() = RT1ln
= RT1ln![]()
и
lтех
= -![]()
Теплота, участвующая в процессе
q
= T (s2
– s1)
=RT ln
![]() = RT ln
= RT ln![]() .
.
В данном процессе все тепло, подведенное к газу, идет на совершение работы расширения:
Коэффициент α для изотермического процесса равен нулю, значение ξ - единице, т.е.
α
=![]() и ξ = 1 – α = 1.
и ξ = 1 – α = 1.
2.3.6. Адиабатный процесс
А д и а б а т н ы м называют процесс изменения состояния системы, происходящий без теплообмена с окружающей средой.
В адиабатном процессе dq = 0, следовательно, теплоемкость сq = 0.
Для вывода уравнения адиабаты используем выражения первого закона термодинамики (1.17) и (1.18) при dq = 0:
cp dT –v dp = 0 и cv dT + p dv = 0
Разделим первое уравнение на второе:
![]() ,
,
сократив на dT, разделив переменные и обозначив cp/cv =к, будем иметь:
к![]()
Проинтегрировав полученное уравнение от начального до конечного состояния процесса, получим:
к
ln![]()
или
p1 v1к = p2 v2к.
На основании этого запишем уравнение адиабаты:
p vк = const. (2.60)
При адиабатном процессе произведение давления на удельный объем в степени к есть величина постоянная. Кривую, построенную по уравнению (2.60), называют а д и а б а т о й, а величину к, являющуюся отношением теплоемкостей cp и cv – п о к а з а т е л е м а д и а б а т ы.
Уравнение адиабатного процесса аналогично политропному, разница лишь в том, что здесь вместо показателя политропы п имеем показатель адиабаты к. Поэтому все последующие соотношения для адиабатного процесса получим из политропных, заменив п на к.
Так, связь между параметрами в адиабатном процессе имеет вид:
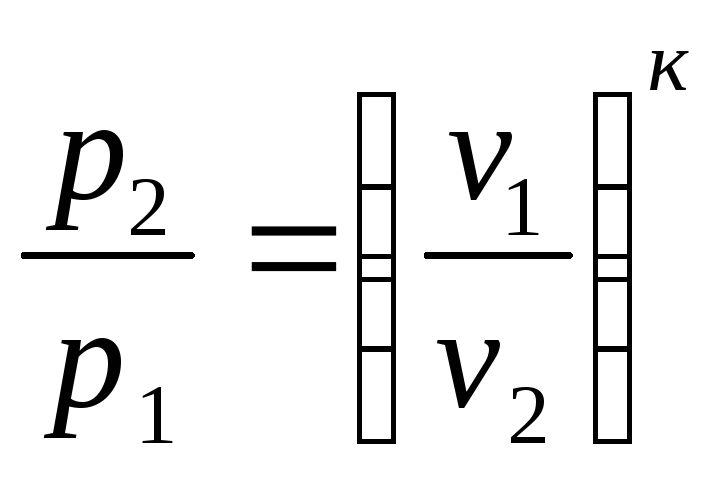 или
или
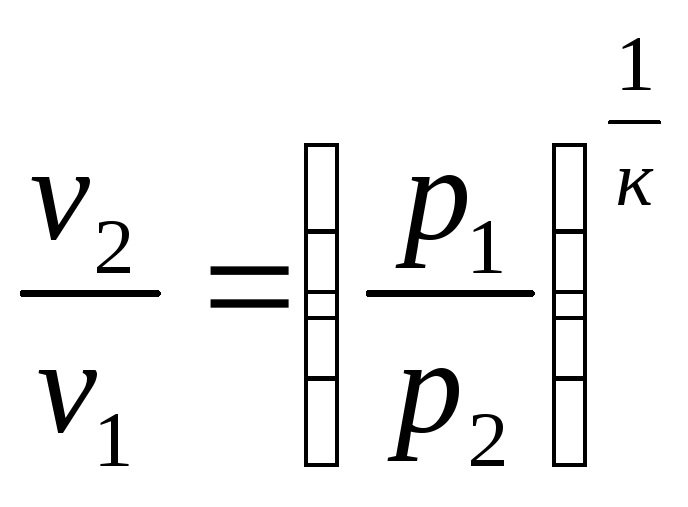 ;
;
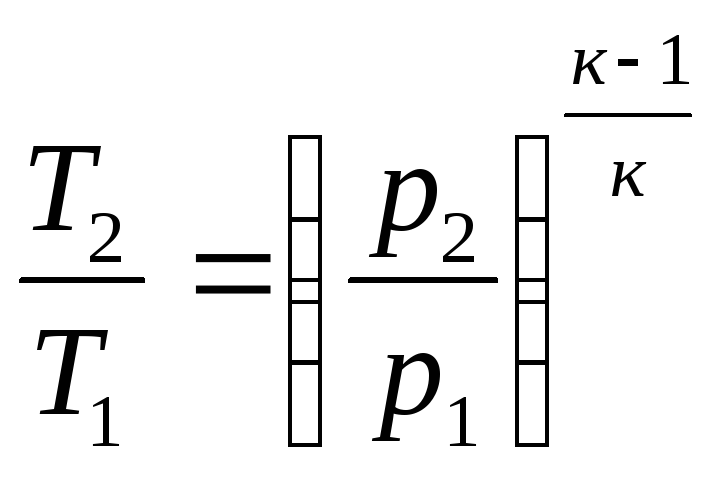
![]() или
или
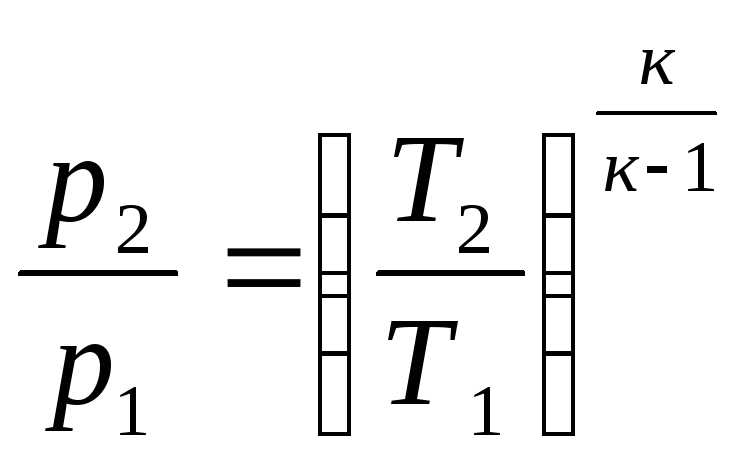 ;
;
 или
или
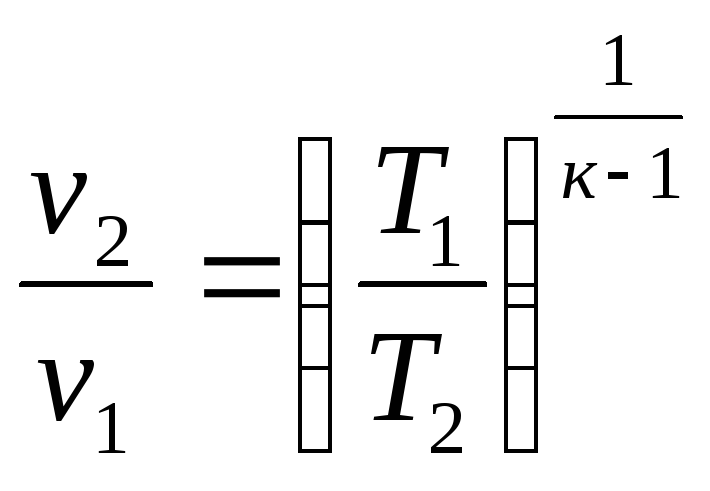
Адиабата в pv-координатах представляет собой неравнобочную гиперболу, рис.2.14. Она круче изотермы, так как к >1. В Ts-координатах адиабата изображается вертикальной прямой, рис. 2.15, потому что при q = 0 изменения энтропии нет, т.е. ∆s = 0. В этом случае адиабатный процесс можно называть и з о э н р о п н ы м процессом
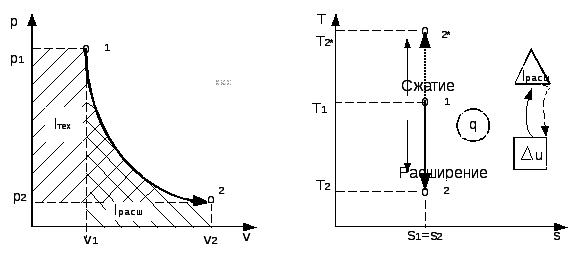
Рис. 2.14 Рис. 2.15
Изменение энтальпии и внутренней энергии определяются по уравнениям:
∆i =cp (T2 –T1) и ∆u = cv (T2 – T1) .
Заменив в уравнении (2.52) и (2.53) п на к, получим работу расширения и техническую работу:
lрасш
=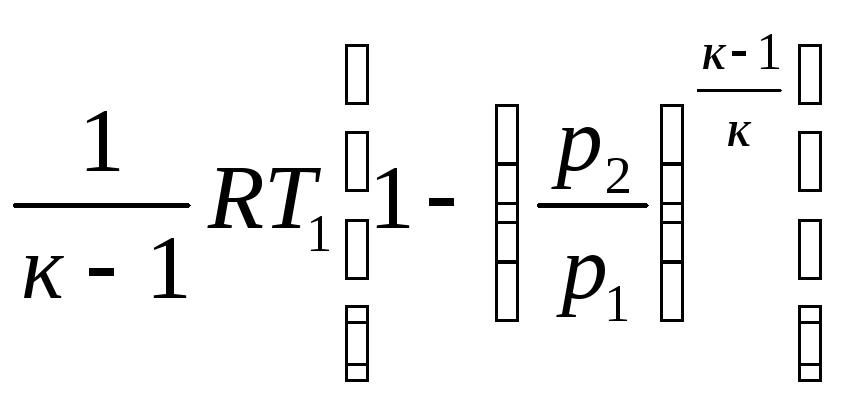 и
lтех
=
и
lтех
=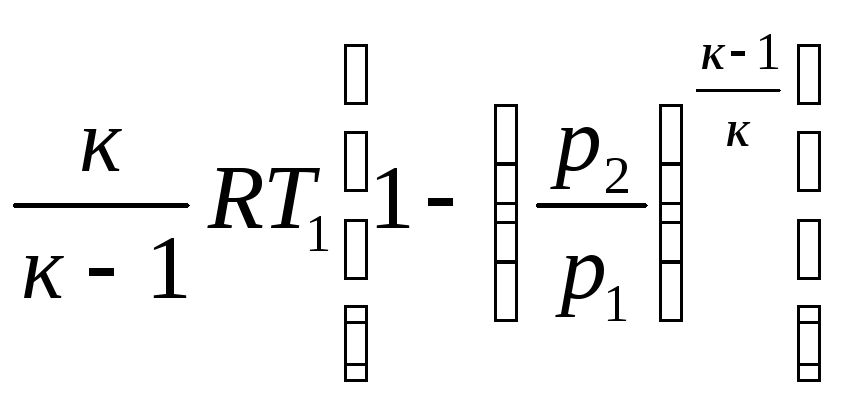 ..
..
Отсюда следует, что в адиабатном процессе техническая работа в к раз больше величины работы расширения.
Поскольку теплота в адиабатном процессе равна нулю, то работа расширения совершается только за счет изменения внутренней энергии рабочего тела.
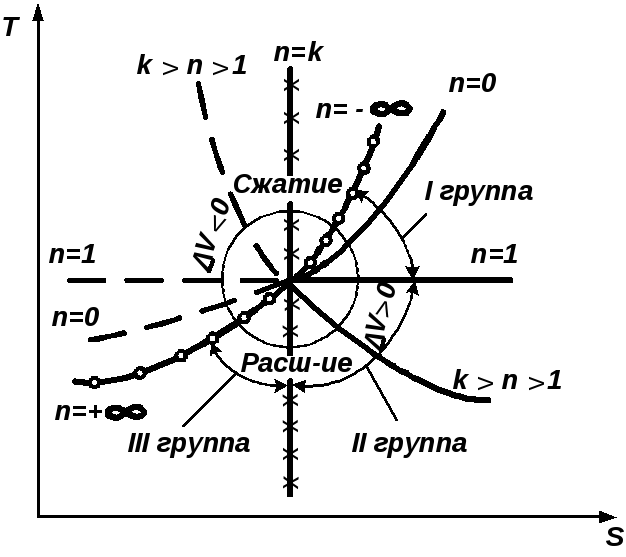
2.3.7. Характерные группы политропных процессов
В зависимости от энергообмена системы с окружающей средой поли- тропные процессы расширения можно разбить на три характерные группы:
I группа – с показателем процесса п от -∞ до 1;
II группа – с показателем процесса п от 1 до к;
III группа – с показателем процесса п от к до +∞.
Распределение процессов по группам в pv и Ts – координатах показано на рис.2.16.(а) и рис.2.16 (б), соответственно. Процессы, лежащие выше изотермы, протекают с увеличением внутренней энергии, ниже – с ее уменьшением. К процессам, расположенным над адиабатой, теплота подводится, под адиабатой – отводится. Процессы расширения лежат справа от изохоры, сжатия – слева.
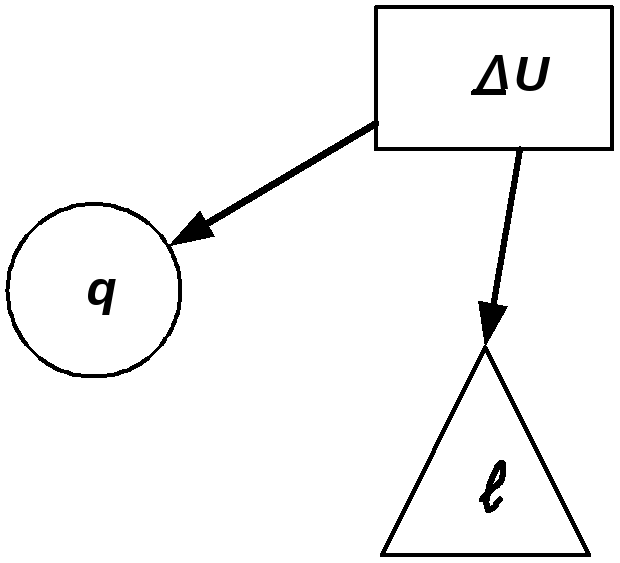
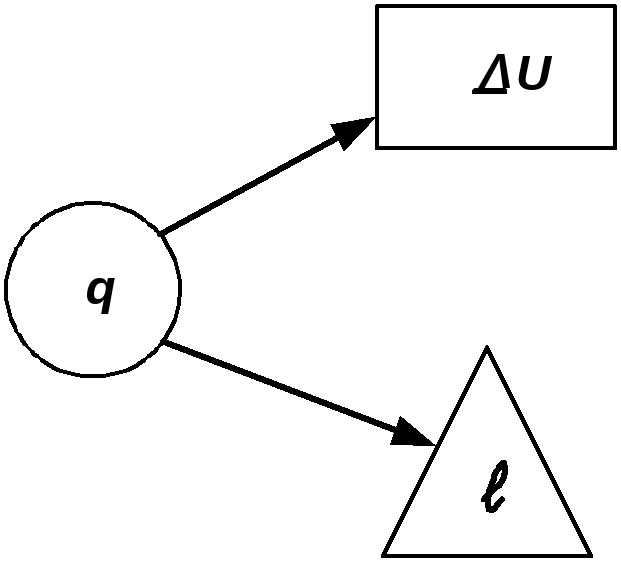
Для первой группы характерным является то, что все процессы расширения идут с подводом тепла и увеличением внутренней энергии. Связь между теплотой, работой и внутренней энергией можно представить схематически, рис.2.17. В первой группе процессов (а) вся теплота идет на совершение
работы расширения и увеличение внутренней энергии.
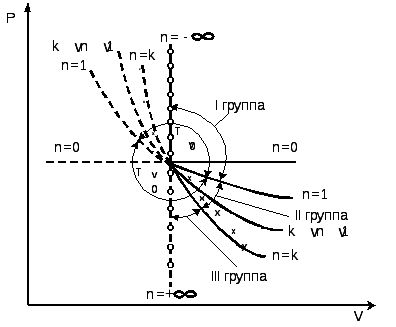
а) б)
Рис.2.16

а)б) в)
Рис. 2.17
Во второй группе (б) теплота тоже подводится, но внутренняя энергия уменьшается. В этом случае работа расширения совершается за счет подведенного тепла и уменьшения внутренней энергии.
Третью группу (в) отличает то, что все процессы расширения идут с отводом теплоты и уменьшением внутренней энергии. Работа процессов этой группы производится только за счет уменьшения внутренней энергии. Кроме того, внутренняя энергия дополнительно еще уменьшается вследствие отвода теплоты от системы.
2.3.8. Диаграммы состояния
Изображение процессов в координатах, по осям которых выбраны те или иные параметры. позволяет построить для рабочих тел характерные диаграммы состояния, широко использующиеся при исследовании термодинамических процессов и циклов. Рассмотрим некоторые из них.
Диаграмма состояния в pv – координатах представляет собой сетку из изобар и изохор, на которую наложены изотермы. По этой диаграмме можно быстро определить в любом состоянии термодинамические параметры рабочего тела, для которого она построена. Однако pv-диаграмма дает недостаточно полную информацию о рабочем теле и процессах изменения его состояния.
Диаграмма состояния в Ts – координатах позволяет непосредственно определить большее число параметров, так как на поле графика, состоящего из сетки изотерм и изоэнтроп, наносятся уже два вида изопараметрических процессов: изохоры и изобары. По этой диаграмме для любого состояния можно определить T, p, v, s, а также cp и cv.
Некоторым недостатком рассмотренных диаграмм является то, что при определении количества работы (в pv – диаграмме) и количества теплоты
(в Ts – диаграмме) приходится измерять соответствующие площади.
В технических расчетах чаще используется диаграмма, построенная в is-координатах. Достоинством такой диаграммы является то, что на ней работа и теплота процессов изображаются отрезками линий. При построении диаграммы по оси ординат откладывается энтальпия, а по оси абсцисс – энтропия. На рис. 2.18 представлена is – диаграмма водяного пара. На поле графика из изоэнтальп и изоэнтроп наносятся изобары, изохоры и изотермы.
Имея
is
– диаграмму, по двум известным параметрам
можно просто найти остальные параметры
состояния рабочего тела. Так, например,
по p
и T
непосредственно определяются i
, s,
v,
cp,
cv
и вычисляются R,
к, u.
В адиабатном процессе расширения от
состояния 1 до состояния 2 отрезок оси
ординат
![]() i1
- i2
представляет
работу техническую, а в изотермном
процессе
i1
- i2
представляет
работу техническую, а в изотермном
процессе
![]() s
= s2
– s1
– эквивалентна теплоте, подведенной в
процессе расширения.
s
= s2
– s1
– эквивалентна теплоте, подведенной в
процессе расширения.
В холодильной технике, как правило, используются диаграммы состояния хладагентов в координатах ln p – i. Для фреона R–22 диаграмма состояния представлена в Приложении табл. 16.
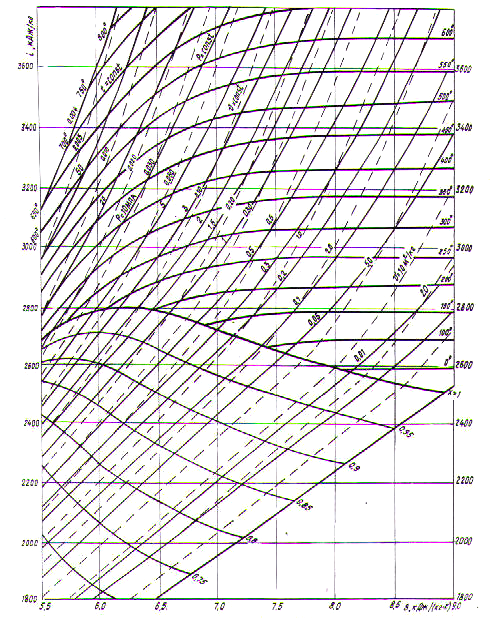
Рис. 2.18
