
- •Министерство сельского хозяйства рф
- •Раздел 1 Техническая термодинамика
- •Глава 1 Законы термодинамики
- •1.2. Законы термодинамики
- •Глава 2 термодинамические свойства рабочих тел
- •2.1. Рабочее тело тепловых машин
- •2.2. Теплоемкость гав и газовых смесей
- •2.3. Термодинамические процессы
- •Глава 3 пар и влажный воздух
- •3.1. Парообразование жидкостей
- •3.2. Влажный воздух
- •Глава 4 термодинамика газового потока
- •4.1. Уравнения и параметры движущегося газа
- •4.2. Течение газа в каналах
- •Глава 5 Циклы тепловых машин
- •5.1. Цикл Карно
- •5.2. Идеальные циклы поршневых двс
- •5.3. Идеальный цикл газотурбинного двигателя
- •15.4. Цикл паросиловой установки
- •5.5. Цикл универсальной тепловой машины Стирлинга
- •5.6. Циклы компрессоров
- •5.7. Циклы холодильных машин
- •Раздел II Основы теории теплообмена
- •Глава 6. Теплопроводность
- •6.1. Терминология теплообмена
- •6.2. Сущность теплопроводности
- •6.3. Стационарная теплопроводность
- •6.4 Понятие о решении задач нестационарной теплопроводности
- •Глава 7 Конвективный теплообмен
- •7.1. Теплоотдача
- •7.2. Основы теории теплового подобия
- •7.3. Теплоотдача при естественной конвекции
- •7.4. Теплоотдача при вынужденной конвекции
- •7.5. Теплоотдача при изменении агрегатного состояния
- •Глава 8 Лучистый теплообмен
- •8.1. Закономерности лучистого теплообмена
- •8.2. Лучистый теплообмен между телами, разделенными
- •8.3. Лучистый теплообмен в камерах сгорания
- •Теплопередача и теплообменные аппараты
- •9.1. Уравнение теплопередачи
- •9.2. Теплопередача через плоскую и цилиндрическую стенки
- •9.3. Теплопередача через оребренную стенку
- •9.4. Интенсификация теплопередачи
- •9.5. Тепловая защита
- •9.6. Теплообменные аппараты
- •9.7 Тепловые трубы
- •Приложение
- •Соотношения между единицами давления
- •Теплофизические свойства металлов и сплавов
Глава 2 термодинамические свойства рабочих тел
2.1. Рабочее тело тепловых машин
2.1.1. Газ как рабочее тело
Выше было показано, что для непрерывного взаимного преобразования теплоты и работы необходимо иметь, кроме источника теплоты и теплоприемника, вспомогательное тело, которое воспринимает энергию в одной форме и в результате кругового процесса преобразует ее некоторую часть в другую форму. Это вспомогательное тело называют р а б о ч и м т е л о м.
В качестве рабочих тел тепловых машин необходимо использовать вещества, обладающие свойством сжимаемости. Это требование вытекает из того, что цикл тепловых машин обязательно включает в себя процессы, связанные с изменением объема рабочего тела, например, расширение продуктов сгорания в ДВС, сжатие фреона в компрессоре холодильной машины и т.п. В табл.3 и табл. 4 Приложения приведены свойства некоторых газов, используемых в качестве рабочих тел.
Рабочим телом современных теплоэнергетических установок являются однородный газ или газовые смеси. В ряде случаев протекание процессов связано с рабочим телом многофазового состава. Так, например, в испарителе холодильной машины хладагент находится в парожидкостном состоянии. Рабочее тело часто включает вещества, способные вступать друг с другом в химические реакции. В общем случае фазовые переходы и химические реакции сопровождаются тепловым и механическим взаимодействием с внешней средой, поэтому для их анализа используются общие методы термодинамики. Расчеты циклов энергетических установок существенно упрощаются, если реальный газ рассматривать как идеальный.
Под идеальным понимают газ, в котором силы межмолекулярного взаимодействия отсутствуют, а сами молекулы рассматриваются как материальные точки.
Все реальные газы при высоких температурах и малых давлениях почти полностью подходят под понятие идеального газа, и по своим свойствам практически не отличаются от него. Введение понятия идеального газа позволило получить простые математические зависимости между параметрами состояния и создать стройную теорию термодинамических процессов. Рассмотрим некоторые свойства газов и газовых смесей.
Уравнения состояния идеального газа
Функциональную связь между термодинамическими параметрами идеального газа впервые получил в 1834 г. французский физик Б. Клапейрон, использовавший при этом свойства газов, открытые англичанином Р. Бойлем и французом Ж. Гей-Люссаком.
Р. Бойль в 1662г. экспериментально установил следующую законо -мерность:
при одной и той же температуре удельный объем идеального газа изменяется обратно пропорционально изменению его давления, т.е.
p
v
=![]() .
(2.1)
.
(2.1)
Независимо от Р.Бойля эту же закономерность в 1676 г. получил французский физик Э. Мариотт, поэтому выражение (2.1) именуют законом Бойля-Мариотта.
Ж. Гей-Люссак в 1802 г. опытным путем установил, что
при одном и том же давлении удельный объем идеального газа изменяется прямо пропорционально изменению его абсолютной температуры, т.е.
![]() .
(
2.2)
.
(
2.2)
Рассмотрим два состояния 1 кг идеального газа. Первое состояние (С0) соответствует нормальным физическим условиям и характеризуется параметрами p0, v0, T0; второе состояние (C ) – произвольное, имеющее параметры p, v, T. Изобразим графически функцию (2.1) в координатах pv при температурах T0 = const и T = cоnst. Любая точка из полученных кривых изображает состояние газа, характеризуемое тремя конкретными параметрами (давлением, удельным объемом и температурой). Эти состояния изображены на рис. 2.1
Используя закономерность Бойля- Мариотта, выразим р через р0 и v0.
р v0′ = p0 v0, , (2.3)
г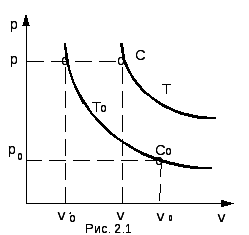 деv0'
– удельный объем газа при давлении
p
и температуре T0.
деv0'
– удельный объем газа при давлении
p
и температуре T0.
Из закона Гей-Люссака следует, что
v0′ /T0= v/T. (2.4)
Подставляя в (2.3) значение v0' из выражения (2.4), получим:
![]() .
(2.5) Правая часть равенства (2.5)
имеет для заданного газа конкретное
численное значение, в термодинамике
его обозначают R
, т.
е.
.
(2.5) Правая часть равенства (2.5)
имеет для заданного газа конкретное
численное значение, в термодинамике
его обозначают R
, т.
е.
![]() .
.
Величину R называют г а з о в о й п о с т о я н н о й и измеряют в Дж/(кг·К). Для произвольного состояния газа уравнение (2.5) будет иметь вид:
![]() .
(2.6)
.
(2.6)
Выражение (2.6) называют уравнением Клапейрона. Оно устанавливает, что
для выбранного состояния произведение давления на удельный объем, деленное на абсолютную температуру, есть величина постоянная.
Найдем числовое значение газовой постоянной R и выявим ее физическую сущность. Для этого обратимся к еще одной закономерности поведе-
ния газов, экспериментально установленной в 1811г. итальянским ученым
А. Авогадро.
При одинаковых давлениях и температурах одинаковые количества различных газов занимают один и тот же объем.
В СИ за единицу количества вещества принят м о л ь (М). Моль равен количеству вещества системы, содержащей столько же структурных элементов, сколько содержится атомов в углероде – 12 массой 0,012 кг. Установлено, что в 12 г углерода содержится 6·1023 атомов. Такое количество структурных элементов в любом другом веществе имеет другую массу. Моль – расчетная единица и эталона для его воспроизведения не существует.
Массу одного моля вещества называют м о л я р н о й м а с с о й Молярную массу обозначают через μ. Единица молярной массы – кг/моль. При численном выражении молярной массы различных веществ иногда за единицу количества вещества принимают 1000 молей – 1 кмоль.
Величины,
характеризующие количественную единицу
вещества в молях, условимся обозначать
чертой сверху. Тогда объем моля какого-либо
газа
![]() будет равен произведению удельного
объема газа на его молярную массу,
т.е.
будет равен произведению удельного
объема газа на его молярную массу,
т.е.![]() =
=
![]() μ.
μ.
Согласно закону Авогадро, для различных газов при одинаковых условиях будет иметь:
v1 μ1 = v 2 μ 2 = v μ . (2.7)
Экспериментально
установлено, что при нормальных физических
условиях (T0
= 273,15; p0
= 760 мм рт.
ст. = 101325 Па) объем одного моля любого
газа
![]() 0
= 22,41 м3/моль.
0
= 22,41 м3/моль.
Из определения газовой постоянной следует, что
R
=![]()
![]() .
.
Умножив
обе части этого равенства на μ и
подставив численные значения p0,
![]() и Т0,
получим:
и Т0,
получим:
![]() R
R
![]() 8314 Дж/(моль·К).
Величину μR
обозначают
8314 Дж/(моль·К).
Величину μR
обозначают
![]() и называют у н и в е р с а л ь н о й
(молярной)
и называют у н и в е р с а л ь н о й
(молярной)
газовой постоянной.
Универсальная газовая постоянная для одного моля всех газов, независимо от их природы, является величиной постоянной и равной:
![]() =
8314 Дж/(моль·К).
=
8314 Дж/(моль·К).
Отсюда, газовая постоянная 1 кг конкретного газа вычисляется как
R
=![]() .
(2.8)
.
(2.8)
Для одного и того же газа, в зависимости от его массы, уравнение состояния может быть записано по-разному:
для 1 кг p v = R T, (2.9)
для m кг p V = m R Т , (2.10)
для
одного моля
p
![]() =
=![]() T.
T.
![]() (2.11)
(2.11)
Чтобы уяснить физический смысл газовой постоянной, запишем уравнение (2.10) для одной и той же массы газа, находящейся в двух различных состояниях при одинаковом давлении:
р V1 = m R Т1 и p V2 = m R Т2 .
Вычитая из второго уравнения первое, получаем:
р (V2 –V1) = m R (T2 – T1),
откуда
R
=![]()
![]() .
.
Числитель в полученном выражении представляет собой работу газа в процессе при постоянном давлении. Следовательно, если разность температур равна одному кельвину, а масса газа – одному килограмму, то газовая постоянная есть работа расширения 1 кг газа при увеличении его температуры на 1 кельвин в изобарном процессе.
Уравнение состояния реального газа
Все полученные выше уравнения состояния справедливы только для идеальных газов. Состояния реальных газов могут описываться этими уравнениями только приближенно, поскольку здесь не учитываются силы взаимодействия между молекулами и объемы самих молекул.
За прошедшее столетие различными авторами было предложено значительное число уравнений состояния реального газа. Наибольшее применение в настоящее время имеет уравнение, полученное в 1873 г. голландским физиком Ван-дер-Ваальсом:
(p
+![]() )(v
- b)
= RT,
(2.12)
)(v
- b)
= RT,
(2.12)
где
![]() иb
– постоянные для конкретного газа
величины.
иb
– постоянные для конкретного газа
величины.
Физический смысл поправки b состоит в следующем. У реального газа молекулы занимают определенный объем, и между ними существуют силы взаимодействия. При нормальных состояниях эти силы проявляются как силы притяжения, возрастающие с уменьшением расстояния между молекулам. Но такая закономерность замечается до определенного сближения молекул. При дальнейшем уменьшении расстояния между ними возникают силы отталкивания, величина которых тем больше, чем ближе молекулы друг к другу. Силы отталкивания при некотором расстоянии между молекулами становятся такими огромными, что никакие давления далее не способны уменьшить объем газа. Величина b и есть наименьший объем, до которого представляется возможным сжать газ.
Поправка на давление вытекает из следующих соображений. У реальных газов между молекулами существуют силы притяжения. По этой причине давление реального газа имеет меньшее значение, чем давление идеального газа при одинаковых p и T ,на величину ∆р:
P=![]() – ∆p.
– ∆p.
Величина ∆р пропорциональна квадрату числа молекул в единице объема. Поскольку молекулы реального газа обладают массой, то ∆р пропорционально квадрату плотности или обратно пропорционально квадрату удельного объема. Коэффициентом пропорциональности является величина a, тогда ∆p = a/v2. Величины a и b называются и н д и в и д у а л ьн ы м и
п о с т о я н н ы м и и зависят только от природы газа. Они могут быть определены как теоретически, так и опытным путем. Их численное значение, например, для азота следующее:
a = 0,135 (Н· м4)/кг2 и b = 0,386 10-4 м3/кг.
2.1.2. Газовые смеси
В большинстве случаев в качестве рабочих тел термодинамических систем используются не однородные газы, а их смеси, например, воздух, природный газ, продукты сгорания топлива и т.д.
Газовыми смесями называют механические смеси отдельных газов при условии отсутствия в них химических реакций.
Длительное изучение газовых смесей позволило установить их некоторые особенности:
– каждый газ, входящий в смесь, занимает весь ее объем и имеет ее температуру;
– каждый газ, находящийся в смеси, подчиняется своему уравнению состояния;
– каждый газ, занимающий объем смеси и имеющий температуру смеси, производит соответствующее индивидуальное давление на оболочку сосуда. Это давление называется п а р ц и а л ь н ы м.
Чтобы определить параметры газовой смеси, необходимо знать количество каждого газа, составляющего смесь, т.е. знать состав смеси. Состав смеси может быть задан парциальным давлениями, массовыми или объемными долями.
Задание смеси парциальными давлениями
Парциальное давление обозначается через pi. Если в смеси находится n газов, то сумма их парциальных давлений равна давлению смеси:
рсм
= p1
+ p2
+ … +pn
=
![]() .
(2.13)
.
(2.13)
Это равенство носит название закона Дальтона.
Задание смеси массовыми долями
Массовой долей называется отношение массы данного газа к массе газовой смеси.
Массовая доля обозначается через gi и определяется по выражению:
g i= mi /mсм . (2.14)
Сумма массовых долей равна единице:
![]()
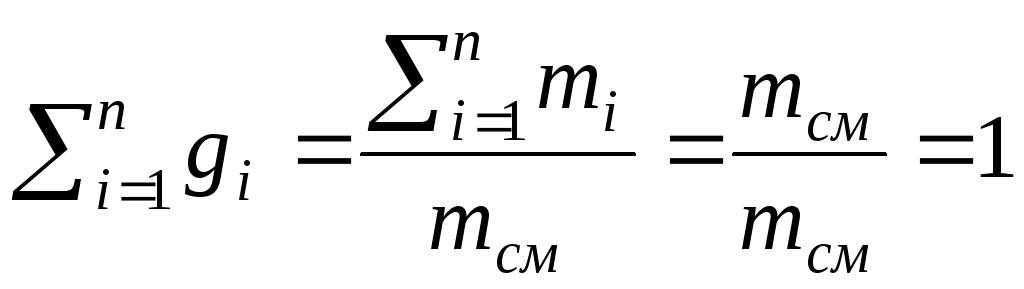 .
.
Задание смеси объемными долями.
Объемной долей называется отношение приведенного объема данного газа к объему всей смеси.
Под приведенным объемом понимают такой объем, который занимал бы индивидуальный газ, имея давление и температуру смеси.
Объемную долю обозначается через ri и определяется по выражению:
ri = Vi /Vсм , (2.15)
где Vi – приведенный объем.
Сумма объемных долей равна единице:
![]()
![]() .
.
Получим соотношения между парциальными давлениями, массовыми и объемными долями.
Запишем уравнение состояния для i -го газа, находящегося в смеси,
pi Vсм = m i R iT см .
Если этот газ займет свой приведенный объем, то его уравнение состояния будет иметь вид:
pсм Vi = m I R I Tсм .
Разделив эти уравнения друг на друга, будем иметь:
р i = ri pсм. (2.16)
Выразим массовую долю i-го газа через его объемную долю и парциальное давление, используя выражения (2.7), (2.14) и (2.16):
.
![]()
![]() .
(2.17)
.
(2.17)
Отсюда
ri
= g
i
![]() (2.18)
(2.18)
и
pi
= gi
![]() .
(2.19)
.
(2.19)
Здесь μсм – молярная масса смеси.
Под
![]()
![]() понимают молярную массу условного газа,
у которого в массеm,
равной массе смеси, содержится число
молей M,
равное числу молей в газовой смеси.
понимают молярную массу условного газа,
у которого в массеm,
равной массе смеси, содержится число
молей M,
равное числу молей в газовой смеси.
Выражения для вычисления молярной массы смеси газов можно получить из (2.17) и (2.18)..
Суммируя по i массовые доли в уравнении (2.17), будем иметь:
![]()
 ,
,
Отсюда
![]() ,
(2.20)
,
(2.20)
![]()
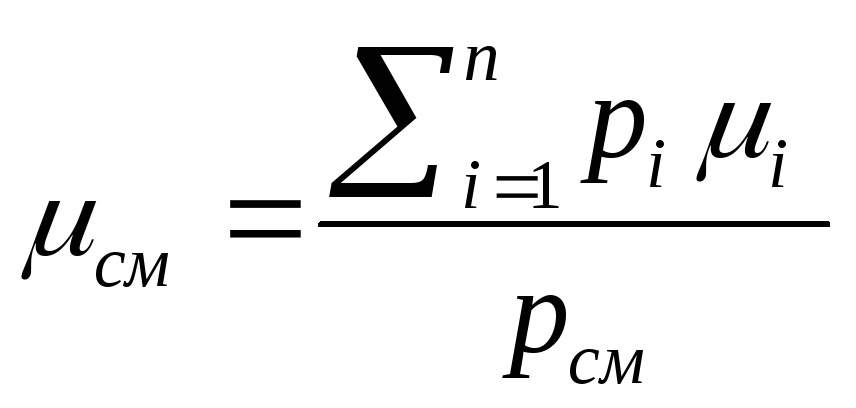 .
(2.21)
.
(2.21)
Аналогично из уравнения (2.18) получимчим:
![]()
![]() .
.
Отсюда
 .
.
![]() (2.22)
(2.22)
Газовая постоянная смеси определяется по известной величине кажущейся молярной массы из соотношения:
Rсм
=
![]() .
(2.23)
.
(2.23)
