
Лабораторки ФИЗИКА
.pdf
8.Обчисліть середнє арифметичне значення відношення питомих теплоємностей повітря при сталому тиску та сталому об’ємі:
|
|
|
|
|
|
|
1 |
n |
|
|
|
||||
|
|
|
|
γ |
= |
∑γi , |
(10.6) |
||||||||
|
|
||||||||||||||
|
|
|
|
|
|
|
n i=1 |
|
|||||||
де n - кількість значень. |
|
|
|
|
|
|
|
|
|
|
|
||||
9. |
Обчисліть середньоквадратичне відхилення: |
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
S = |
|
∑n |
( γ |
− γ i )2 |
|
|||||||||
|
|
i=1 |
|
|
|
|
|
|
|
(10.7) |
|||||
|
|
|
n(n −1) |
||||||||||||
|
|
|
|
|
|
|
|
|
|||||||
10.Обчисліть абсолютну похибку: |
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
γ = tn,α |
S , |
(10.8) |
|||||||||
де tn,α - коефіцієнт Стьюдента. |
|
|
|
|
|
|
|
|
|
|
|
||||
11. Запишіть остаточний результат: |
|
|
|
|
|
|
|
|
|
|
|
||||
|
γ = γ |
± |
γ |
(10.9) |
|||||||||||
12.Визначте відносну похибку розрахунків: |
|
||||||||||||||
|
ε = |
|
γ |
100% |
(10.10) |
||||||||||
|
|
|
|
|
|
γ |
|
|
|
|
|
|
|
|
|
13.Визначте відносно теоретичну похибку розрахунків: |
|
||||||||||||||
|
δ = |
|
|
γT |
|
− γ |
|
|
|
100%, |
(10.11) |
||||
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
γT |
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
де |
теоретичне значення показника |
|
адіабати γT необхідно |
знайти за |
|||||||||||
формулою (10.4) і згідно табл. Д2. |
|
|
|
|
|
|
|
|
|
|
|
||||
14. Сформулюйте та запишіть висновок до роботи. |
|
||||||||||||||
Контрольні запитання до лабораторної роботи № 10
Теплоємність речовини, питома та молярна теплоємності. Ізопроцеси. Теплоємність газу при сталому об’ємі та сталому тиску. Рівняння Майєра. Число ступенів свободи молекули. Закон Больцмана про рівномірний розподілу енергії за ступенями свободи газових молекул. Перший закон термодинаміки та застосування його до адіабатного процесу. Рівняння Пуасона. Обчислення похибок при непрямих вимірюваннях.
41
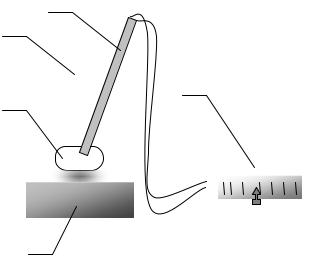
Лабораторна робота №11
ВИЗНАЧЕННЯ ЗМІНИ ЕНТРОПІЇ КРИСТАЛІЧНОГО ОЛОВА В ПРОЦЕСІ ЙОГО НАГРІВАННЯ
Мета роботи: визначити температуру фазового переходу 1 роду для кристалічного олова і зміну ентропії протягом процесу його нагрівання.
Обладнання: порожнистий циліндр з оловом, термопара, електропіч.
Опис лабораторної установки
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
Лабораторна |
установка |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(рис. 11.1) |
складається |
з |
||
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
металевого циліндра (1) в якому |
|||||
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
знаходиться |
олово (2). В |
олово |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
опущено термопару (3), що |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
з`єднана |
з |
вимірювальним |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
приладом (4). Металевий циліндр |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
з |
оловом |
розміщено |
на |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
електроплитці (5). |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
Рис. 11.1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Короткі теоретичні відомості
Фазою речовини називають стан термодинамічної рівноваги речовини, відмінний за фізичними властивостями від інших можливих станів цієї речовини.
Перехід речовини з однієї фази в іншу, наприклад, з твердої в рідку, називають фазовим переходом. За фазових переходів 1 роду теплота поглинається або виділяється (її називають теплотою фазового переходу). Переходи 2 роду характеризуються постійною температурою та густиною речовини і, наприклад, стрибкоподібною зміною теплоємності. За фазових переходів 2 роду поглинання або виділення теплоти не відбувається.
42
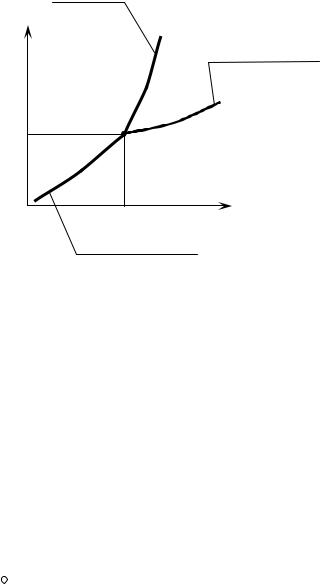
Прикладом переходу 2 роду може бути перехід заліза з феромагнітного стану в парамагнітний.
На |
рис. 11.2 |
зображено |
|
|
|
|||
діаграми |
твердого, |
рідкого |
та |
|
крива |
|
||
|
плавлення |
|
||||||
|
|
|
|
|
|
|
|
|
газоподібного |
стану |
(фаз) |
|
|
крива |
|||
речовини. |
Криві |
розбивають |
P |
|
||||
|
випаровування |
|||||||
|
|
|||||||
|
|
|
|
|
|
|
|
|
координатну |
площину на |
три |
|
тверде |
|
|||
|
|
|
|
|
|
|
рідина |
|
області: |
тверда, |
рідка |
|
та |
|
тіло |
||
|
PK |
|
||||||
газоподібна |
фази. |
Перехід |
з |
К |
|
|||
|
|
|||||||
|
|
|
|
|
|
|
|
|
однієї області в |
іншу |
і |
є |
|
|
газ |
||
|
|
|
||||||
переходом 1 роду. Крім того, на |
|
TK |
|
|||||
|
|
|
||||||
Oкрива T
графіку показано потрійну точку |
сублімації |
|
|
|
|
К, в якій |
речовина може |
Рис. 11.2 |
|
|
|
існувати одразу в трьох станах |
|
|
при тиску PK |
та температурі TK . Точка К називається точкою Кюрі. В деяких |
|
речовинах відносно цієї точки і відбувається переходи 2 роду. |
||
Зведеною кількістю теплоти, яка передається тілу в процесі його |
||
нескінченно |
малого нагрівання, називають відношення dQ/T , де dQ - |
|
нескінченно мала зміна теплоти; T - температура процесу.
Для будь-якого зворотного кругового процесу, сума зведеної кількості
теплоти дорівнює нулю: |
|
|
|
∫ |
dQ |
= 0 |
(11.1) |
|
|||
T |
|
||
Таким чином, підінтегральний вираз dQ/T |
є повним диференціалом |
||
функції, яка визначається тільки станом системи і не залежить від шляху,
яким система прийшла у цей стан. Означена функція S стану
термодинамічної системи, повний диференціал якої дорівнює зведеній кількості тепла, називається ентропією тіла:
dS = |
dQ |
(11.2) |
|
T |
|||
|
|
43
З цієї формули видно, що dS i dQ мають однакові знаки, внаслідок чого, за характером зміни ентропії є можливість визначити, в якому напрямі йде теплообмін. Ентропія визначається станом системи і характеризує саму
вірогідність цього стану.
Чисельно може бути визначена тільки зміна ентропії тіла, але не її значення в деякому стані. У випадку зміни температури тіла та при
відсутності фазового переходу можемо записати: |
|
|||
S = cmln |
T2 |
, |
(11.3) |
|
T1 |
||||
|
|
|
||
де c - питома теплоємність тіла; m - маса тіла; T1 і T2 - абсолютні температури тіла відповідно в станах 1 і 2.
Зміна ентропії при нагріванні і плавленні олова знаходиться як сума зміни ентропії при нагріванні до температури плавлення Tпл і при плавленні олова:
S = cmln |
Tпл |
+ λm , |
(11.4) |
|
|||
Tкімн |
Tпл |
|
|
де Tкімн та Tпл - кімнатна температура |
та температура |
плавлення олова |
|
відповідно, λ та c питомі теплота плавлення та теплоємність олова, m - маса
олова. |
|
Абсолютна температура тіла (вимірюється в градуса Кельвіна): |
|
T =τ O + 273, |
(11.5) |
де τ O - температура тіла в градусах Цельсія. |
|
Порядок виконання роботи
1.З дозволу викладача ввімкніть електроплитку до мережі.
2.Зачекайте 10 хв. поки установка прогріється належним чином.
3.За шкалою вимірювального приладу в момент часу ti визначте температуру олова в градусах Цельсія τiO та, згідно (11.5), в градусах Кельвіна Ti .
4.Повторіть вимірювання температури олова кілька разів через кожні 5 хв.,
поки його температура не досягне 230 – 235°С.
44
5.Вимкніть електроплитку та повторіть серію вимірювань температури олова в процесі його охолодження.
6.Занесіть отримані результати вимірювань до звітної таблиці 11.1.
Таблиця 11.1
ti , с
τiO ,°С
Ti , К
7.Накресліть графік експериментальної залежності температури олова від часу T = f (t).
8.Визначте для олова за графіком T = f (t) температуру фазового переходу 1 роду, якщо він відбувся (йому відповідатиме горизонтальна ділянка графіка).
9.За формулою (11.3) при відсутності фазового переходу 1 роду, або а формулою (11.4) при його наявності і згідно табл. Д2 розрахуйте зміну ентропії олова за увесь час зміни його температури.
10.Сформулюйте та запишіть висновок до роботи.
Контрольні запитання до лабораторної роботи № 11
Фазові переходи першого та другого роду. Ентропія, як функція стану термодинамічної системи. Оборотні та необоротні процеси. Фізичний зміст ентропії, формула Больцмана. Другий закон термодинаміки. Графічні методи обробки результатів вимірювань.
45
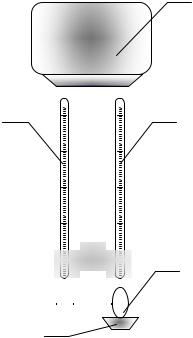
Лабораторна робота №12
ВИЗНАЧЕННЯ ВОЛОГОСТІ ПОВІТРЯ З ДОПОМОГОЮ ПСИХРОМЕТРА АСМАНА
Мета роботи: визначити абсолютну і відносну вологість повітря. Обладнання: психрометр Асмана, барометр.
Опис лабораторної установки
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5 |
Психрометр Асмана (рис. 12.1) складається з |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
двох однакових термометрів (1) і (2), резервуари |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
яких з метою захисту від впливу зовнішнього |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
середовища |
розміщені всередині |
відкритих |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
металевих трубок з подвійними стінками. |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Резервуар одного термометра огорнуто батистом |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(3), кінець якого опущено в невелику посудину з |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
водою (4). Таким чином, маємо сухий (1) та |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
вологий (2) термометри. |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Для точного визначення вологості повітря |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
резервуари сухого і вологого термометрів повинні |
|||
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
обдуватися потоком повітрям, швидкість якого має |
|||
|
|
|
Рис. 12.1 |
|
бути |
сталою, |
що й досягається з |
допомогою |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
вентилятора (5), який знаходиться у верхній частині приладу. Сухий термометр психрометра показує температуру повітря t1, а вологий – температуру t2 випаровування води, яка залежить від відносної вологості повітря.
Короткі теоретичні відомості
Внаслідок безперервного випаровування води з різноманітних поверхонь, повітря атмосфери завжди має в своєму складі деяку кількість водяної пари. Так вологість повітря має велике значення як при дослідженні різних явищ в атмосфері, так і в виробництві, побуті тощо. Для
46
характеристики вологості повітря користуються поняттями абсолютної, максимальної та відносної вологості.
Абсолютною вологістю повітря ϕ називається фізична величина, яка вимірюється масою водяної пари в грамах, що міститься в 1 м3 повітря при даній температурі (тобто густиною водяної пари). Часто абсолютну вологість визначають як парціальний тиск водяної пари і вимірюють її в міліметрах ртутного стовпа. Така заміна одиниці вимірювання абсолютної вологості зумовлена тим, що густина водяної пари і парціальний тиск її - величини пропорційні, про що говорить і рівняння Менделєєва-Клапейрона:
P = |
ρ |
|
RT , |
(12.1) |
|
||||
µ |
|
|
|
|
де P - парціальний тиск газу; ρ - густина газу; µ - молярна маса газу; R - |
||||
молярна газова стала; T - абсолютна температура газу. |
|
|||
Максимальна вологість повітря |
ϕmax визначається |
максимальним |
||
значенням абсолютної вологості повітря при даній температурі, коли воно стає насиченим.
Відносна вологість повітря r , що характеризує міру насиченості
повітря водяною парою визначається відношенням абсолютної вологості ϕ
повітря до її максимального значення |
ϕmax при |
даній температурі та |
||||||
виражається у відсотках: |
|
|
|
|
|
|
|
|
r = |
|
ϕ |
100% |
(12.2) |
||||
|
|
|
||||||
|
ϕ |
max |
|
|
|
|||
|
|
|
|
|
|
|||
Абсолютна вологість повітря може бути розрахована за формулою |
||||||||
Шпрунга: |
|
|
|
|
|
|
|
|
ϕ = ϕmax,2 |
− |
|
|
0,5 (t1 |
− t2 ) H |
|
||
|
|
|
|
|
, |
(12.3) |
||
|
755 |
|||||||
|
|
|
|
|
||||
де ϕmax,2 - максимальна вологість повітря за показами вологого термометра;
H - атмосферний тиск в мм.рт.ст., t1 і t2 - температури сухого і вологого термометрів відповідно.
47
Максимальні значення вологості повітря при різних температурах
повітря необхідно визначати за психрометричною таблицею.
Порядок виконання роботи
1.Змочіть батист вологого термометру в посудині з водою (можна разом з термометром).
2.З дозволу викладача ввімкніть прилад в мережу.
3.Після того як процес випаровування стане незмінним (температура вологого термометра перестане знижуватися), визначте за шкалою сухого
івологого термометрів температури t1 та t2 відповідно.
4.Не вимикаючи приладу з мережі, повторіть ще не менше 4 разів вимірювання показів сухого та волого термометрів через кожні наступні 5 хвилин.
5.Визначте за барометром атмосферний тиск H (мм.рт.ст.).
6.Знайдіть максимальні значення вологості повітря за показами сухого ϕmax,1
іволого ϕmax,2 термометрів, користуючись психрометричною таблицею
(табл. Д8).
7.За формулою (12.3) розрахуйте значення абсолютної вологості повітря ϕi .
8.Результати вимірювань та розрахунків внесіть до звітної таблиці 12.1.
|
|
|
|
|
|
|
|
Таблиця 12.1 |
№ |
t1, |
t2 , |
ϕmax,1 |
ϕmax,2 |
H |
ϕi |
ϕ −ϕi |
(ϕ −ϕi )2 , |
°C |
°C |
|
|
мм.рт.ст. |
|
(мм.рт.ст.)2 |
||
1 |
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Середнє: |
|
Сума: |
9. |
Визначте середнє арифметичне значення абсолютної вологості повітря: |
|||||||
|
|
1 |
n |
|
|
ϕ |
= |
∑ϕi , |
(12.4) |
||
|
|||||
|
|
n i=1 |
|
||
де n - кількість значень.
48
10.Обчисліть середньоквадратичне відхилення:
S = |
∑n (ϕ −ϕi )2 |
|
||
i=1 |
|
(12.5) |
||
n(n −1) |
||||
|
|
|||
11.Обчисліть абсолютну похибку: |
|
|
|
|
ϕ = tn,α |
S , |
(12.6) |
||
де tn,α - коефіцієнт Стьюдента. |
|
|
|
|
12.Запишіть остаточний результат: |
|
|
|
|
ϕ = ϕ ± |
ϕ |
(12.7) |
||
13.Визначте відносну похибку розрахунків: |
|
|||
ε = |
ϕ 100% |
(12.8) |
||
|
ϕ |
|
|
|
14. У відповідності з виразом (12.2) розрахуйте середнє значення відносної вологості повітря:
r = |
|
ϕ |
100% |
(12.9) |
|
ϕ |
max,1 |
||||
|
|
|
|||
|
|
|
|
15.Сформулюйте та запишіть висновок до роботи.
Контрольні запитання до лабораторної роботи № 12
Насичена пара рідини, її тиск? Суміш газів. Парціальний тиск газу, який входить до суміші. Рівняння Менделєєва-Клапейрона. Закон Дальтона. Абсолютна та відносна вологість повітря. Точка роси. Обчислення похибок при непрямих вимірюваннях.
49
Лабораторна робота №13
ВИЗНАЧЕННЯ КОЕФІЦІЄНТУ ПОВЕРХНЕВОГО НАТЯГУ РІДИНИ ЗА ВИСОТОЮ ЇЇ ПІДНЯТТЯ В КАПІЛЯРНІЙ ТРУБЦІ
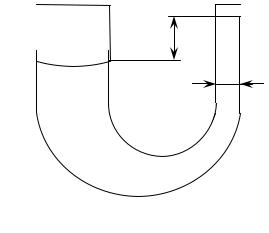
Мета роботи: визначити коефіцієнт поверхневого натягу рідини. Обладнання: U - подібна скляна трубка на підставці, оптична лава,
лінза, екран, штангенциркуль, досліджувана рідина, джерело світла.
H
D
Рис. 13.1
Опис лабораторної установки
Дана лабораторна установка складається з U - подібної трубки, що має коліна різного діаметру, яка розміщується на оптичній лаві. лабораторна установка містить лінзу, що проектує збільшене зображення трубки з водою на екран.
Короткі теоретичні відомості
Оскільки молекули рідини в поверхневому шарі рідини знаходиться в умовах, що результуюча сила їх взаємодії з молекулами рідини набагато більша результуючої сили їх взаємодії з молекулами газу, то на такі молекули буде діяти сила поверхневого натягу, спрямована в середину рідини Ця сила буде породжувати тиск на всю рідину, який називається
молекулярним. Дія сил молекулярного тиску аналогічна дії, яка б виникла, коли поверхня рідини являла собою розтягнуту плівку, що прагне до скорочення. Всі явища, що викликані існуванням молекулярного тиску,
вивчаються і пояснюються на прикладі такої розтягнутої плівки.
Для того, щоб розтягнуту плівку утримати в рівновазі,
перпендикулярно до лінії її границі, необхідно прикласти силу F , дотичну
до поверхні рідини. Ця сила і є силою поверхневого натягу. Вона тим більша,
чим більша довжина L контуру плівки: |
|
F = σL , |
(13.1) |
50
