
- •13.1. Нарушения основных периодов роста человека
- •13.2. Гипо- и гипербиотические процессы
- •13.2.1. Гипобиотические процессы
- •13.2.2. Гипербиотические процессы
- •13.3. Опухолевый рост
- •13.3.1. Эпидемиология опухолевых заболеваний у человека
- •13.3.2. Опухоли доброкачественные и злокачественные
- •13.3.3. Этиология опухолей
- •13.3.4. Биологические особенности опухолей, механизм их развития
- •13.3.5. Патогенез опухолевого роста (онкогенез)
- •13.3.6. Взаимоотношение опухоли и организма
- •13.4. Трансплантация клеток, тканей и органов
13.3.6. Взаимоотношение опухоли и организма
Проблема взаимоотношения опухоли и организма является одной из центральных в современной онкологии. Она включает два аспекта: 1) влияние опухоли на организм и 2) влияние организма на опухоль.
Влияние опухоли на организм. Паранеопластические синдромы
Паранеопластические синдромы - это совокупность признаков (симптомов), возникающих при выявлении опухоли, сопровождающих ее течение и исчезающих после удаления новообразования. Многие паранеопластические синдромы неспецифичны для определенных видов опухолей, могут возникать за месяцы и годы до развития клинических проявлений опухолевого процесса. Следовательно, многие стойкие отклонения в клинической картине должны вызывать онкологическую настороженность врача. Паранеопластические синдромы подразделяют на кожные, неврологические, психоневрологические, параэндокринные (см. раздел 13.3.4), метаболические (с развитием раковой кахексии), гематологические, сосудистые, почечные, костные, иммунодепрессию (с повышенной подверженностью к инфекционным заболеваниям) и др.
Среди кожных проявлений паранеопластического синдрома следует отметить эритему Гаммела, чернеющий акантоз, акро- и гиперкератоз, кожную порфирию, ихтиоз, гипертрихоз, псориаз, кожный зуд неясной этиологии, дерматомиозит. К группе неврологических проявлений паранеопластического синдрома относят мионейропатии (при миеломе, раке легкого и молочной железы), полиневриты, а также синдромы, напоминающие миастению. Часто при раке молочной железы, плоскоклеточном раке почки, яичка, щитовидной железы выявляется паранеопластический синдром гиперкальциемии, который сопровождается развитием неврологических проявлений при отсутствии видимых поражений метастазами костной системы. При аденоме паращитовидных желез и раке легкого отмечаются гиперкальциемия и остеопороз. Конкретным примером паранеопластического синдрома может служить карциноидный синдром, который проявляется усиленной продукцией серотонина, гистамина, ряда нейромедиаторов, гормонов, вызывающих клинические проявления в видесосудистых изменений.
|
|
Среди признаков гематологического паранеопластического синдрома выделяют анемию, не связанную с кровопотерей, эритроцитоз, полиглобулию (почечно-клеточный рак почки, опухоль Вильмса, рак надпочечников). Нередко при опухолях наблюдаются эозинофилия, моноцитоз, тромбоцитоз, лейкоцитоз, повышение СОЭ, нарушения системы свертывания крови - у большинства онкологических больных свертываемость крови повышена. Необходимо подчеркнуть, что факторы свертывающей и противосвертывающей систем крови могут способствовать инвазии опухолевых клеток в окружающие ткани, возникновению и стимуляции роста метастазов.
Продукты распада опухоли вызывают системную неспецифическую реакцию, заключающуюся в общей интоксикации организма, лихорадке. Продуцируемые злокачественными новообразованиями эктопические гормоны, нейромедиаторы, факторы роста могут влиять на клиническое течение и прогноз опухолевого процесса, а также использоваться в дифференциальной диагностике заболеваний.
Опухолевые маркеры
Начало изучения опухолевых маркеров было весьма обнадеживающим. Уже в конце XIX в. в моче больных множественной миеломой были обнаружены специфические белки (иммуноглобулины), получившие название «белки Бенс-Джонса», однако следующего успеха пришлось ждать более 80 лет. Он связан с открытием Г.И. Абелевым и Ю.С. Татариновым α-фетопротеина в крови больных гепатомой. Эти исследования положили начало новому этапу в изучении факторов, ассоциированных с ростом злокачественных опухолей, и привели к открытию в ХХ столетии серии различных соединений, получивших название «опухолевые маркеры». Маркеры широко используются клиническими биохимиками для выявления первичной опухоли и ее метастазов. К маркерам злокачественного роста относят вещества различной природы. В их число входит более 200 соединений: антигены, гормоны, ферменты, гликопротеины, липиды, белки, метаболиты, концентрация которых коррелирует с массой опухоли, ее пролиферативной активностью, а в некоторых случаях - со степенью злокачественности новообразования. Аномальная экспрессия генома - один из основных механизмов продукции маркеров опухолевыми клетка-
|
|
ми, который обусловливает синтез эмбриональных, плацентарных и эктопических белков, ферментов, антигенов и гормонов.
В качестве «идеальных тестов» для ранней диагностики злокачественных опухолей предлагалось множество маркеров, однако эта проблема до настоящего времени остается нерешенной. Сложности обусловлены многообразием требований, предъявляемых к «идеальному маркеру». Идеальный опухолевый маркер должен продуцироваться опухолевой клеткой в достаточных количествах, чтобы его можно было определить с помощью современных методов. Он не должен присутствовать у здоровых людей и при доброкачественных опухолях, но должен выявляться на ранних стадиях опухолевого процесса еще до клинических проявлений опухоли. Количество опухолевого маркера должно быть прямо пропорционально объему опухоли, а его уровень должен коррелировать с результатами противоопухолевого лечения.
В клинических исследованиях используется ряд достаточно эффективных «опухолевых маркеров», которые, однако, не всегда соответствуют всем вышеуказанным критериям в полной мере. Современные биохимические и иммунологические методы позволяют выявить новообразования, когда число опухолевых клеток достигает 109-1010, а минимальный уровень секретируемого опухолью маркера - от одного до нескольких фемтомолей в 1,0 мл сыворотки крови. Большая эффективность использования опухолевых маркеров в клинике может быть достигнута путем комбинации разных тестов. Следует отметить, что количество предлагаемых маркеров для диагностики и мониторинга злокачественных новообразований постоянно увеличивается, и наступает этап критической их переоценки с целью формирования стратегии и адекватного использования. Большинство опухолевых маркеров в достаточной степени изучено (см. табл. 13-4, 13-5). Из числа недавних успехов клинической биохимии следует отметить разработку и внедрение в практическую онкологию маркеров костного ремоделирования (пиридинолина, дезоксипиридинолина), поскольку кости скелета относятся к одной из наиболее распространенных локализаций метастазирования злокачественных опухолей. Биохимические методы диагностики метастазов в кости необходимы для правильного планирования лечебных мероприятий, определения стадии основного заболевания и оценки прогноза.
|
|
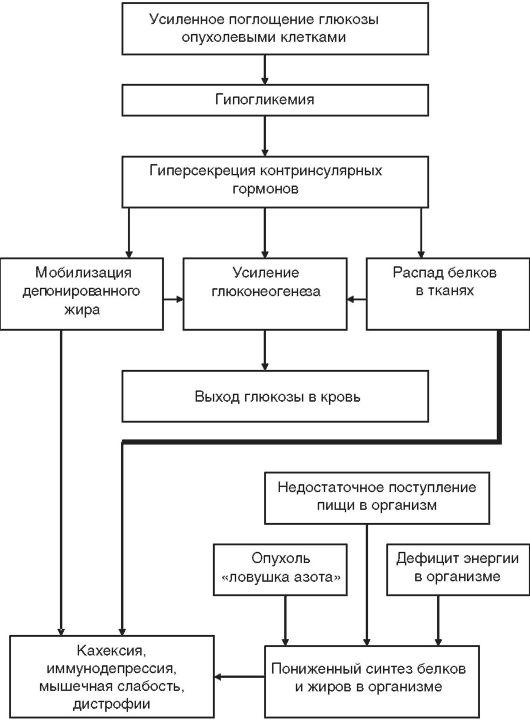 Рис.
13-9. Патогенез
раковой кахексии
Рис.
13-9. Патогенез
раковой кахексии
приспособительных механизмов. Усиливается продукция контринсулярных гормонов. Это приводит к усиленному распаду гликогена в печени и в мышцах, к распаду белков и жиров в тканях и органах организма для усиления процессов глюконеогенеза. Все это обеспечивает сохранение нормогликемии в течение достаточно длительного времени. Указанная компенсация так называемого «гипогликемического давления опухоли на организм» (по В.С. Шапоту) имеет нежелательные последствия для организма. Отмечается повышенный распад лимфоидной ткани, что сопровождается развитием иммунодефицитного состояния, тем более что процесс синтеза антител в организме при гипогликемии снижен. Кроме этого имеется повышенный распад мышечной ткани, в результате у больных развиваются дистрофические изменения в мышцах, мышечная слабость.
|
|
В организме-опухоленосителе ограничены возможности синтеза собственных белков и жиров, что усугубляет дистрофию тканей (мышечной, лимфоидной и др.) и кахексию. Это объясняется энергодефицитом (из-за гипогликемии), использованием метаболитов (аминокислот) для глюконеогенеза и снижением поступления питательных веществ в организм из-за анорексии, возникающей у онкологических больных.
Многие биологически активные вещества, выделяемые опухолями и нормальными клетками организма, способны влиять на развитие кахексии при онкологической патологии. К ним относятся цитокины, неконтролируемое выделение которых может быть одной из причин изменения обмена веществ в организмеопухоленосителе. Высказываются предположения о том, что TNF-α, IL-6 и γ-интерферон, повышенная экспрессия которых часто определяется при кахексии, могут выступать в качестве медиаторов этого процесса, способствуя развитию интоксикации, анорексии, снижению массы тела. При кахексии перечисленные цитокины определяются в повышенном количестве не только в опухоли, но и в циркулирующих жидкостях, а при снижении их содержания возможно обратное развитие кахексии.
В развитии кахексии, вызванной онкологической патологией, определенную роль может играть фактор мобилизации липидов, который осуществляет прямой гидролиз триглицеридов в жировой ткани до глицерина и неэстерифицированных жирных кислот. Введение сыворотки крови мышей с лимфомой здоровым особям вызывало массивную мобилизацию жиров. Фактор мобилизации
липидов присутствовал и в опухолевой ткани, и в культуре клеток лимфомы. Дальнейшие исследования показали, что это стабильный протеин с молекулярной массой около 5 кД, состоящий из двух субъединиц с высокой и низкой молекулярной массой. Он термостабилен, не реагирует на воздействие липазы, разрушается трипсином c образованием низкомолекулярной субъединицы, резистентной к воздействию протеолитических ферментов. Позже фактор мобилизации липидов был назван токсогормоном L. Его определили в асцитической жидкости больных гепатомой и у мышей с саркомой-180. Соединение с аналогичными характеристиками присутствовало в сыворотке крови больных с клиническими проявлениями онкологической кахексии и отсутствовало у здоровых пациентов. Оно также не было обнаружено у больных со значительным снижением массы тела при болезни Альцгеймера. Содержание фактора мобилизации липидов в сыворотке крови больных злокачественными опухолями коррелировало со снижением массы тела, а при эффективном лечении уровень определяемого фактора снижался.
|
|
Несмотря на большое число исследований по изучению механизмов развития кахексии при раке, медиатор этого состояния до настоящего времени не выявлен. На первый взгляд кахексия представляется невыгодным состоянием для опухоли, так как смерть организма ведет и к умиранию опухоли. Однако рост новообразования сильно зависит от экзогенного поступления липидов и аминокислот, поэтому выработка опухолью факторов, способствующих процессам катаболизма тканей, необходима для повышения метаболизма в ней самой. В этом случае ингибиторы кахексии при раке с помощью отграничения опухоли от главного энергетического материала, вероятно, могут вызвать снижение опухолевого роста. Все полученные результаты и высказанные исследователями предположения, возможно, помогут разработать новые подходы к лечению опухолей.
Влияние организма на опухоль. Противоопухолевая резистентность организма
Механизмы противоопухолевой защиты организма функционируют на всех этапах развития опухолевого процесса. В свою очередь, опухоль довольно успешно защищается от действия противоопухолевых механизмов организма путем изоляции клеток от их влияния, а также нарушением работы самих этих механизмов, и в
первую очередь иммунных. Многие исследователи связывают начало развития опухолевого процесса с нарушениями механизмов противоопухолевой резистентности организма. Подтверждением этому является более частое развитие опухолей у человека при наследственных иммунодефицитах.
Механизмы противоопухолевой резистентности подразделяются на следующие группы:
1. Антиканцерогенные механизмы направлены на защиту организма от действия канцерогенных факторов.
Существуют различные механизмы, которые удаляют или предупреждают действие физических, химических и биологических канцерогенных факторов. Так, например, эффект различных видов ионизирующего излучения, сопровождающийся усиленным образованием губительных для клетки свободных радикалов кислорода, ткани организма устраняют различными антиоксидантами. Выявлена активация ряда микросомальных ферментов (например, в печени) и антиоксидантов при попадании в организм химических канцерогенов с целью предотвращения образования активного их метаболита и/или ускорения обезвреживания самого бластомогенного фактора. Важное место среди этих антиканцерогенных веществ занимают ингибиторы β-глюкуронидазы, которые предотвращают распад глюкуронидов и высвобождение канцерогенных соединений. Если химические канцерогены имеют свойства гаптенов, они могут инактивироваться антителами и в последующем фагоцитироваться. Биологические канцерогенные агенты, в частности онкогенные вирусы, могут быть ингибированы специфическими противовирусными антителами и интерфероном. Натуральные киллеры уничтожают комплекс «вирус+клетка» путем продукции активных форм кислорода, перекиси водорода, лизосомальных ферментов, протеаз и фосфолипаз. Кроме того, инактивация канцерогенов осуществляется за счет их выведения из организма почками (в составе мочи), печенью (в составе желчи), кишечником (в составе кала), потовыми железами (в составе пота).
|
|
2. Антимутационные механизмы направлены на предотвращение трансформации нормальных клеток в опухолевые, это требует подавления активности онкогенов.
На этапе возникновения онкогенов клетка активирует антионкогенные механизмы (супрессорные гены). Генетический фонд клетки защищен мощным ферментным аппаратом, обеспечиваю-
щим восстановление (репарацию) ДНК. С помощью эндо- и экзонуклеаз, щелочных фосфатаз и ДНК-полимераз клетки вырезают измененные нуклеотиды и за счет соответствующих комплементарных участков второй нити ДНК (если она не повреждена) воссоздают исходную, генетически запрограммированную нуклеотидную последовательность поврежденной нити. Особенно важна в этих механизмах роль гена-супрессора клеточного деления (антионкогена) р53 (см. раздел 13.3.5). Практически все известные канцерогены индуцируют в клетках репаративный синтез ДНК.
3. Антицеллюлярные механизмы направлены на обнаружение и уничтожение уже возникших опухолевых клеток.
При появлении опухолевых клеток включаются как неиммунные, так и иммунные механизмы, которые направлены на уничтожение или предупреждение их размножения. Защита хозяина включает механизмы распознавания и элиминации мутантных, трансформированных и опухолевых клеток эффекторами системы врожденной неспецифической резистентности и специфического противоопухолевого иммунитета в случае антигенных опухолей. Неспецифическое распознавание опухолевых клеток эффекторами неспецифической резистентности и подавление их роста связаны с комплексом межклеточных взаимодействий и индукцией сети различных цитокинов, создаваемой при кооперации дендритных клеток, активированных макрофагов, NK-клеток, нейтрофилов и опухолевых клеток. Преимуществом системы неспецифической резистентности по сравнению со специфическим противоопухолевым иммунитетом является ее постоянная готовность распознавать единичные опухолевые клетки независимо от того, экспрессируют они специфические опухолевые антигены или нет. Наиболее эффективный контроль врожденной резистентности над возникновением первичных опухолей может осуществляться в начале латентного периода, когда число опухолевых клеток невелико, а их эволюционные генетические изменения, как правило, минимальны. В это время только немногие трансформированные клетки могут «ускользнуть» от эффективного распознавания и элиминации и начать размножаться. Однако при прогрессии опухоли с последующим естественным отбором более жизнеспособных клеток последние приобретают вторичные фенотипические свойства, которые делают их резистентными к цитотоксической активности эффекторов системы врожденной резистентности. Например, опухолевые клетки адсорбируют на своей поверхности фибриноген,
|
|
который быстро превращается в фибрин. Фибриновая пленка защищает эти клетки от противоопухолевых факторов организма. При этом среди неиммунных механизмов резистентности организма следует выделить лаброцитарный эффект, который связан со способностью тучных клеток продуцировать гепарин, препятствующий образованию зищитной фибринной пленки на поверхности опухолевых клеток. Изоляции опухолевых клеток от факторов неспецифической резистентности служат редукция микрокровообращения в ткани опухоли, ускользание их от влияний глюкокортикоидов, ингибирующих процесс пролиферации (это происходит, например, из-за уменьшения количества рецепторов для гормонов на мембране опухолевых клеток).
Специфический противоопухолевый иммунитет формируется на поздних стадиях опухолевого роста и малоактивен. Слабая антигенность опухолей (за счет антигенной дивергенции, антигенной реверсии и антигенного упрощения опухолевых клеток), развитие иммунодефицитного состояния в организме являются основными факторами, обеспечивающими неэффективность противоопухолевого иммунитета. Появление иммунодефицита в процессе развития опухоли может быть связано с эндокринно-обменными нарушениями в организме и, в частности, с увеличением продукции кортикостероидов. Их действие приводит к угнетению иммунной системы, а проявляется это в угнетении лимфопролиферации и образования антител. Нарушение иммунной системы считается одним из важных факторов и условий в возникновении, развитии и прогрессии опухолевого процесса.
