
- •Министерство образования и науки рф
- •Введение
- •Краткая характеристика нуклеиновых кислот клеток высших организмов
- •2.4. Определение сиаловых кислот в сыворотке крови методом Гесса.
- •4.4. Определение сиаловых кислот в сыворотке крови методом Гесса
- •2.1. Гидролиз казеина и определение в гидролизате фосфорной кислоты
- •4.1. Гидролиз казеина и определение в гидролизате фосфорной кислоты
- •2.1. Определение прочности связи между белковым и липидным компонентами липопротеидов ткани печени по качественной пробе л. Делямуре
- •2.2. Сделать выводы и оформить отчет.
- •4.1. Определение прочности связи между белковым и липидным компонентами липопротеидов ткани печени по качественной пробе л. Делямуре
- •4.1. Определение активности α-амилазы слюны и ее термолабильности
4.1. Определение активности α-амилазы слюны и ее термолабильности
Фермент -амилаза (диастаза) содержится в слюне и ускоряет гидролитическое расщепление -1,4-гликозидных связей в молекулах полисахаридов (крахмала, гликогена) до декстринов и мальтозы. Процесс распада полисахаридов в присутствии -амилазы включает в себя ряд стадий: крахмал амилодекстрины эритродекстрины ахродекстрины альтотетроза мальтоза. При этом нерасщепленный крахмал при взаимодействии с раствором йода дает синее окрашивание, амилодекстрины – фиолетовое, эритродекстрины – красно-бурое, ахродекстрины, альтотетроза и мальтоза – желтое. Кроме того, конечный продукт гидролиза крахмала – мальтоза – имеет свободную альдегидную группу, которую можно обнаружить реакцией Троммера (Фелинга).
В основе пробы Троммера лежит окислительно-восстановительная реакция восстановления гидрата окиси меди (синего цвета) в гидрат закиси меди (красного цвета) при нагревании. Таким образом, по окраске раствора, содержащего слюну и крахмал, с йодом или проведением реакции Троммера можно выявить степень активности -амилазы.
Одним из характерных свойств ферментов, является термолабильность, т.е. чувствительность к температуре, при которой протекает реакция. Для многих энзимов максимальная скорость реакции наблюдается при 38-40С. При нагревании выше 50С они утрачивают свойства биологических катализаторов вследствие денатурации, при этом степень инактивирования зависит от длительности теплового воздействия. При низких температурах ферменты хорошо сохраняются, но скорость ферментативного катализа мала. При повышении температуры от 0С до 40С скорость реакции увеличивается, а затем тепловая денатурация фермента снижает ее.
Ход работы
Слюну разводят в мерном цилиндре в 10 раз. В чистую пробирку отливают небольшое количество (2-3 мл) разведенной слюны и кипятят ее в течение 5-8 минут, а затем охлаждают.
В 4 пробирки наливают по 10 капель 1% раствора крахмала.
В первые две пробирки добавляют по 10 капель разведенной слюны.
В третью – 10 капель прокипяченной слюны.
В четвертую – 10 капель воды (в качестве контроля). Первую пробирку помещают в ледяную баню, а остальные – в термостат или водяную баню при температуре 38С на 10 минут.
После этого содержимое пробирок делят на 2 части и проводят качественные реакции на крахмал и продукты его расщепления (йодную пробу и пробу Троммера).
Йодная проба. К 2 каплям исследуемого раствора приливают 1 каплю раствора Люголя (раствора йода в KI). Первая проба приобретает фиолетовое окрашивание, третья и четвертая окрашиваются в синий цвет вследствие отсутствия или инактивации -амилазы, вторая проба приобретает буро-желтую окраску в связи с расщеплением крахмала активной -амилазой до декстринов.
Реакция Троммера. К 5 каплям исследуемой жидкости добавляют 5 капель 10% раствора едкого натра и 5 капель 1% раствора сернокислой меди. Содержимое пробирки нагревают над пламенем горелки. Появление красного цвета указывает на присутствие в растворе мальтозы и глюкозы (положительная реакция Троммера).
Результаты исследования записывают в таблицу 10:
Результаты опыта Таблица 10.
|
Материал исследования |
Субстрат |
Контрольные реакции |
Чем обусловлена реакция | |
|
Йодная проба |
Проба Троммера | |||
|
Свежая слюна (0С) |
Крахмал |
|
|
|
|
Свежая слюна (37С) |
Крахмал |
|
|
|
|
Прокипяченная слюна |
Крахмал |
|
|
|
|
Контроль (Н2О) |
Крахмал |
|
|
|
4.2. Влияние температуры на скорость ферментативной реакции
Ход работы
Берут 4 пробирки, наливают в них по 10 капель 0.5%-ного раствора крахмала (субстрата).
Первую пробирку ставят в снег (лед),
вторую оставляют при комнатной температуре (15-20оС), третью ставят в термостат при температуре 45оС,
четвертую - на водяной бане при температуре 75оС.
В 4 другие пробирки наливают по 10 капель дистиллированной воды и по 1 капле 0.1%-ного раствора йода. Через 5 минут в пробирки с крахмалом добавляют по 10 капель слюны, разведенной в 10 раз (1 капля слюны и 9 капель воды), хорошо перемешивают и оставляют при той же температуре (0, 15-20, 45 и 75оС).
Через 5 минут после того, как в пробирки добавили слюну, из каждой из них берут по 1-2 капле жидкости и вносят в заготовленные пробирки с йодом. Если во всех пробирках жидкость окрашивается в синий цвет, реакцию повторяют через 5 минут со вновь приготовленными пробирками с йодом, а затем повторяют еще через 5 минут.
Различная окраска при реакции с йодом, а, следовательно, разная степень гидролиза крахмала обусловлена разной скоростью ферментативного катализа при разных температурных условиях.
В работе важно уловить нужный момент для йодной пробы, так как при длительном гидролизе полное расщепление крахмала может произойти и при низких температурах опыта. Результаты опыта записывают в таблицу 11 и делают выводы.
Влияние температуры на действие фермента Таблица 11.
|
Температура, оС |
Окраска крахмала с йодом через определенное время, мин | |||
|
5 |
10 |
15 |
20 | |
|
0 оС |
|
|
|
|
|
15-20 оС |
|
|
|
|
|
45 оС |
|
|
|
|
|
75 оС |
|
|
|
|
4.3. Влияние реакции среды на активность ферментов и определение оптимума рН действия α-амилазы слюны
Каждый фермент наиболее активен в пределах довольно узкой зоны рН, называемой оптимумом рН. Для разных ферментов существует свой оптимум рН, совпадающий с их изоэлектрической точкой. Большинство ферментов активны при значениях рН, лежащих в области 6-8, однако некоторые энзимы имеют оптимальную активность в сильнокислой или сильнощелочной области. Так, для пепсина желудочного сока оптимум рН равен 1,5-2,5; для аргиназы печени – 9,5. Оптимум рН действия -амилазы слюны лежит в зоне 6,8-7,1. В кислой и щелочной средах активность амилазы снижается. Оптимум рН для нее можно определить при взаимодействии ее с крахмалом при различных значениях рН.
Ход работы
В 6 пробирок наливают растворы 0,2М двузамещенного фосфорнокислого натрия и 0,1М лимонной кислоты в количествах, указанных в таблице 12:
Приготовление буферных растворов Таблица 12.
|
№ пробы |
Количество 0,2М Na2HPO4, мл |
Количество 0,1М лимонной кислоты, мл |
рН смеси |
Количество буферной смеси, мл |
Количество разведенной слюны |
Количество раствора крахмала, мл |
Окрашивание с раство-ром Люголя |
|
1 |
2,5 |
2.5 |
5,0 |
0,1 |
1,0 |
2,5 |
|
|
2 |
3,0 |
2,0 |
5,8 |
0,1 |
1,0 |
2,5 |
|
|
3 |
3,5 |
1,5 |
6,3 |
0,1 |
1,0 |
2,5 |
|
|
4 |
4,0 |
1,0 |
6,9 |
0,1 |
1,0 |
2,5 |
|
|
5 |
4,5 |
0,5 |
7,5 |
0,1 |
1,0 |
2,5
|
|
|
6 |
5,0 |
- |
8,2 |
0,1 |
1,0
|
2,5
|
|
При этом получают буферные растворы с рН от 5,0 до 8,2.
В 6 других пронумерованных пробирок наливают по 2,5 мл 0,1% раствора крахмала и по 0,1 мл буферной смеси с различным значением рН. Затем в каждую добавляют по 1 мл разведенной в 10 раз слюны, перемешивают и на 5 минут помещают в термостат или водяную баню при температуре 38-40С. По истечении указанного времени пробирки вынимают и в каждую приливают по 1 капле раствора Люголя.
Оптимум рН действия амилазы слюны определяют по той пробирке, в которой произошло наиболее полное расщепление крахмала (при реакции с раствором йода в этом случае наблюдается красная или желтая окраска). Результаты исследования записывают в таблицу 12 и делают выводы.
4.4. Влияние активаторов и парализаторов на активность α-амилазы слюны
Активаторами и парализаторами (ингибиторами) называют вещества, способные ускорять или тормозить действие ферментов. Активаторы и ингибиторы часто используют при биохимических исследованиях для изучения отдельных ферментов в тканях. Добавлением различных ядов удается блокировать активные центры одних ферментов, не изменяя при этом действия других (специфическое ингибирование). В качестве примера можно привести действие производных диизопропилфторфосфата (ДФФ) на ферменты, содержащие в активном центре аминокислоту серин (холинэстераза) или монойодацетата на тиоловые ферменты. Специфическое ингибирование ферментов следует отличать от неспецифического, наблюдаемого при действии различных денатурирующих агентов на большинство белков-ферментов. К таким агентам относят температуру, минеральные и органические кислоты, соли тяжелых металлов в высоких концентрациях (соли ртути, свинца, меди и др.).
В некоторых случаях действие фермента не проявляется при отсутствии активирующих агентов. Например, -амилаза после диализа полностью теряет способность расщеплять крахмал, и вновь приобретает ее после добавления хлористого натрия. Таким образом, активность фермента значительно возрастает в присутствии ионов хлора, которые являются его активаторами. Кроме того, в структуру молекулы -амилазы входит ион кальция, который не только ее активирует, но и предохраняет от потери активности и гидролиза при действии протеолитических ферментов. Поэтому активность фермента ингибируется фторидами, цитратом, оксалатом и этилендиаминтетраацетатом натрия (ЭДТА), связывающими ионы кальция.
Если к смеси, содержащей крахмал и амилазу, в одном случае прилить хлористый натрий, в другом – воду (в качестве контроля), а в третьем – раствор сернокислой меди, то через некоторое время при действии раствора Люголя жидкость в пробе с NaCI окрасится в желтый цвет, в контрольной – в красный, а в пробе с CuSO4 - в синий. Различный цвет жидкостей обусловлен неодинаковой степенью гидролиза крахмала и свидетельствует об активирующем влиянии на фермент -амилазу слюны хлористого натрия и парализующем – медного купороса.
Ход работы
Берут 3 пробирки, наливают по 3 мл разведенной в 10 раз слюны и
в первую по 3 капли 1% раствора хлорида натрия
во вторую по 3 капли 1% раствора сульфата меди
в третью по 3 капли воды.
Затем в каждую пробирку добавляют по 5 капель 1% раствора крахмала, оставляют на 5 минут при комнатной температуре, после чего приливают по 1 капле раствора Люголя.
Различная окраска при реакции с йодом, а, следовательно, разная степень гидролиза крахмала обусловлена разной скоростью ферментативного катализа пи добавлении различных веществ. Результаты опыта записывают в таблицу 13 и делают выводы.
Результаты опыта Таблица 13.
|
Фермент |
Субстрат |
Окраска жидкости после добавлении йода в присутствии: | ||
|
NaCI |
CuSO4 |
H2O | ||
|
-амилаза |
крахмал |
|
|
|
4.5. Специфичность α-амилазы слюны
Одно из наиболее характерных свойств ферментов – их высокая специфичность. Энзимы способны катализировать только определенные химические реакции (каталитическая специфичность), а также обладают избирательностью действия по отношению к субстратам (субстратная специфичность). В зависимости от механизма действия выделяют ферменты с абсолютной и относительной специфичностью. Абсолютная специфичность действия заключается в способности фермента катализировать превращение только одного субстрата (аргиназа, уреаза). Для ферментов с относительной специфичностью существенное значение имеет тип преобразуемой химической связи в молекуле субстрата (пищеварительные ферменты – пепсин, трипсин, липаза, -амилаза и др.).
Фермент -амилаза слюны ускоряет гидролиз полисахаридов, имеющих в своем составе -1,4-гликозидную связь (крахмал, гликоген), но не действует на дисахариды, в том числе мальтозу, образующуюся при гидролизе крахмала. В слюне содержится также фермент мальтаза, которая ускоряет гидролиз только дисахарида мальтозы, но не оказывает никакого действия на дисахарид сахарозу. Следовательно, в слюне имеются ферменты, расщепляющие крахмал до мальтозы и глюкозы, и отсутствуют ферменты, расщепляющие сахарозу.
Сахароза (также как и крахмал) не является редуцирующим сахаром и не дает реакции Троммера. Однако, продукты гидролиза сахарозы и крахмала обладают восстанавливающей способностью (реакция Троммера в этом случае будет положительной).
Ход работы
В две пробирки наливают по 5 капель слюны.
В первую добавляют 10 капель 1% раствора крахмала,
во вторую – 10 капель 10% раствора сахарозы.
После чего помещают обе пробирки в термостат при температуре 37С на 10 минут. По истечении указанного времени пробирки вынимают из термостата и с их содержимым проводят реакцию Троммера.
При этом в пробирке с гидролизатом крахмала жидкость окрашивается в желтый цвет, в пробирке, содержащей сахарозу, окраска раствора не меняется.
Результаты работы заносят в таблицу 14 и делают выводы.
Результаты опыта Таблица 14.
|
Фермент |
Субстрат |
Основной тип гликозид-ной связи субстрата |
Проба Троммера | |
|
+ |
- | |||
|
Амилаза и мальтаза слюны |
крахмал |
-1,4- |
|
|
|
Амилаза и мальтаза слюны |
сахароза |
-1,2- |
|
|
5. СОСТАВЛЕНИЕ ОТЧЕТА
Отчет составляется с указанием цели, задания, экспериментальные данные и выводы.
6. ВОПРОСЫ ДЛЯ КОНТРОЛЯ
6.1. Что такое ферменты и какую роль они выполняют в организме?
Какова химическая природа фермента? В чем отличие ферментов-протеинов от ферментов-протеидов?
Какие составные части выделяют в молекулах холоферментов? Какова их роль в катализе?
В чем заключается отличие ферментов от неорганических катализаторов?
От каких факторов зависит активность ферментов?
Как обнаружить присутствие фермента в реакционной смеси? Как обнаружить присутствие -амилазы в слюне?
Что понимают под термолабильностью ферментов? С помощью каких приемов можно определить температуру, при которой наблюдается максимальная активность -амилазы?
Почему при температуре больше 50С большинство ферментов теряют свою активность?
Что понимают под оптимумом рН действия ферментов? Как можно определить оптимум рН действия -амилазы слюны?
Что такое активаторы и ингибиторы ферментов? Назовите активаторы и ингибиторы -амилазы.
Какие виды специфичности ферментов Вы знаете?
Какие ферменты содержатся в слюне? Гидролиз каких углеводов (крахмала или сахарозы) происходит при добавлении к ним слюны? С помощью какой реакции можно выявить наличие или отсутствие гидролитического расщепления крахмала или сахарозы?
Тема: БИОХИМИЯ СЛЮНЫ
1. ЦЕЛЬ
Изучить рН и состав слюны.
2. ЗАДАЧИ
2.1. Определить рН слюны.
2.2. Определить фосфаты в слюне.
2.3. Обнаружить роданиды в слюне.
2.4. Сделать выводы и оформить отчет.
3. ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Выделение слюны в слизистую полости рта осуществляется 3-мя парами желез. Клетки околоушной железы продуцируют секрет серозного типа, а клетки подчелюстной и подъязычной желез – секрет смешанного типа. При низкой скорости секреции слюна сильно гипотонична; ее осмотическое давление увеличивается с повышением скорости слюноотделения, и при его максимальной скорости слюна может становиться почти изотоничной плазме. Слюноотделение возникает рефлекторно – либо под воздействием безусловных рефлексов, вызванных факторами механического характера, например присутствие во рту инородного тела, или условно рефлекторно, например при виде и запахе пищи. Слюна смачивает пищевую массу и делает ее более скользкой, что облегчает проглатывание пищи.
Слюна человека содержит амилазу, катализирующую гидролиз полисахаридов до смеси олигосахаридов. Муцины подчелюстных желез содержат около 60% углеводов (сиаловую кислоту, N-ацетилгалактозамин, фукозу, галактозу). Олигосахаридные группировки муцинов образуют О-гликозидные связи с остатками серина или треонина полипептидной цепи. Полностью гликозилированные полипептидные цепи муцина в водных растворах ассоциируют за счет нековалентных взаимодействий, образуя высокомолекулярные агрегаты. Агрегаты муцина образуют структуры, отличающиеся значительной протяженностью, прочно удерживающие воду внутри молекулярного матрикса, благодаря этому раствору муцина обладают значительной вязкостью. Удаление сиаловой кислоты значительно снижает вязкость раствора муцина.
Неэнзиматические макромолекулярные гликопротеины слюны имеют особое значение для вязкости ротовой жидкости и тем самым для скольжения съеденных кусочков пищи. К тому же углеводные части несут анионные группы, которые обусловливают сильную гидратацию. Вязкость слюны в 10-20 раз выше, чем у плазмы.
4. ПРАКТИЧЕСКАЯ ЧАСТЬ
4.1. Определение рН слюны
Ход работы
Каплю слюны наносят на универсальную индикаторную бумагу и немедленно сравнивают полученную окраску со шкалой рН от 6.0 до 8.0.
В норме слюна имеет рН близкий к нейтральному (6.4-7.0). Сдвиг в кислую сторону нарушает процессы минерализации и способствует развитию кариеса, а также создаются условия для воздействия кислых протеиназ на ткани парадонта.
4.2. Определить фосфаты в слюне
Ход работы
2 мл слюны осаждают 2 мл 10% раствора ТХУ. Фильтруют. К 2 мл фильтрата добавляют 4 мл 5% раствора молибденовокислого аммония в 5 н. H2SO4 с добавлением 0.5% раствора аскорбиновой кислоты. Перемешивают и инкубируют в термостате при 45оС в течение 20 минут.
Наблюдают появление синего преходящего окрашивания, и выпадение осадка желтого цвета комплексного соединения фосфорномолибденовокислого аммония.
4.3. Обнаружение роданидов в слюне
Роданиды слюны обнаруживают по появлению красного окрашивания при добавлении к слюне хлорного железа. Это типичная и чувствительная реакция на роданиды обусловлена образованием роданистой соли трехвалентного железа в результате взаимодействия ионов Fe3+ и SCN- и образования различных комплексов, имеющими состав от Fe(H2O)5NCS2+ до Fe(NCS)63-. Некоторые органические соединения, например соли лимонной и уксусной кислот, препятствуют образованию окраски.
Ход работы
К 5 каплям слюны добавляют 2 капли 2% раствора HCl и 2 капли 0.01% раствора FeCl3.
На местах повреждения слизистой оболочки полости рта происходит эмиграция гранулоцитов, которые принимают участие в защитных реакциях. В гранулоцитах локализован фермент лактопероксидаза, которая окисляет имеющийся в слюне роданид с помощью перекиси водорода бактериального происхождения в гипотиоционат.
SCN- + Н2О2 → ОSCN- + Н2О
Гипотиоционат чрезвычайно бактерициден и совместно с Н2О2 или ее радикалами действует антикариесогенно. Содержание роданидов велико в слюне курильщиков, что связано с поступлением в их организм синильной кислоты табачного дыма.
5. СОСТАВЛЕНИЕ ОТЧЕТА
Отчет составляется с указанием цели, задания, включает условия протекания реакций, экспериментальные данные и выводы.
6. ВОПРОСЫ ДЛЯ КОНТРОЛЯ
6.1. Как определить рН слюны?
6.2. Как определить содержание фосфатов и роданидов слюне?
6.3. Чем связано увеличение роданидов в слюне у курильщиков?
Тема: КЛАССИФИКАЦИЯ ФЕРМЕНТОВ
1. ЦЕЛЬ
Изучить активность ферментов.
2. ЗАДАЧИ
2.1. Исследовать активность оксидоредуктаз
2.2. Изучить действие пероксидазы крови
2.3. Открыть действие каталазы крови
2.4. Определить активности каталазы крови по Баху и Зубковой
2.3. Сделать выводы и оформить отчет.
3. ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
В соответствии с природой катализируемых энзимами реакций выделяют 6 основных классов ферментов:
Оксидоредуктазы – энзимы, катализирующие окислительно-восстановительные реакции;
Трансферазы - обеспечивающие реакции межмолекулярного переноса химических групп;
Гидролазы - вызывающие гидролитическое расщепление внутримолекулярных связей в субстрате;
Лиазы - катализирующие реакции негидролитического расщепления или присоединения химических групп по месту локализации двойных связей;
Изомеразы - обеспечивающие ферментативные процессы изомеризации;
Лигазы (синтетазы) - ускоряющие реакции синтеза, т.е. соединения двух субстратов, протекающих за счет энергии гидролиза макроэргических связей АТФ.
4. ПРАКТИЧЕСКАЯ ЧАСТЬ
4.1. Исследование активности действия тирозиназы картофеля
К классу оксидоредуктаз относятся ферменты, катализирующие окислительно-восстановительные реакции. По химической природе они являются сложными белками. В их состав входят производные витаминов РР (НАД+, НАДФ+), В2 (ФМН, ФАД), соединения геминовой природы; аскорбиновая кислота, ионы металлов (Cu2+, Fe2+) и др.
Оксидоредуктазы делятся на подклассы в зависимости от того, какие химические группировки являются донорами или акцепторами электронов: 1) анаэробные дегидрогеназы осуществляют перенос атомов водорода от окисляемого субстрата на любое органическое соединение, но не на О2 (в качестве небелковой части они содержат, главным образом, производные витамина РР); 2) аэробные дегидрогеназы катализируют реакции переноса атомов водорода непосредственно на кислород с образованием перекиси водорода (по химической природе эти ферменты являются флавопротеинами); 3) оксидазы осуществляют транспорт водорода от субстрата на кислород с образованием в качестве конечного продукта воды (в их составе обнаруживаются ионы металлов, обычно ионы Cu2+); 4) цитохромы – гемсодержащие белки, участвующие в транспорте только электронов в цепях митохондриального и микросомального окисления; 5) оксигеназы катализируют реакции включения кислорода в молекулу окисляемого субстрата (в составе их молекул обнаруживаются НАДФН+Н+ и тетрагидробиоптерин); 6) гидроксипероксидазы, участвующие в разложении перекиси водорода.
Открытие действия тирозиназы картофеля
Тирозиназа (катехолоксидаза, полифенолоксидаза) относится к группе ферментов, действующих на фенолы (тирозин, катехоламины и полифенолы) и родственные им соединения. Акцептором электронов в реакции, катализируемой этим энзимом, служит молекулярный кислород.
Тирозиназа является металлопротеином, содержащим медь (0,20-0,25%). Ионы двухвалентной меди являются необходимым компонентом активного центра фермента, действующим как переносчик электронов в процессе окисления и восстановления. После ее удаления фермент инактивируется, в некоторых случаях происходит реактивация энзима ионами Cu2+. Тирозиназа распространена в растениях и грибах, особенно много ее содержится в клубнях картофеля. В организме животных и человека тирозиназа локализуется в основном в меланоцитах и катализирует превращение адреналина в физиологически неактивный адренохром. Последний, конденсируясь, превращается в бурый пигмент меланин.
Бронзовый цвет кожи при недостаточности коры надпочечников (болезнь Аддисона) обусловлен избыточной секрецией кортикотропина гипофизом, что приводит к стимуляции меланоцитов, чрезмерной активации тирозиназы в них и, как следствие, избыточному образованию меланина.
Ход работы
Измельченный картофель (0,5-1 г) растирают в фарфоровой ступке с 3 мл дистиллированной воды и фильтруют через два слоя марли. Фильтрат содержит фермент тирозиназу.
Если к раствору тирозина добавить вытяжку из картофеля, содержащую фермент, и смесь для контакта с кислородом воздуха встряхнуть, то жидкость через некоторое время приобретает сначала розовый, потом бурый и черный цвет. Реакция вызвана окислением тирозина кислородом воздуха и протекает благодаря каталитическому действию катехолоксидазы. При этом последовательно образуются галохром (5,6-дигидроксииндол-2-карбоновая кислота) красного цвета и меланин.
В две пробирки наливают по 1 мл вытяжки из картофеля. Содержимое одной пробирки кипятят 1-2 минуты и охлаждают в стакане с холодной водой. В обе пробирки добавляют по 5-10 капель 0,1% раствора тирозина, тщательно перемешивают и помещают в водяную баню при температуре 40-45С. Через 5 минут их вынимают и сильно встряхивают. Жидкость в пробирке с активной вытяжкой принимает сначала розовую, а затем бурую окраску. В контрольной пробе цвет жидкости не меняется.
Вместо тирозина можно использовать 0,1% раствор адреналина.
4.2. Изучение действия пероксидазы крови
Пероксидазы в большом количестве встречаются в растительных клетках. У животных их активность обнаруживается в эритроцитах, мышцах, молоке. Этот фермент катализирует реакцию окисления многих фенолов и аминов (в частности, гидрохинона, пирокатехина, гваякола, крезола, бензидина, фенилендиамина и некоторых других соединений), причем акцептором водорода в этом случае является перекись водорода. Пероксидаза может окислять также адреналин, в результате чего образуется адренохром. Таким образом, пероксидазой окисляются те же субстраты, что и полифенолоксидазой, но с участием Н2О2 или органических пероксидов.
Пероксидазы представляют собой протеиды, содержащие в качестве активной группы железопорфириновый комплекс (родственный гему гемоглобина). Вследствие этого они угнетаются цианидами, сероводородом, гидроксиламином, тиомочевиной, перекисью водорода (при проведении работы необходимо следить за тем, чтобы количество этих соединений в пробах не превышало допустимый уровень). Активность пероксидазы может угнетаться присутствием каталазы из-за усиления реакции разложения перекиси водорода.
Для изучения действия растительных пероксидаз используют водные экстракты хрена и картофеля. Об активности пероксидазы, полученной из растительных продуктов, можно судить по изменению окраски гваяковой смолы или бензидина в присутствии перекиси водорода, которые окисляясь, приобретают синюю окраску.
Ход работы
4.2.1. Гваяковая проба. К полученной взвеси хрена, картофеля или их водному экстракту добавляют 1-2 капли свежеприготовленного спиртового раствора гваяковой смолы. Затем приливают 1-2 капли 0,5% раствора перекиси водорода и наблюдают появление ярко-синего окрашивания. Если указанную пробу выполнять с прокипяченным препаратом фермента, окрашивание не появится, поскольку фермент инактивировался при кипячении.
4.2.2. Бензидиновая проба. К раствору, содержащему пероксидазу хрена или картофеля, добавляют 2-5 капель спиртового раствора бензидина и 1-2 капли 0,5% раствора перекиси водорода, в результате чего развивается темно-синее окрашивание, поскольку бензидин окисляется перекисью водорода в парахинондиимид, соль которого образует окрашенное соединение с неокисленным бензидином.
4.2.3. Пероксидаза крови. Для ее исследования кровь разводят водой в 10 раз и проводят гваяковую и бензидиновую пробы. Параллельно ставят опыт без крови или с ее прокипяченным раствором, в которых фермент либо отсутствует, либо инактивирован.
4.3. Открытие действия каталазы крови
Каталаза – фермент, присутствующий в клетках животных и растительных организмов (особенно много обнаруживается в печени и эритроцитах животных, где ее концентрация доходит до 0,1% сухого вещества клетки). Не обнаруживается она лишь у облигатных анаэробов.
По химической природе каталаза представляет собой олигомерный гемопротеин, так как в состав ее простетической группы входит вещество, близкое по строению к гему. Кроме того, в молекуле данного энзима наряду с геминовыми группами обнаруживается и желчно-пигментная.
Роль каталазы в обмене веществ очень велика. Ей принадлежит защитная функция – освобождение организма от непрерывно образующихся в нем перекиси водорода, фенолов, формальдегидов и т.д., что связывает ее с антиоксидантной защитной системой организма (разрушая токсичную Н2О2, фермент предотвращает развитие свободно-радикальных неконтролируемых процессов перекисного окисления липидов). Она предохраняет аскорбиновую кислоту и гемоглобин от сочетанного окисления, снабжает кислородом ряд тканей.
Каталаза ускоряет реакцию разложения перекиси водорода, которая в качестве донора и акцептора водорода использует Н2О2, по уравнению:
2 Н2О2 2 Н2О + О2.
Активность каталазы угнетается цианидами, сероводородом, гидрок-силамином, она неустойчива в сильнокислой среде.
Ход работы
4.3.1. К 2 мл дефибринированной крови приливают 1-2 мл 3% раствора перекиси водорода. При этом происходит обильное выделение кислорода. При повторении опыта с прокипяченной кровью каталазного действия не наблюдается.
4.3.2. К 2 мл молока добавляют 1 мл 3% раствора перекиси водорода и обнаруживают выделение пузырьков кислорода. В опыте с прокипяченным молоком оно отсутствует.
4.3.3. В две пробирки, содержащие по 2 мл свежего и прокипяченного картофельного сока, приливают небольшое количество 3% раствора перекиси водорода. При этом кислород начинает выделяться только в опыте с некипяченым соком.
4.4. Определение активности каталазы крови по Баху и Зубковой
Активность каталазы выражается количеством миллиграммов перекиси водорода, разрушенной за 30 минут при 18С. Количество Н2О2 определяют путем титрования раствором перманганата калия в кислой среде.
Ход работы
В небольшой стаканчик наливают 20 мл дистиллированной воды и добавляют 0,02 мл крови из микропипетки, ополаскивая ее при этом несколько раз. Таким образом, получают кровь, разведенную в 1000 раз.
В 4 конические колбочки емкостью 50 мл наливают по 7 мл дистиллированной воды.
В 2 первые колбы (опытные пробы) приливают по 1 мл разведенной в 1000 раз крови.
В две другие (контрольные пробы) – по 1 мл той же крови, но предварительно прокипяченной.
Затем во все колбы добавляют по 2 мл 1% раствора химически чистой перекиси водорода и на 30 минут ставят их в термостат с температурой 18С. По истечении указанного времени в колбочки наливают по 3 мл 10% раствора серной кислоты с целью прекращения действия каталазы и подкисления раствора и титруют 0,1N раствором перманганата калия до появления светло-розового окрашивания, не исчезающего в течение 30 секунд.
В первых двух колбах титруется остаток неразрушенной перекиси водорода, в двух последних – все ее количество, взятое для опыта. Долю разрушенной Н2О2 можно найти по разности между двумя титрованиями (в расчете учитываются средние значения титрования двух первых и двух последних проб).
Например, если на титрование контрольной пробы пошло 8 мл 0,1N раствора KMnO4, а на опытную – 3 мл, то количество перекиси водорода, разрушенной каталазой, соответствует 5 мл 0,1N раствора перманганата калия. Полученную разность умножают на 1,7 (так как 1 мл 0,1N раствора KMnO4 эквивалентен 1,7 мг Н2О2) и получают каталазное число исследуемой крови: 1,7 5 = 8,5 ед. В норме каталазное число колеблется от 10 до 15 ед.
Гипокаталаземия (снижение активности каталазы крови) отмечается при ряде инфекционных заболеваний: брюшном тифе, скарлатине, малярии, туберкулезе легких, хронических отравлениях соединениями свинца, мышьяка, ртути, фосфором. Гиперкаталаземия (повышение активности каталазы в крови) наблюдается у детей при бронхолегочных заболеваниях, при этом нарастание активности фермента находится в прямой зависимости от степени легочной недостаточности.
Определение каталазной активности крови представляет интерес в хирургической практике. При этом в ответ на оперативные вмешательства, проводимые под местной анестезией, отмечается подъем ее активности, тогда как операция под общим наркозом приводит к снижению активности энзима. Осложнения нагноительного характера сопровождаются снижением активности каталазы, однако для более точной интерпретации полученных результатов необходим подсчет числа эритроцитов.
5. СОСТАВЛЕНИЕ ОТЧЕТА
Отчет составляется с указанием цели, задания, экспериментальные данные и выводы.
6. ВОПРОСЫ ДЛЯ КОНТРОЛЯ
Как классифицируются ферменты по типу катализируемой реакции?
К какому классу ферментов относятся -амилаза и липаза?
При каких патологических состояниях в сыворотке крови одновременно повышается активность амилазы и липазы?
Какие методы количественного определения активности -амилазы в сыворотке крови и моче используют в клинической практике? На чем они основаны?
В каких органах происходит выработка -амилазы? Какие типы изоамилаз обнаруживаются в сыворотке и моче?
Каково значение количественного определения активности -амилазы в крови и моче?
Что является субстратом для липазы поджелудочной железы? Каковы условия ее функционирования? Как можно обнаружить присутствие липазы в вытяжке поджелудочной железы?
К какому классу ферментов относятся каталаза, пероксидаза, тирозиназа? Укажите подкласс перечисленных ферментов.
Какие из изученных Вами ферментов являются гемопротеидами? Какова их биологическая роль?
Какие соединения угнетают активность геминовых ферментов?
Что является донором и акцептором водорода в реакциях, катализируемых тирозиназой и пероксидазой?
Какую реакцию катализирует катехолоксидаза? Какова ее биологическая роль в организме человека?
На чем основано количественное определение каталазного числа крови?
К какому классу ферментов относится сукцинатдегидрогеназа? Что является ее субстратом? На чем основан принцип определения активности сукцинатдегидрогеназы в тканях?
Какие соединения являются ингибиторами сукцинатдегидрогеназы?
Какую реакцию катализирует аланинаминотрансфераза? В каких органах и тканях отмечается наибольшая активность данного фермента?
Что такое коэффициент де Ритиса? Чему он равен в норме? Как изменяется его величина при а) инфаркте миокарда, б) остром вирусном гепатите, 3) алкогольном гепатите?
Тема: ВОДОРАСТВОРИМЫЕ ВИТАМИНЫ
1. ЦЕЛЬ
Изучить качественные реакции водорастворимых витаминов.
2. ЗАДАЧИ
2.1. Провести качественные реакции на водорастворимые витамины;
Витамин В1 (тиамин)
Витамин В2 (рибофлавин)
Витамин РР (никотиновая кислота и ее амид)
Витамин В6 (пиридоксин)
Витамин С (аскорбиновая кислота)
Количественное определение витамина С
2.2. Сделать выводы и оформить отчет.
3. ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Витамины – это группа низкомолекулярных органических веществ различного химического строения, которые, присутствуя в пище в небольших количествах, являются незаменимыми ее компонентами и обеспечивают нормальное протекание биохимических и физиологических процессов путем регуляции метаболизма. При этом витамины не включаются в структуру тканей человека и не используются в качестве источника энергии. При отсутствии витаминов в пище развиваются заболевания, которые носят общее название – авитаминозы, а при их недостаточном содержании – гиповитаминозы. Если содержание витаминов в пище велико, то это тоже приводит к заболеваниям – гиперавитаминозам.
Многие витамины представляют собой исходный материал для биосинтеза коферментов и простетических групп ферментов. Поэтому высокая активность ферментов и их влияние на скорость обмена веществ зависит от обеспеченности организма витаминами. Ряд витаминов обладает регуляторными функциями, в частности участвует в регуляции проницаемости мембран и генной экспрессии. Некоторые витамины (Е, А и С), являясь антиоксидантами и предотвращая образование активных форм кислорода и перекисное окисление ненасыщенных жирных кислот мембранных липидов, также участвуют в регуляции клеточного метаболизма.
По растворимости витамины делят на две группы – водорастворимые и жирорастворимые.
Все водорастворимые витамины, за исключением витамина Р и С, содержат в своем составе азот, поэтому их объединяют в комплекс витаминов группы В. они обычно сопровождают друг друга в продуктах и обладают общим свойством – устойчивостью к нагреванию. В отличие от них витамин С к нагреванию не устойчив. При нагревании он быстро разрушается, особенно в присутствии кислорода и солей тяжелых металлов.
К водорастворимым витаминам относятся В1 – тиамин, В2 – рибофлавин, РР (В5) – никотиновая кислота и ее амид, В6 – пиридоксин, В3 – пантотеновая кислота, Н – биотин, Вс – фолиевая кислота, В12- цианкобаламин, В15 – пангамовая кислота, С – аскорбиновая кислота, Р – рутин. Водорастворимые витамины практически накапливаются в организме, поэтому его чувствительность к их недостатку особенно велика.
Витамин В1 (тиамин) состоит из пиримидинового и тиазолового колец.
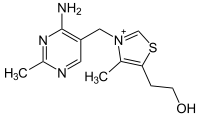
В организме он входит в состав коферментов ТПФ (тиаминпирофосфата) и ТТФ (тиаминтрифосфата).
ТПФ является коферментов ферментов декарбоксилирования (декарбоксилаз) α-кетокислот, поэтому при его недостатке процессы днкарбоксилирования будут нарушены. Это прежде всего относится к декарбоксилированию пировиноградной кислоты (ПВК) – важнейшего промежуточного продукта обмена углеводов
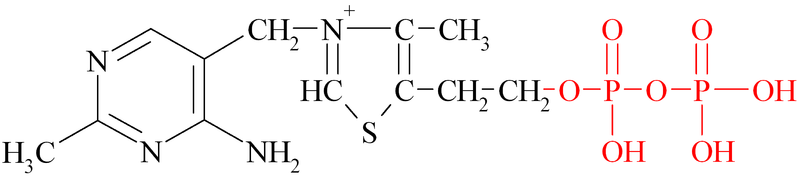
Витамин В2 (рибофлавин) относится к группе естественных пигментов, известных под названием флавинов. Он представляет собой метилированное производное изоаллоксазина, к которому присоединен спирт рибитол. Его биологическое действие во многом определяет наличие активных двойных связей в циклической структуре рибофлавина. По месту двойных связей легко присоединяется водород, при этом рибофлавин, вещество желтого цвета, восстанавливается в бесцветное лейкосоединение
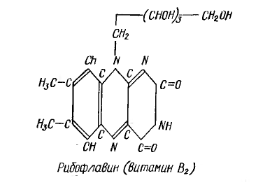
Рибофлавин входит в состав коферментов аэробных (вторичных) дигидрогеназ – в состав флавинадениндинуклеотида (ФАД). Поэтому при недостатке рибофлавина происходит нарушение процесса биологического окисления органических веществ, в частности окисления β-оксикислот (восстановленной формы никотинамидадениндинуклеотида (НАД х Н2).
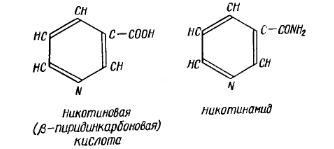
Витамин РР (никотиновая кислота и ее амид) является производным пиридина. Никотинамид входит в состав коферментов анаэробных (первичных) дегидрогеназ: НАД (никотинамидаденин-динуклеотида) и НАДФ (никотинамидадениндинуклеотидфосфата). Поэтому при недостатке витамина РР происходит нарушение процессов биологического окисления органических веществ – как тканевого дыхания, так и брожения.
Витамин В6 (пиридоксин). Пиридоксин – это общее название группы веществ, обладающих активностью витамина В6: пиридоксола, пиридоксаля, и пиридоксамина. Все они являются производными пиридина:
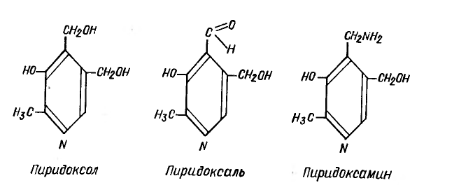
В организме витамин В6 играет большую роль в обмене белков и аминокислот. Он входит в состав коферментов ферментов троансаминирования (переаминирования) и поэтому участвует в процессах трансаминирования аминокислот (перенос аминогруппы аминокислоты на кетокислоту). Он также входит в состав декарбоксилаз некоторых аминокислот. Поэтому при недостатке витамина В6 нарушается белковый обмен.
Витамин С (аскорбиновая кислота) – вещество, которое по своей химической природе близко к углеводам. Оно очень не устойчиво:
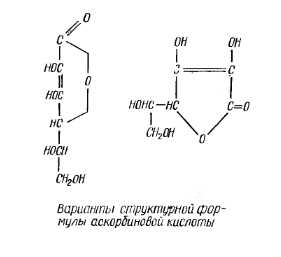
В живых организмах витамин С присутствует как в свободном, так и в связанном виде. Связанная с белком аскорбиновая кислота – аскорбиноген – обладает большей устойчивостью к окислителям, чем свободная кислота. Важнейшей особенностью аскорбиновой кислоты является ее способность к обратимому окислению (дегидрированию) с образованием дегидроаскорбиновой кислоты.
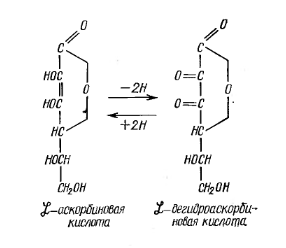
В живых организмах витамин С принимает участие в окислительно-восстановительных процессах, в синтезе стероидных гормонов, в превращениях аминокислот (тирозина и фенилаланина) и др. Это говорит о том, что биологическая роль аскорбиновой кислоты многообразна.
Для обнаружения витаминов применяют качественные реакции. Они основаны на цветных реакциях, характерных для группировок, входящих в состав витаминов.
4. ПРАКТИЧЕСКАЯ ЧАСТЬ
4.1. Качественная реакция на витамин В1 (тиамин)
Основная роль водорастворимых витаминов сводится к тому, что они являются исходными субстратами для синтеза коферментов, являющихся обязательными компонентами ферментативных реакций.
Коферментная функция водорастворимых витаминов
Таблица 15.
|
Название витамина |
Название коферментов |
Основные реакции, в которых принимает участие кофермент |
|
Тиамин |
Тиаминпирофосфат (ТПФ) |
Окислительное декарбоксилирование -кетокислот; транскетолаза |
|
Рибофлавин |
ФМН и ФАД |
Окислительно-восстановительные реакции |
|
Ниацин |
НАД+ и НАДФ+ |
Окислительно-восстановительные реакции |
|
Пиридоксин |
Пиридоксальфосфат |
Реакции трансаминирования, дезаминирования, декарбоксилирования аминокислот |
|
Кобаламин |
Метил- и дезоксиаденозилкобаламин |
Реакции метилирования и изомеризации метилмалонил-КоА |
|
Фолиевая кислота |
Тетрагидрофолат |
Перенос одноуглеродных радикалов, биосинтез ДНК |
|
Пантотеновая кислота |
HSKoA |
Реакции ацетилирования и ацилирования |
|
Аскорбиновая кислота |
|
Реакции гидроксилирования в синтезе коллагена, гормонов коры и мозгового слоя надпочечников, метаболизме тирозина |
Для обнаружения витаминов в пищевых продуктах или биологических объектах обычно используются качественные реакции, основанные на образовании характерного окрашенного соединения витамина с каким-либо химическим реактивом. Эти реакции также лежат в основе количественного определения витаминов в продуктах питания и жидкостях организма (сыворотка крови, моча), что имеет важное значение для определения обеспеченности ими организма человека.
Тиамин (солянокислый) – бесцветное кристаллическое вещество. Он содержится в хлебе из муки грубого помола, крупах, горохе, фасоли, пивных и пекарских дрожжах и мясных продуктах. Суточная потребность в этом витамине составляет 1,5-2 мг. Его коферментная форма – тиаминпирофосфат (кокарбоксилаза) – входит в состав ферментов, катализирующих реакции простого и окислительного декарбоксилирования -кетокислот (пировиноградной и 2–оксоглутаровой) и транскетолазы. Благодаря этому витамин В1 способствует окислению пирувата и 2-оксоглутарата в митохондриях и следовательно, образованию энергии из углеводов и аминокислот.
Как известно, транскетолаза обеспечивает деятельность неокислительной фазы пентозофосфатного пути окисления углеводов, который является главным источником НАДФН+Н+ и единственным источником рибозо-5-фосфата в клетках. Поэтому тиамин необходим для осуществления всех биохимических процессов, использующих НАДФН+Н+ (синтез жирных кислот, стероидов, дезинтоксикации лекарств и ядов и т.д.) и рибозо-5-фосфат (синтез нуклеотидов, нуклеиновых кислот, нуклеотидных коферментов).
Тиаминовая недостаточность, называемая болезнью бери-бери, проявляется нарушениями метаболизма и функций пищеварительной, сердечно-сосудистой и нервной систем. При данном заболевании увеличивается содержание пировиноградной кислоты в крови, моче, мозговой, нервной и других тканях, уменьшается ее использование в энергетическом обеспечении тканей, особенно зависящих от углеводов, что обуславливает возникновение нарушений функционирования нервной ткани и полиневриты. При заболевании бери-бери отмечается выраженный отрицательный азотистый баланс, быстрое общее истощение и атрофия органов.
4.1.1. Реакция окисления тиамина в тиохром основана на окислении тиамина в щелочной среде железосинеродистым калием. В результате реакции образуется желтый пигмент тиохром, обладающий голубой флуоресценцией.
Ход работы
К 1 капле 5% раствора тиамина (или к 1-2 мг порошка) добавляют 5-10 капель 10% раствора едкого натра, 1-2 капли 5% раствора железосинеродистого калия и перемешивают.
При нагревании жидкость окрашивается в желтый цвет вследствие превращения тиамина в тиохром. При освещении раствора тиохрома ультрафиолетовыми лучами можно наблюдать голубую флуоресценцию.
4.1.2. Диазореакция на тиамин.
Тиамин с диазореактивом образует в щелочной среде сложное комплексное соединение оранжевого цвета.
Ход работы
Диазореактив готовят, сливая в пробирку по 5 капель 1% раствора сульфаниловой кислоты и 5% раствора азотистокислого натрия.
Затем добавляют небольшое количество порошка тиамина (на кончике стеклянной палочки) и 5-7 капель 10% раствора бикарбоната натрия (по стенке наклоненной пробирки). На границе двух жидкостей появляется кольцо оранжевого цвета.
4.2. Качественная реакция на витамин В2 (рибофлавин)
Источником рибофлавина для человека служат продукты питания и частично кишечные бактерии. Им богаты печень, почки, желток куриного яйца, творог. В растительных продуктах содержится меньше рибофлавина. Суточная потребность в нем взрослого человека составляет 1-3 мг.
Рибофлавин входит в состав простетических групп флавиновых ферментов в виде флавинаденинмононуклеотида (ФМН) и флавинадениндинуклеотида (ФАД). Флавопротеиды составляют большое семейство окислительно-восстановительных ферментов, окисляющих различные метаболиты и переносящих водород на различные акцепторы. Флавиновые ферменты участвуют в синтезе гемоглобина и многочисленных реакциях окисления веществ в клетках: переносе электронов и протонов по дыхательной цепи, окислении пирувата, сукцината, 2-оксоглутарата, -глицеролфосфата, жирных кислот, биогенных аминов, альдегидов.
Недостаток в витамине В2 проявляется в снижении содержания его коферментных форм (прежде всего ФМН) в тканях, а также в симптомах поражения эпителия слизистых кожи и роговицы глаза. Наблюдаются сухость и покраснение слизистых губ и полости рта, трещины в углах рта и на губах, повышенное шелушение кожи (особенно лица) из-за медленного обновления клеток эпителия, сухость конъюктивы, ее воспаление, светобоязнь, прорастание роговицы сосудами (васкуляризация) и ее помутнение.
Окисленная форма рибофлафина представляет собой желтое вещество, флуоресцирующее в ультрафиолетовых лучах. В основе качественной реакции на витамин В2 заложена его способность восстанавливаться сначала в родофлавин (промежуточное соединение) розового цвета, а затем в бесцветное соединение лейкофлавин,
Ход работы
В пробирку наливают 10 капель раствора рибофлавина, добавляют 5 капель концентрированной соляной кислоты и небольшой кусочек металлического цинка.
В результате взаимодействия цинка с соляной кислотой происходит интенсивное выделение водорода. Жидкость в пробирке постепенно розовеет, а затем обесцвечивается.
Происходящая реакция обусловлена восстановлением рибофлавина выделяющимся водородом сначала в красный родофлавин, а затем в бесцветный лейкофлавин.
4.3. Качественная реакция на витамин РР (никотиновая кислота и ее амид)
Витамин РР при нагревании с раствором ацетата меди образует синий осадок медной соли никотиновой кислоты, плохо растворимый в воде.
В пробирку вносят 10 капель 1%-ного раствора витамина РР и нагревают до кипения, при этом если раствор был мутным, то он станет прозрачным.
К нагретому раствору витамина добавляют 10 капель 2%-ного раствора ацетата меди и снова нагревают до кипения, после чего пробирку сразу же охлаждают под струей холодной воды. На дне пробирки выпадает синий осадок медной соли никотиновой кислоты.
4.4. Качественная реакция на витамин В6 (пиридоксин)
Витамин В6 при взаимодействии с раствором хлорного железа образует комплексную соль типа фенолята железа красного цвета.
В пробирку вносят 10 капель 1%-ного раствора витамина В6, добавляют 10 капель 1%-ного раствора хлорного железа и хорошо перемешивают. Раствор в пробирке окрашивается в красный цвет.
4.5. Качественная реакция на витамин С (аскорбиновая кислота)
Источником витамина С являются овощи и фрукты. Суточная потребность в витамине составляет 70-100 мг.
Аскорбиновая кислота является донором водорода в окислительно-восстановительных реакциях, образуя редокс-пару с дегидроаскорбиновой кислотой. Восстановление дегидроаскорбиновой кислоты в аскорбиновую осуществляется дегидроаскорбатредуктазой с участием восстановленного глутатиона. Биологическое действие аскорбиновой кислоты связано с ее участием в реакциях биологического окисления.
Витамин С защищает гемоглобин, препятствуя его окислению; принимает участие в гидроксилировании пролина, лизина, что повышает прочность коллагеновых волокон; способствует синтезу хондроитинсульфатов соединительной ткани; участвует в обмене аминокислот тирозина и триптофана, стероидов, превращении фолиевой кислоты в коферментную форму, восстановлении Fe3+, что облегчает всасывание железа в кишечнике и поступление в ткани.
Дефицит витамина С ведет к цинге. При тяжелых формах заболевания наблюдается нарушение образования коллагена и хондроитинсульфата соединительной ткани. В результате повышаются проницаемость и ломкость капилляров, возникают подкожные кровоизлияния. При недостатке аскорбиновой кислоты снижается возможность использования запасов железа для синтеза гемоглобина в клетках костного мозга и участия фолиевой кислоты в пролиферации кроветворных клеток. Усиливающиеся при этом процессы перекисного окисления липидов вызывают гемолиз эритроцитов. Все это приводит к выраженной анемии. К внешним проявлениям цинги относятся: расшатывание и выпадение зубов, кровоточивость десен, отек и боли в суставах, бледность (анемичность) кожных покровов, подкожные кровоизлияния, поражение костей, замедление заживления ран.
Качественные реакции на аскорбиновую кислоту основаны на ее способности легко окисляться и восстанавливать такие вещества, как железосинеродистый калий, метиленовую синь, молекулярный йод, 2,6-дихлор-фенолиндофенол и др.
Ход работы
4.5.1. В 2 пробирки наливают по 1 капле 5% раствора железосинеродистого калия и по 1 капле 1% раствора хлорного железа.
В первую пробирку к зеленовато-бурой жидкости добавляют 5-10 капель 1% раствора аскорбиновой кислоты.
Во вторую – столько же дистиллированной воды.
Жидкость в первой пробирке приобретает зеленовато-синюю окраску и выпадает осадок берлинской лазури. Во второй пробирке зеленовато-бурая окраска раствора остается без изменений.
Реакция обусловлена окислением аскорбиновой кислоты и восстановлением железосинеродистого калия K3[Fe(CN)6] в железистосинеродистый калий K4[Fe(CN)6], который с хлорным железом образует берлинскую лазурь Fe4[Fe(CN)6]3.
4.5.2. В 2 пробирки наливают по 1 капле 0,01% раствора метиленовой сини и по 1 капле 10% раствора соды.
В первую пробирку добавляют 3 капли раствора аскорбиновой кислоты.
Во вторую – эквивалентное количество воды и нагревают над пламенем горелки.
В пробирке с аскорбиновой кислотой жидкость обесцвечивается.
4.6. Количественное определение аскорбиновой кислоты
Метод количественного определения аскорбиновой кислоты основан на ее редуцирующих свойствах, в частности способности восстанавливать йодат калия до свободного йода, количество которого определяют титриметрически по реакции с крахмалом.
Ход работы
2-10 г растительного материала измельчают, растирают в фарфоровой ступке с 40 мл дистиллированной воды в течение 10 минут и полностью переносят в мерную колбу на 100 мл. Ступку ополаскивают водой, которую сливают в ту же колбу. Общий объем в мерной колбе доводят до 100 мл дистиллированной водой и фильтруют раствор в сухой стаканчик или колбу.
В конические колбочки емкостью 100 мл наливают 10 мл фильтрата, 1 мл 2% раствора HCI, 0,5 мл 1% раствора KI и 2 мл 0,5% раствора крахмала. Смесь доводят водой до 20 мл, перемешивают и титруют из микробюретки 0,01N раствором йодата калия до устойчивого синего окрашивания. Все операции по определению аскорбиновой кислоты следует проводить быстро (в течение 10 минут). Параллельно осуществляют контрольное титрование смеси реактивов, при этом вместо 10 мл фильтрата в пробу вносят 10 мл воды.
Вычисляют результаты по разности количества 0,01N раствора йодата калия, затраченного на титрование контрольной и опытной проб. Например, если разница при титровании составляет 2 – 1 = 1 мл 0,01N раствора йодата калия, то количество аскорбиновой кислоты равно 1 0,088 = 0,088 мг в 10 мл или 0,88 мг в 100 мл вытяжки (исходя из того, что 1 мл 0,01N йодата калия соответствует 0,088 мг аскорбиновой кислоты). Далее производят расчет количества витамина С в 100 г продукта, учитывая навеску растительного материала.
5. СОСТАВЛЕНИЕ ОТЧЕТА
Отчет составляется с указанием цели, задания, включает уравнения протекания реакций, экспериментальные данные и выводы.
6. ВОПРОСЫ ДЛЯ КОНТРОЛЯ
Что такое витамины? Какова их биологическая роль?
По какому принципу классифицируются витамины? Какие классы витаминов при этом выделяют? Перечислите витамины, относящиеся к каждому из указанных Вами классов.
Дать понятие «авитаминозы» и «гиповитаминозы». Каковы причины их возникновения?
Что является источниками витаминов?
Как можно оценить витаминную обеспеченность организма?
6.6. В состав каких коферментов входят тиамин, рибофлавин, пиридоксин, ниацин? В каких реакциях метаболизма участвуют эти коферменты?
6.7. С помощью каких качественных реакций можно обнаружить присутствие тиамина, рибофлавина, ниацина, пиридоксина, аскорбиновой кислоты? В чем заключается механизм данных реакций?
Какие свойства аскорбиновой кислоты составляют основу метода ее количественного определения? В чем заключается принцип этого метода?
Тема: ЖИРОРАСТВОРИМЫЕ ВИТАМИНЫ
1. ЦЕЛЬ
Изучить качественные реакции жирорастворимых витаминов.
2. ЗАДАЧИ
2.1. Провести качественные реакции на жирорастворимые витамины;
Витамин А (ретинол)
Витамин Д (эргокальциферол)
Витамин К (филлохинон)
Витамин Е (токотриенол)
2.2. Сделать выводы и оформить отчет.
3. ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
К жирорастворимым витаминам относятся витамины А (ретинол), Д (эргокальциферол), Е (токотриенол), К (филлохинон), Q (убихинон), F (комплекс ненасыщенных жирных кислот – линолевой, линоленовой и арахидоновой). Витамины, растворимые в жирах, могут накапливаться в организме человека, и поэтому кратковременный дефицит их поступления не приводит к каким-либо неблагоприятным последствиям.
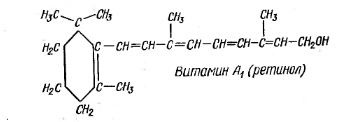
Витамины А (ретинол). Биологически активный витамин А содержится только в животных продуктах. В настоящее время выделены два вещества, обладающие активностью витамина А: витамин А1 – из печени морских рыб и витамин А2 - из печени пресноводных рыб. Витамин А2 отличается от витамина А1 наличием дополнительной двойной связи в кольце (между 3 и 4 углеродными атомами).
В растениях содержатся пигменты, которые являются провитаминами витамина А. В животных организмах под влиянием фермента каротинокиназы они превращаются в витамин А. К ним относится каротин – желтый пигмент растений. Витамин А в организме принимает участие в образовании зрительного пурпура – родопсина. Кроме того, он поддерживает стабильность клеточных мембран
Витамин Д является производным циклопентанпергидро-фенантрена. Выделено несколько веществ, обладающих активностью витамина Д. Наиболее распространены витамин Д2 – эргокальциферол и витамин Д3 – холекальциферол.
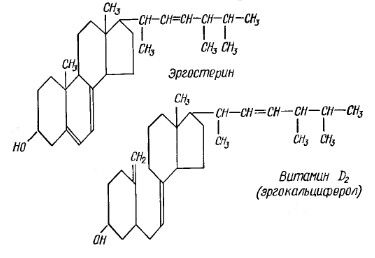
Биологически активный витамин Д содержится только в животных продуктах. Провитамином витамина Д2 является эргостерол. Он содержится в грибах и дрожжах. Провитамином витамина Д3 является холестерол – он содержится в коже. Провитамины превращаются в витамины под действием ультрафиолетовых лучей. Витамин Д в живых организмах участвует в процессе костеобразования, так как влияет на обмен кальция и фосфора, а также на группу ферментов, осуществляющих всасывание кальция. При его недостатке кости становятся мягкими и искривляются:

Витамин Е (токоферол) существует в виде нескольких изомеров: α-, β- и γ- токоферолов. Они отличаются друг от друга порядком расположения метильных групп в бензольном ядре.
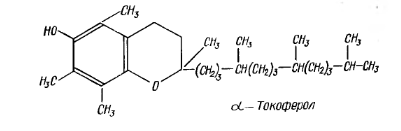
При недостатке витамина Е нарушаются процессы размножения, наступает бесплодие. Витамин Е оказывает влияние на окислительные процессы в организме, принимая участие в окислительно-восстановительных реакциях, связанных с окислительным фосфорилированием. Кроме того, он является прекрасным природным антиокислителем и стабилизирует витамин А.
Витамин К (филлохинон) является производным нафтохинона. Существует два природных вещества, обладающих активностью витамина К – К1 и К2.
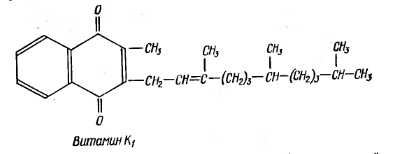
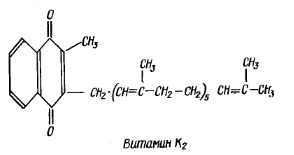
В живых организмах витамин К входит в состав простетической группы ферментов, участвующих в биосинтезе протромбина.
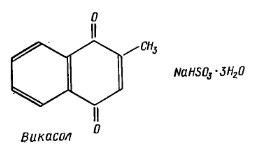
Он участвует также в регуляции процессов фосфорилирования. Искусственно синтезирован викасол, который является производным витамина К3 (метилбензохинона).
Для обнаружения витаминов применяют качественные реакции. Они основаны на цветных реакциях, характерных для группировок, входящих в состав витаминов.
4. ПРАКТИЧЕСКАЯ ЧАСТЬ
4.1. Качественные реакции на витамин А
Наиболее богаты витамином А печень морских рыб, крупного рогатого скота и свиней, яичный желток, молочные продукты, морковь, томаты, свекла, салат. В овощах витамин А содержится в виде провитаминов – каротинов, которые в организме превращаются в ретинол. Суточная потребность в витамине А – 1-2,5 мг ретинола или 2-5 мг каротина.
Витамин А и его производные (ретиналь, ретиноевая кислота) регулируют рост и дифференцировку клеток развивающегося организма (эмбриона, молодого организма), деление и дифференцировку быстропролиферирующих тканей (хряща, костной ткани, эпителиальных клеток кожи и слизистых, сперматогенного эпителия и плаценты, что делает его необходимым для осуществления нормальной репродуктивной функции). Окисленная форма ретинола – цис-ретиналь – принимает участие в акте зрения в качестве небелкового компонента родопсина.
Наиболее ранними признаками недостаточности ретинола является нарушение темновой адаптации (сумеречная или ночная слепота – гемералопия или никталопия). При гиповитаминозе возникают также уменьшение массы тела, остановка роста (в молодом возрасте), пролиферация и ороговение эпителия (фолликулярный гиперкератоз), сухость кожи и слизистых, слущивание эпителия, нарушение репродуктивной функции, сухость конъюктивы глаза (ксерофтальмия), помутнение и размягчение роговицы (кератомаляция).
4.1.1. Реакция с серной кислотой
Ход работы
На сухое часовое стекло наносят 5 капель масляного раствора ретинола ацетата в хлороформе и 1 каплю концентрированной серной кислоты, в результате чего образуется красно-фиолетовое или красно-бурое окрашивание.
4.1.2. Реакция с хлоридом железа
Ход работы
В сухую пробирку вносят 1 каплю раствора ретинола ацетата и 5 капель хлороформа. Перемешивают и добавляют 3 капли хлорида железа. Отмечают появление желто-зеленого окрашивания.
4.2. Качественные реакции на витамин Д (эргокальциферол и холекальциферол)
Витамин Д – групповое обозначение нескольких веществ, относящихся по химической природе к стеринам. Существуют несколько витамеров витамина Д. Среди них наиболее активны эргокальциферол (Д2), холекальциферол (Д3) и дигидроэргокальциферол (Д4). Витамин Д2 образуется из растительного предшественника – эргостерина, а Д3 – из 7-дегидрохолестерина. Таким образом, эргостерин и 7-дегидрохолестерин являются провитаминами. Образование холекальциферола может происходить в коже человека и животных после их облучения ультрафиолетовым светом. Это объясняет тот факт, что дефицит витамина Д чаще встречается в северных широтах и зимой.
Витамин Д содержится в ряде продуктов животного происхождения (печень, молоко, дрожжах и др.) и растительном масле. Наиболее богата им печень рыб. Суточная потребность в данном витамине составляет для детей 12-25 мкг, а для взрослых – значительно меньше, однако потребность в витамине может возрастать у пожилых людей, ведущих домашний образ жизни или прикованных к постели и не подвергавшихся воздействию солнечного света.
Холекальциферол обладает малой активностью. Повышение его активности осуществляется за счет реакций гидроксилирования, протекающих в печени и почках. В печени образуется главная транспортная форма витамина Д – 25-гидроксихолекальциферол (25(ОН)Д3), доставляемая током крови в почки, где происходит образование производного 1,25-дигидрок-сихолекальциферола или кальцитриола (1,25(ОН)2Д3), обладающего гормональной активностью. Действие кальцитриола направлено на регуляцию фосфорно-кальциевого обмена. Это единственный регулятор перемещения кальция через мембрану энтероцитов против градиента концентрации. Он также стимулирует биосинтез в энтероцитах кальцийсвязывающего белка, что обеспечивает всасывание кальция и фосфатов в тонком кишечнике; усиливает реабсорбцию этих ионов в почечных канальцах. Следует отметить также, что обнаруженный витамин Д-зависимый сывороточный фактор активизирует поглощение кальция костной тканью. Все это способствует поддержанию нормального соотношения кальция и фосфора в плазме и внеклеточных жидкостях, что обеспечивает кальцификацию молодой растущей ткани.
Недостаток витамина Д в организме детей приводит к развитию рахита. При этом наблюдается: нарушение минерализации костей, что приводит к их деформации; позднее развитие зубов, гипотония мышц. У взрослых недостаток витамина Д проявляется размягчением костей (остеомаляцией), их хрупкостью (остеопорозом), возникающих вследствие вымывания из костной ткани солей кальция и фосфора.
Ход работы
4.2.1. В сухую пробирку вносят 1-2 капли раствора рыбьего жира и 1-2 капли раствора брома в хлороформе (1:60). Жидкость постепенно приобретает зеленовато-голубоватый цвет.
4.2.2. К 2 каплям рыбьего жира приливают 2-3 капли хлороформа и 1 каплю концентрированной серной кислоты, что вызывает ярко-желтое, постепенно переходящее в буро-красное окрашивание.
4.3. Качественные реакции на витамин Е (токоферол)
4.3.1. Реакция с хлоридом железа (III)
В сухую пробирку вносят 4-5 капель 0.1%-ного спиртового раствора α-токоферола, прибавляют 0.5 мл 1%-ного хлорида железа (III) и тщательно перемешивают. Раствор в пробирке приобретает красный цвет в результате окисления α-токоферола хлоридом железа (III) в α-токоферилхинон.
4.3.2. Реакция с концентрированной азотной кислоты
В сухую пробирку вносят 4-5 капель 0.1%-ного спиртового раствора α-токоферола, прибавляют 10 капель концентрированной азотной кислоты и тщательно перемешивают. Образуется эмульсия, которая при стоянии расслаивается. При этом ее верхний слой приобретает желтовато-красную или красную в результате окисления α-токоферола в α-токоферилхинон.
4.4. Качественные реакции на витамин К (викасол)
4.4.1. Реакция со щелочным раствором цистеина
В сухую пробирку вносят 5 капель 0.1%-ного спиртового раствора викасола, добавляют 2 капли 0.02%-ного раствора цистеина, 2 капли 10%-ного раствора гидроксида натрия и тщательно перемешивают. Раствор в пробирке приобретает лимонно-желтый цвет.
4.4.2. Реакция с анилином
В сухую пробирку вносят 10 капель 0.1%-ного спиртового раствора викасола, добавляют 5 капель раствора анилина и перемешивают. Раствор в пробирке приобретает красный цвет.
5. СОСТАВЛЕНИЕ ОТЧЕТА
Отчет составляется с указанием цели, задания, экспериментальные данные и выводы.
6. ВОПРОСЫ ДЛЯ КОНТРОЛЯ
6.1. Какова биологическая роль витаминов А, Д и К. Какие патологические состояния возникают при их дефиците в пище? Назовите основные симптомы этих заболеваний.
Какова биологическая роль витамина Е? Как изменится потребность в данном витамине при увеличении потребления растительных жиров, содержащих большое количество ненасыщенных жирных кислот?
Почему у новорожденных детей может развиваться геморрагический синдром?
Что такое провитамины? Назовите вещества, являющиеся провитаминами ретинола и кальциферола.
Почему у больных, прикованных к постели увеличена потребность в кальцифероле?
6.6. Почему при заболеваниях печени или почек у больного наблюдаются симптомы остеопороза?
6.7. С помощью каких реакций можно обнаружить ретинол, кальциферол, токоферол, викасол? Какие изменения наблюдаются в присутствии перечисленных витаминов в анализируемой жидкости?
Какие разновидности витамина К Вы знаете? В чем заключается отличие викасола от природных витаминов К? При каких патологических состояниях рекомендуется введение викасола? Какова его суточная доза при этом?
Тема: ВВЕДЕНИЕ В ОБМЕН ВЕЩЕСТВ. ЭНЕРГЕТИЧЕСКИЙ ОБМЕН
1. ЦЕЛЬ
Количественное определение АТФ и креатинфосфата в мышцах.
2. ЗАДАНИЕ
2.1. Количественное определение АТФ и креатинфосфата в мышцах
2.2.Сделать выводы и оформить отчет.
3. ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
В мышечной ткани содержится два макроэргических соединения – АТФ и креатинфосфат, которые обеспечивают по мере надобности мышцу энергией. Метод их определения в мышечной ткани основан на том, что два последних остатка фосфорной кислоты в АТФ, богатые энергией, как и фосфатный остаток в креатинфосфате, легко отщепляются при непродолжительном гидролизе в кислой среде – это так называемый лабильно связанный фосфор.
Сравнение содержания неорганического фосфора в пробах до и после гидролиза дает представление о количестве лабильно связанного фосфата, которое приходится на макроэргические соединения мышечной ткани. Количество неорганического фосфора определяют по цветной реакции с молибдатом аммония в присутствии аскорбиновой кислоты.
4. ПРАКТИЧЕСКАЯ ЧАСТЬ
4.1. Количественное определение АТФ и креатинфосфата в мышцах
Ход работы
0,5 г мышечной ткани гомогенизируют на льду с 5 мл охлажденного 2,5% раствора трихлоруксусной кислоты и фильтруют в мерную пробирку. Осадок на фильтре промывают 5 мл холодной дистиллированной воды, после чего доводят объем раствора до 10 мл.
В две пробирки отмеривают по 0,5 мл безбелкового фильтрата мышц и добавляют по 1 мл 1М раствора соляной кислоты.
Первую пробирку (опытную) кипятят 10 минут на водяной бане. Вторую пробирку (контрольную) кипячению не подвергают.
Дальнейшие процедуры с опытной и контрольной пробами проводят обязательно одновременно. После охлаждения в обе пробирки приливают по 1 мл 1М раствора едкого натра и 7,5 мл дистиллированной воды. Растворы в пробирках тщательно перемешивают и отмеривают по 0,5 мл жидкости в две другие пробирки, куда затем добавляют по 0,5 мл 1% раствора молибдата аммония, 0,5 мл 1% раствора аскорбиновой кислоты и 2 мл дистиллированной воды.
Смесь в пробирках перемешивают и выдерживают 10 минут при комнатной температуре, после чего колориметрируют при длине волны 670 нм в кюветах с толщиной слоя 10 мм против дистиллированной воды.
В опытной пробе (после гидролиза) определяемый неорганический фосфат представляет собой сумму лабильно связанного фосфата и фосфатных солей, присутствующих в ткани; в контрольной пробе присутствуют только фосфатные соли.
Из оптической плотности, найденной для опытной пробы, вычитают оптическую плотность, полученную для контрольной пробы. Количество лабильно связанного фосфора находят по калибровочному графику, который строят, измеряя экстинкцию стандартных растворов неорганического фосфора, обрабатывая их таким же образом, как и опытную пробу.
Количество лабильно связанного фосфора рассчитывают, учитывая разведение, по формуле:
Х = А 3,3 400 100,
где Х – содержание макроэргических соединений в пересчете на 1 мг АТФ в 100 г сырой ткани (мг/100 г); А – содержание АТФ в пробе, мг; 3,3 400 – коэффициент пересчета на 1 г ткани с учетом разведения растворов.
5. СОСТАВЛЕНИЕ ОТЧЕТА
Отчет составляется с указанием цели, задания, включает условия протекания реакций, экспериментальные данные и выводы.
6. ВОПРОСЫ ДЛЯ КОНТРОЛЯ
6.1 Какие термодинамические параметры системы определяют направление протекания химической реакции? Как они изменяются при самопроизвольном течении процесса?
6.2. Что такое открытая система? Основное условие существования открытых систем?
6.3. Что такое метаболизм? Из каких процессов он складывается?
Какие биологические функции выполняет метаболизм?
Что такое общие и специфические пути метаболизма?
Какие пути образования АТФ Вам известны? В чем их отличие друг от друга?
Какие соединения называются макроэргическими? Дайте понятие макроэргической связи.
Какие типы макроэргических соединений Вы знаете? Приведите примеры макроэргических соединений.
6.9. Что такое субстратное фосфорилирование? Какая форма свободной энергии используется в реакциях субстратного фосфорилирования?
Что такое окислительное фосфорилирование? Где в клетке оно имеет место?
Какие макроэргические соединения образуются в мышцах?
На чем основан метод определения лабильно связанного фосфата в мышечной ткани?
Приложение 1.
ТЕХНИКА БЕЗПАСНОСТИ ПРИ РАБОТЕ В БИОХИМИЧЕСКОЙ ЛАБОРАТОРИИ
ОБЩИЕ ПРАВИЛА
Все работы в лаборатории проводить в рабочей одежде – халате.
При пользовании реактивами обращать внимание на надписи на этикетке.
Не пробовать на вкус или на ощупь неизвестные вещества.
Не производить смешивания веществ, результаты реакций между которыми не известны.
Работу с выделением ядовитых газов и с сильно пахнущими веществами производить в вытяжном шкафу.
Не следует вдыхать выделяющиеся газы непосредственно из пробирки или направлять их в лицо.
Ввиду того, что водород, метан, этилен и ацетилен образуют с воздухом взрывчатые смеси, нельзя поджигать их у отверстия газоотводной трубки, не убедившись предварительно, что воздух полностью вытеснен из пробирки.
Не принимать пищу на рабочем месте и во время работы.
При возникновении пожара в лаборатории тушить его, прикрыв пламя тряпкой, асбестовым одеялом или засыпав песком. Ящики с песком должны быть в каждой лаборатории. Знать места расположения огнетушителей.
После работы поставить все реактивы на место, вымыть посуду, убрать рабочий стол.
В конце работы обязательно вымыть руки.
Любая работа заканчивается протоколированием результатов произведенных исследований.
Приложение 2.
РАБОТА СО ЩЕЛОЧАМИ, КИСЛОТАМИ И ПРОЧИМИ СИЛЬНОДЕЙСТВУЮЩИМИ И ЯДОВИТЫМИ РЕАКТИВАМИ
Набирать реактивы пипеткой из бутыли только в том случае, если сосуд наполнен не меньше чем наполовину.
При заборе реактива погружать пипетку до самого дна склянки, летучие кислоты не насасывать ртом, а пользоваться баллоном или автоматической пипеткой.
Во время заполнения пипетки не отвлекаться – смотреть только на пипетку.
После отмеривания реактива не класть использованную пипетку на стол, а опустить ее в сосуд для промывания.
Все работы с использованием кислот, щелочей и других сильнодействующих реактивов производить чрезвычайно осторожно и внимательно.
Если реактив попадает в рот или на кожу, промывать пораженное место водой, а затем нейтрализовать 3% раствором соды в случае кислоты или 3% раствором уксусной кислоты в случае щелочи.
Если реактивы прольются на стол, нейтрализовать кислоту содой, а щелочь уксусной кислотой, а затем вымыть стол водой.
