
Оптическое материаловедение и
.pdf1
Федеральное агентство связи Государственное образовательное учреждение высшего
профессионального образования «Поволжский государственный университет телекоммуни-
каций и информатики»
___________________________________________________
Кафедра физики
А.Г. Глущенко, С.В. Жуков
КОНСПЕКТ ЛЕКЦИЙ
ПО УЧЕБНОЙ ДИСЦИПЛИНЕ
Оптическое материаловедение
по направлению подготовки: «Фотоника и оптоинформати-
ка».
2
УДК 621.391
А.Г. Глущенко, С.В. Жуков.
Материалы и оптические элементы в фотонике. Конспект лекций. – Самара.: ГОУВПО ПГУТИ, 2010. – с.
Настоящее издание представляет собой учебное пособие к образовательному модулю ОПД.Ф.07 «Оптическое материаловедение» бакалаврской программы «Фотоника и оптоинформатика».
Учебное пособие предназначено для студентов, обучающихся по бакалаврскому направлению «Фотоника и оптоинформатика».
Рецензент:
Петров П.П. – к.т.н., доцент, доцент кафедры «
……….. » ГОУВПО ПГУТИ
Государственное образовательное учреждение высшего профессионального образования «Поволжский государственный университет телекоммуникаций и информатики»
Самара – 2010 |
Глущенко А.Г., Жуков С.В., 2010 |

3
Содержание — перечень тем и разделов
Наименование тем и разделов |
|
Стр. |
1. Введение
Эволюция термина «оптический материал», роль оптических материалов в оптоинформатике
2. Механизмы формирования оптических свойств конденсированных сред
2.1. Фундаментальное поглощение света
при изменении электронных состояний
2.2. Поглощение при изменении колебательных состояний, роль обертонов,
3. «Классические» стёкла»
3.1. Явление стеклования и природа стеклообразного состояния
3.2. Структура стекол и методы ее исследования
оптические характеристики, диаграмма Аббе
физико-химические свойства и номенклатура бесцветных оптических стёкол
классификация стеклообразующих систем по химическому составу, основные процессы технологии синтеза стёкол;
4. Широкозонные оптические кристаллы
методы выращивания кристаллов
анизотропия поглощения и излучения света
сопоставление оксидных и галоидных кри-
4
Наименование тем и разделов |
|
Стр. |
сталлов
кристаллы для фотолитографии
5. Узкозонные полупроводниковые кристаллы
специфика технологии получения
связь между оптическими параметрами и проводимостью
кремний и его место в современных высоких технологиях
6. Стеклокристаллические материалы
технологические приёмы получения
оптические ситаллы
оптическая керамика
фотохромные материалы
материалы для записи информации
нанокристаллические материалы
7. Эпитаксиальные технологии:
конструирование материала с заданным набором значений энергии и оптическим
спектром
, квантовые ямы, проволоки и точки
8. Современные тенденции развития оптических материалов
полифункциональность, миниатюризация оптических элементов, объединение и смешение понятий «оптический материал» и «оптический элемент»
5
Введение
За последние десятилетия произошли количественные и качественные изменения в науке об оптических материалах и устройствах, которые подвигли авторов написать этот курс лекций.
Появилась новая научная дисциплина – фотоника.
Фотоника — это наука о генерации, управлении и обнаружении фотонов, особенно в видимом и ближнем ин-
фракрасном спектре, а также о их распространении на ультрафиолетовой (длина волны 10-380 нм), длинноволновой инфракрасной (длина волны 15-150 мкм) и сверхинфракрасной части спектра (например, 2-4 ТГц соответствует длине волны 75-150 мкм), где сегодня активно развиваются квантовые каскадные лазеры. Фотоника покрывает широкий спектр оптических, электрооптических и оптоэлектронных устройств и их разнообразных применений. Коренные области исследований фотоники включают волоконную и интегральную оптику, в том числе нелинейную оптику, физику и технологию полупроводниковых соединений, полупроводниковые лазеры, оптоэлектронные устройства, высокоскоростные электронные устройства.
Развитие физики и современных технологий привело к тому, что невозможно найти агрегатное состояние вещества которое бы широчайшим образом не использовалось в современных оптических устройствах.
С другой стороны развилось понятие оптический элемент как фуцкционально специализированный элементарный структурный элемент фотонного устройства, основанный на оптических материалах.
Современные технологии так расширили сферу применения оптических явлений и материалов, в том числе и в повседневной жизни, что не знать на основе каких оптических материалов и как выполнены: светоизлучающие диоды, полупроводниковые лазеры, аналоговые и цифровые копиры, цифровые камеры и т.д. просто неприлично.
Исходя из вышесказанного, авторы попытались создать курс лекций, удовлетворяющий следующим требованиям:
6
1.Быть достаточно популярным – изложить физические основы строения и принципов работы материалов и оптических элементов в оптических устройствах наиболее доступно.
2.Наиболее широко (в рамках возможного) охватить круг современных оптических материалов, оптических элементов и устройств.
Курс лекций построен по принципу – агрегатные состояния вещества это скелетная основа, материалы и физические принципы их работы заполнение основы и наконец, оптические устройства это внешний слой.
Первая часть курса, из за огромного круга применений, посвящена полупроводниковым материалам и использованию их в современных оптических устройствах.
7
Лекция 1 Агрегатное состояние вещества.
Кристаллическое и аморфное строение вещества. Силы приводящие к образованию твердых тел.
Агрегатное состояние — состояние вещества, характеризующееся определёнными качественными свойствами
— способностью или неспособностью сохранять объём и форму, наличием или отсутствием дальнего и ближнего по-
рядка и другими. Изменение агрегатного состояния сопровождается скачкообразным изменением свободной энергии, энтропии, плотности и других основных физических свойств [1].
В современной физике выделяют следующие агрегатные состояния: твёрдое тело, жидкость, газ, плазма.
Твёрдое и жидкое состояния вещества относятся к конденсированным состояниям — атомы или молекулы вещества в них находятся настолько близко друг к другу, что неспособны свободно двигаться.
Изменение агрегатного состояния — термодинамические процессы, являющиеся фазовыми переходами. Выделяют следующие их разновидности: из твёрдого в жидкое — плавление; из жидкого в газообразное — испарение и кипение; из твёрдого в газообразное — сублимация; из газообразного в жидкое или твёрдое — конденсация. Отличительной особенностью является отсутствие резкой границы перехода к плазменному состоянию.
Понятие агрегатного состояния достаточно условно — существуют аморфные тела, сохраняющие структуру жидкости и обладающие небольшой текучестью; высокоэластичные состояния некоторых полимеров, представляющие нечто среднее между стеклообразным и жидким состоянием, жидкие кристаллы и другие. Также существуют плавные переходы между некоторыми агрегатными состояниями. С другой стороны стоит отметить наличие нескольких различных состояний твёрдых тел, как например, графит, алмаз и уголь, относящихся к одному агрегатному состоянию. Для описания различных состояний в физике чаще используется более широкое понятие фазы.
8
1.1. Твёрдое тело
Твёрдое тело — агрегатное состояние вещества, характеризующееся стабильностью формы и характером теплового движения атомов, которые совершают малые колебания около положений равновесия [2].
Твердое тело образуется при кристаллизации из жидкого состояния. Даже в перегретой жидкости существуют заро-
дыши кристаллов называемые кластерами. Они состоят из нескольких атомов и в своем строении несут элементарную структуру бедующего кристалла. Образуются они тогда когда при взаимодействии атомов жидкости их энергия флуктуационно аномально уменьшается и энергия притяжения превышает тепловую энергию беспорядочного движения.
Кластеры постоянно возникают и разрушаются. Чем ближе температура жидкости к температуре кристаллизации тем больше концентрация и возможный размер кластеров. При большой
скорости охлаждения скорость процесса образования кластеров превосходит скорость их роста. При этом образуется твердое тело состоящее из огромного числа зародышей кристаллов – аморфное твердое тело. При небольших скоростях охлаждения (особенно при наличии градиента температуры в зоне кристаллизации) скорость роста кластеров превосходит скорость их образования при этом кластеры разрастаются и возникают сросшиеся макроскопические кристаллы
– поликристаллы. При регулировании градиента температуры в зоне кристаллизации (особенно при использовании затравочных кристаллов) можно получить один большой - монокристалл.
Среди твердых тел различают кристаллические и аморфные твердые тела.
Кристаллы характеризуются пространственною периодичностью в расположении равновесных положений атомов существующей на больших расстояниях (такой порядок называется дальним порядком). В аморфных телах пространственная периодичность может наблюдаться только на очень малых расстояниях порядка элементарной ячейки кристалла (такой порядок называется ближним по рядком) (рис.1.1).

9
Рис. 1.1. Строение кристаллического и аморфного твердого тела
Согласно классическим представлениям, устойчивым состоянием (с минимумом потенциальной энергии) твёрдого тела является кристаллическое. Аморфное тело находится в метастабильном состоянии и с течением времени должно перейти
вкристаллическое состояние, однако время кристаллизации
часто столь велико, что метастабильность вовсе не проявляется.
Каморфным веществам принадлежат стекла (искусственные и вулканические), естественные и искусственные смолы, клеи и др. Стекло — твердотельное состояние аморфных веществ. Аморфные вещества могут находиться либо в стеклообразном состоянии (при низких температурах), либо в состоянии расплава (при высоких температурах). Аморфные вещества переходят в стеклообразное состояние при температурах ниже температуры стеклования T. При температурах свыше T, аморфные вещества ведут себя как расплавы, то есть находятся
врасплавленном состоянии. Вязкость аморфных материалов — непрерывная функция температуры: чем выше температура, тем ниже вязкость аморфного вещества.
Каморфным веществам относятся многие полимеры. Макромолекулы полимеров имеют цепь из сотен и тысяч атомов углерода, к которой боковыми связями присоединены группы OH, COOH, NH2, атомы водорода, хлора, фтора. В молекулы могут входить бензольные кольца и другие сочетания атомов.
10
Атомы и молекулы, составляющие твёрдое тело, плотно упакованы вместе. Другими словами, молекулы твёрдого тела практически сохраняют своё взаимное положение относительно других молекул и удерживаются между собой межмолекуляр-
ным взаимодействием.
Многие твёрдые тела содержат в себе кристаллические структуры. В минералогии и кристаллографии под кристаллической структурой подразумевается определённый порядок атомов в кристалле. Кристаллическая структура состоит из элементарных ячеек, набора атомов расположенных в особенном порядке, который периодически повторяется во всех направлениях пространственной решётки. Расстояния между элементами этой решётки в различных направлениях называют параметром этой решётки. Кристаллическая структура и симметричность играют роль в определении множества свойств, такие как спайность кристалла, электронная зонная структура и оптические свойства.
При применении достаточной силы любое из этих свойств может быть нарушено, вызывая остаточную деформацию.
Твёрдые тела обладают тепловой энергией, следовательно их атомы совершают колебательное движение. Тем не менее это движение незначительно и не может наблюдаться или быть почувствованным при нормальных условиях.
1.2. Строение, структура и дефекты твердых оптических материалов.
Оптические материалы делятся на кристаллические и аморфные. С физической точки зрения твердым телом считается только кристалл [9].
Кристаллы (от греч., первоначально — лёд, в дальнейшем — горный хрусталь, кристалл) — твёрдые тела, в которых атомы расположены закономерно, образуя трёхмернопериодическую пространственную укладку — кристаллическую решётку.
Кристаллы — это твёрдые вещества, имеющие естественную внешнюю форму правильных симметричных многогранников, основанную на их внутренней структуре, то есть на одном из нескольких определённых регулярных рас-

11
положений составляющих вещество частиц (атомов, молекул, ионов).
Рис. 1.2. Кристалл кварца
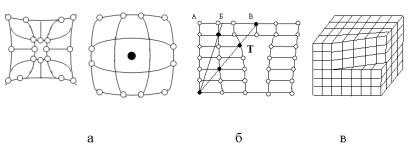
Его атомы располагаются в узлах регулярной пространственной структуры - кристаллической решетки, структурной единицей которой является элементарная ячейка. Трансляцией элементарной ячейки (сдвигом, поворотом) можно получить кристалл. Примеры ряда структурных схем кристаллов приведены на рис. 1.3.
В общем случае элементарная ячейка кристаллической решетки имеет вид косоугольного параллелепипеда (рис. 1.3, а), характеризуемого значениями сторон а, б, с и углов , , . По соотношению сторон и углов выделяют 7 кристаллических систем. Наиболее распространенными являются решетки
Рис. 1.3. Схемы элементарных ячеек кубические (рис. 1.3, б,в) и гексагональные (рис 1.3, г). Если в
центрах граней куба располагаются дополнительные атомы, то решетка называется гранецентрированной (ГЦК), если атом внедряется в центр куба - решетка объемно-центрированная
12
(ОЦК). Гексагональная плотно упакованная решетка имеет ячейку с основанием в виде правильного шестиугольника.
Все возможные кристаллические решетки возникают за счет различных типов взаимодействия между атомами и молекулами образующими твердое тело.
1.3. Силы приводящие к образованию твердых
тел.
Ионная связь.
Кристаллы такого типа образуют элементы из первой и второй подгрупп, и 6-й и 7-й подгрупп с другой сторо-
ны. При этом электроны с верхних уровней элементов первой и второй подгрупп заполняют электронные оболочки элементов 6(7) подгрупп и образовавшиеся ионы связываются силами электростатического притяжения. Электроотрицательностью
атома называют энергию, которая выделяется при добавлении к элементу лишнего электрона. Формально электроотри-
цательность может быть положительной (атомы Cl, O, S) или отрицательной (щелочные и щелочноземельные металлы). Чем больше разница электроотрицательностей элементов, тем больше они склонны к образованию ионной связи [3]. Ионная связь
самая сильная и составляет около 6-7 эВ на атом. Ковалентная связь.
В чистом виде ковалентная связь образуется между
элементами 4 подгруппы в кристаллах алмаза, кремния, германия. При этом электроны не переходят от атома к атому, а формируют общие электронные оболочки. Максимумы электронной плотности лежат посередине между ато-
мами. Если в кристаллической решетке узлы заняты разнородными атомами, то в таких кристаллах реализуется ковалентная связь, имеющая частично ионный характер [4]. Это означает, что максимумы электронной плотности лежат не строго посередине между атомами, а сдвинуты в сторону одного из типов атомов. К таким соединениям относятся SixGe1-x. Ковалентная
связь составляет около 4-5 эВ на атом. Металлическая связь.
Если в твердом теле зона проводимости частично за-
полнена, это означает, что электроны зоны проводимости
13
коллективизируют и взаимодействуют со всеми атомами кристалла. Строгое квантово-механическое рассмотрение энергии образования металлического кристалла вызывает трудности, поэтому в материаловедении пользуются эмпирическими выражениями для энергии связи, основанными на обработке экспериментальных данных о сжимаемости, теплоте сублимации
[5,6].
|
|
|
|
Eñâ |
|
Ae2 |
|
B |
|
Ce2 |
|
||
|
|
Например: |
|
|
|
, |
где |
||||||
|
|
1/ 3 |
2 / 3 |
|
|||||||||
|
4 |
|
|
|
|
|
|
|
|
||||
|
r3 |
- объем, приходящийся на один атом, ra |
– среднее |
||||||||||
|
|||||||||||||
3 |
a |
|
|
|
|
|
|
|
|
|
|
||
межатомное расстояние.
Первое слагаемое – потенциальная энергия электронов проводимости, второе слагаемое – кинетическая энергия электронов проводимости, третье слагаемое – потенциальная энер-
гия валентных электронов. Металлическая связь составляет
около 2,5-3 эВ на атом.
Связь Ван-дер-Ваальса.
Она возникает между атомами, имеющими заполненные электронные оболочки (кристаллы инертных газов), а также между некоторыми типами органических молекул. Между молекулами в молекулярных решетках действуют силы Ван-дер-Ваальса, энергия которых примерно на два порядка ниже, чем у атомных связей (порядка 0,07-0,1 эВ на атом) [7].
Водородная связь.
Водородная связь реализуется при взаимодействии органических молекул, имеющих в составе электроотрицательные атомы (N,O,F и т.д.). При этом атом водорода может связать два элекроотрицательных атома двух молекул. Если молекулы содержат одинаково расположенные электроотрицательные элементы, то между ними может возникнуть несколько водородных связей. Благодаря водородным связям на длинной органической молекуле в растворе, содержащем более простые органические молекулы, может синтезироваться сложная органическая молекула, имеющая строго заданное расположение электроотрицательных элементов. Водородная связь
14
прочнее связи Ван-дер-Ваальса [8]. Она характерна для взаимодействия молекул углеводородов, в частности, полимеров с кислородом окислов металла, является важнейшей формой связи между молекулами воды в жидком состоянии и в виде льда.
Энергия водородной связи порядка 0,3-0,5 эВ на атом.
Значения энергии перечисленных видов связей и характерные свойства кристаллов представлены в Табл. 1.1.
Таблица 1.1 Энергия связи и некоторые свойства кристаллов
|
|
Энергия |
|
|
Примеры |
связи, |
|
Тип |
кДж/моль |
||
кристал- |
|||
связи |
лов |
, |
|
|
(эВ на |
||
|
|
||
|
|
атом) |
NaCl
Ионная LiF
~ 1000
MgO
(6-7)
C (алмаз), Ковалентная Si, Ge, TiN,
~ 700
WC, SiC
(4-5)
Металличе- |
Fe, Cu, Al, |
~ 400 |
ская |
Ag, Na |
(2,5-3) |
Молекулярная |
Молекулы в |
~ 10 |
Некоторые свойства кристаллов
Малая электропроводность при низких и хорошая ионная проводимость при высоких температурах. Высокие прочность, твердость и температура плавления, хрупкое разруше-
ние. Высокая твердость, низкая электропроводность при малых температурах, хрупкость. Некоторые материалы являются полупро-
водниками. Высокая электропроводность и пластичность. Низкая температу-
|
|
|
15 |
|
|
|
Энергия |
|
|
|
Примеры |
связи, |
Некоторые свой- |
|
Тип |
кДж/моль |
|||
кристал- |
ства |
|||
связи |
лов |
, |
кристаллов |
|
|
(эВ на |
|||
|
|
|
||
|
|
атом) |
|
|
|
полимерах |
(0,07-0,1) |
ра плавления, |
|
|
Ar, CH4 |
|
сильная сжи- |
|
|
|
|
маемость, пластич- |
|
|
|
|
ность, ползучесть, |
|
|
|
|
вязкая упругость. |
|
|
|
|
Склонность к обра- |
|
|
|
~ 50 |
зованию разветв- |
|
Водородная |
H2O, HF |
ленных мно- |
||
(0,3-0,5) |
||||
|
|
гомолекулярных |
||
|
|
|
||
|
|
|
структур. |
Выводы:
1.Агрегатное состояние — состояние вещества, характеризующееся определёнными качественными свойствами — способностью или неспособностью сохранять объём и форму, наличием или отсутствием дальнего и ближнего порядка.
2.Твёрдое тело — агрегатное состояние вещества, характеризующееся стабильностью формы и характером теплового движения атомов, которые совершают малые колебания около положений равновесия.
3.Даже в перегретой жидкости существуют зародыши кристаллов называемые кластерами. Они состоят из нескольких атомов и в своем строении несут элементарную структуру бедующего кристалла. Образуются они тогда когда при взаимодействии атомов жидкости их энергия флуктуационно аномально уменьшается и энергия притяжения превышает тепловую энергию беспорядочного движения.
4.Среди твердых тел различают кристаллические и аморфные твердые тела. Кристаллы характеризуются пространственною периодичностью в расположении равновесных положений атомов существующей на больших расстояниях (такой порядок называется дальним порядком). В аморфных телах атомы колеблются вокруг хаотически расположенных точек, то
16
есть пространственная периодичность может наблюдаться только на очень малых расстояниях порядка элементарной ячейки кристалла (такой порядок называется ближним порядком).
5.Кристаллы — это твёрдые вещества, имеющие естественную внешнюю форму правильных симметричных многогранников, основанную на их внутренней структуре, то есть на одном из нескольких определённых регулярных расположений составляющих вещество частиц (атомов, молекул, ионов). Его атомы располагаются в узлах регулярной пространственной структуры - кристаллической решетки, структурной единицей которой является элементарная ячейка. Трансляцией элементарной ячейки (сдвигом, поворотом) можно получить кристалл.
6.Все возможные кристаллические решетки возникают за счет различных типов взаимодействия между атомами и молекулами образующими твердое тело. Наиболее распространенными, расположенными в порядке убывания являются: ионная, ковалентная, металлическая связи.
Вопросы и задания для самоконтроля по теме:
1.В чем отличие твердого тела от жидкости?
2.Чем отличаются кристаллические и аморфные твердые тела?
3.Что такое кластер?
4.При каких условиях можно получить монокри-
сталл?
5.При каких условиях можно получить аморфное твердое тело?
6.Какой тип взаимодействия в твердых телах наиболее сильный?

17
Лекция 2.
Идеальные механические свойства кристалла. Дефекты кристаллов и свойства кристаллов.
2.1. Идеальные механические свойства кристал-
ла.
Потенциальная энергия взаимодействия между парой изолированных атомов E выражается формулой
Å |
A |
|
B |
, |
(2.1) |
rm |
rn |
||||
где А, В, m, n – коэффициенты; r – объемный радиус. |
|||||
Первый член уравнения характеризует энергию сил отталкивания, второй – энергию сил притяжения. Поскольку сила взаимодействия выражается в виде
F |
dE n |
, |
(2.2) |
|
|||
|
dr |
|
|
то, подставляя ее значение в формулу (2.1), получаем
F |
|
mA |
|
|
bn |
|
|
|
|
|
(2.3). |
||
r |
m 1 |
r |
n 1 |
|||
|
|
|
|
|
||
На рис. 2.1.а показаны функции En(r), F(r). Имеется в виду, что один атом помещен в начале отсчета, второй можно перемещать вдоль оси r. При этом r0 - положение устойчивого равновесия, в котором находятся атомы при Т= ОоК. Если вещество нагрето, то второй атом будет колебаться относительно первого, и чем выше температура, тем больше размах его колебаний.
Если же кинетическая энергия превысит высоту потенциального барьера на величину En, то данный атом может оторваться от первого, и произойдет диссоциация. Пунктиром показан график зависимости силы от расстояния между атомами. При r = r0 сила взаимодействия равна нулю. Левая крутая ветвь характеризует силы отталкивания, а правая пологая - силы притяжения [2,10]. Истинное среднее расстояние между центрами атомов, как следует из сказанного, увеличивается с ростом температуры из-за асимметрии потенциальной кривой, что и является причиной теплового расширения.
18
0.1
Рис. 2.1. Силовые и энергетические характеристики межатомного взаимодействия
Когда атомы объединяются в кристалл, то потенциальные кривые накладываются, и у расположившихся в цепочку атомов (рис. 2.1,б) результирующая кривая имеет периодиче-
ский характер. Периодический характер имеет и зависимость
0.2)
силы от координаты, график которой изображен тонкой линией. Исходя из этого, напряжение, вызывающее сдвиг одной части кристалла относительно другой вдоль плоскости, парал- 0.3)лельной оси Х, так же, как и сила, препятствующая смещению атома A в положение Al, может быть представлено в виде
формулы
τ Ksin |
2 õ |
(2.4). |
|
b |
|||
|
|
С другой стороны, по закону Гука τ Gõ/h. Здесь G - модуль сдвига, b и h - параметры решетки. Поскольку сдвиговые деформации начинаются при x b (например, в алюминии при
õ/b 0,002), то sin 2π x/b 2π x/b.
Тогда, K 2π x / Gx/h, следовательно, K Gb/2 b, а сдвиговое напряжение
τ |
Gb |
sin |
2π x |
(2.5). |
|
2π h |
b |
||||
|
|
|
Максимального значения сила сопротивления достигает при сдвиге, равном b/4 (см. рис. 2.1, б), поэтому
τmax |
|
Gb |
|
2π |
|
b |
. (2.6) |
|
2π h |
b |
4 |
||||||
|
|
|
|
|
19
Считая h b, получаем, что теоретическое значение сопротивления сдвигу max G/4. Это весьма большая ве-
личина. В частности, для стали G 80 ГПа, следовательно,max 20 ГПа. В действительности сопротивление сдвигу
конструкционной стали, по крайней мере, на два порядка ниже.
Причиной столь большого расхождения между значениями теоретической и истинной прочности являются дефекты кристаллической решетки. Из-за дефектов сдвиг про-
исходит не одновременно по всей атомной плоскости, а скольжение начинается на одном или нескольких участках, а затем распространяется по всей плоскости с конечной скоростью, как, например, при разрыве бумаги, ткани. Наименьшее сопротивление сдвигу наблюдается при скольжении вдоль наиболее плотно заселенных атомами плоскостей.
2.2. Дефекты кристаллов и механические свойства кристаллов.
Дефекты кристаллов делятся на нульмерные (точечные), одномерные и двумерные. К точечным относятся энергетические, электронные и атомные. Наиболее распро-
странены энергетические дефекты - фононы - кванты волн рас- тяжения-сжатия и сдвига (звуковые волны). Тепло в кристаллах распространяется также в виде механических волн со звуковой скоростью. В квантовой механике распространение звуковых волн, как и электромагнитных, рассматривается как движение частиц - фононов. Энергия фонона, как и фотона, по формуле Планка равна h .
К электронным дефектам относятся избыточные электроны, дырки, экситоны. Последние представляют собой пару электрон-дырка, связанную кулоновскими силами.
Атомные дефекты включают вакансии, атомы в межузлах и чужеродные атомы (рис. 2.2, а). Точечные дефекты иг-
рают важную роль в электрических и оптических свойствах кристаллов.
Одномерные дефекты – дислокации играют огромную роль в поведении кристаллов при деформации. Про-
20
стейшая линейная дислокация представляет собой отсутствующий ряд атомов (рис. 2.2, б).
Рис.2.2. Дефекты решетки.
Более сложной является винтовая дислокация (рис. 2.2, в), которая возникает в результате поворота одной части кри-
сталла относительно другой. Пластическая деформация кри-
сталлов наблюдается при сдвиговых напряжениях, во много раз меньших, чем теоретические. Деформация происходит в результате движения дислокаций, которое начинается при сравнительно небольшой относительной деформации - порядка 10-4 - 10-3мм. Когда дислокация проходит через весь кристалл, одна часть его смещается относительно другой на величину межатомного расстояния. При этом плотность дислокаций велика (составляет в начале сдвига ~ 106 - 108 см-3), и сдвиг приводит к однородному скольжению множества блоков кристалла относительно друг друга с выходом дислокаций и образованием ступенек на границах тела. По-
движность дислокаций, а, следовательно, скорость пластической деформации экспоненциально повышаются с ростом температуры.
