
Оптическое материаловедение и
.pdf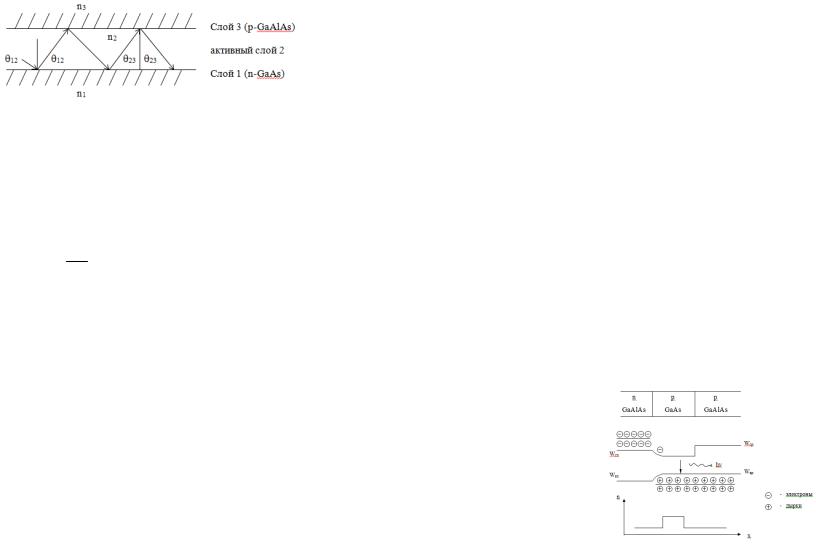
301
слой с показателем преломления n2 расположен между двумя неактивными областями с показателями преломления n1 и n3.
Рис. 6.2. Распределение луча в трехслойной структуре
Если показатели преломления слоев удовлетворяют условию
n2 > n1 ≥ n3 ,
то угол падения луча Θ12 на границу раздела между слоями 1 и 2 (рис. 6.2) будет больше критического угла Θкр, определяемого уравнением (6.2).
Θкр=arc sin n2
n1
Аналогичная ситуация наблюдается на границе раздела слоев 2 и 3. Таким образом, если показатель преломления активной области больше показателя преломления окружающих ее слоев (неравенство 6.1), то электромагнитное излучение распространяется в направлении, параллельном границам раздела слоев. В результате волноводный эффект препятствует проникновению излучения в смежные с активной областью неактивные части полупроводника, т.е. способствует уменьшению оптических потерь. Четко выраженное ограничение излучения достигается при изменении показателей преломления на переходе до 10%. Этого можно достичь только на гетеропереходе. В лазерах с гомоструктурой разность между показателем преломления активного слоя и показателями преломления соседних слоев достигает лишь 0,1-1%. Поэтому в лазере с односторонней гетероструктурой четко выраженное ограничение излу-чения достигается лишь на границе гетероперехода (между слоями 2 и 3).
Совокупное действие обоих факторов привело к существенному снижению плотности порогового тока накачки от 20
302
.. 100 кА/см2 до 7 ..40 кА/см2 и одновременно к увеличению
дифференциальной квантовой эффективности, |
характеризу- |
||
ющейся тангенсом |
угла |
наклона энергетической харак- |
|
теристики (рис. 5.2) от 15...20 до 35 - 50%. |
|
||
Односторонние гетероструктуры широко используются |
|||
в импульсных инжекционных |
лазерах. Импульсная мощ- |
||
ность излучения лазерных диодов типа ЛПИ и ИЛПИ составляет 1.... 25 Вт при частотах следования импульсов 3...25кГц.
Лазеры на основе двойных гетероструктур
Следующим шагом явилось создание двухсторонней гетероструктуры (ДГС). На рис. 6.3. схематически изображена структура с двумя гетеропереходами, ее зонная диаграмма в условиях прямого смещения, а также профили распределения показателя преломления. В ДГС активная область (часть GaAs р-типа) заключена между широкозонными полупроводниками с обеих сторон, что значительно усилило волноводные свойства такой структуры и привело к дальнейшему уменьшению оптических потерь. Существенному снижению порогового тока в ДГС также способствовало то обстоятельство, что электроны широкозонного эмиттера GaAlAs n-типа поступают в активную область узкозонного полупроводника, теряя свою потенциальную энергию, как бы «сваливаясь с горки». Это явление носит название суперинжекции. В результате пороговая плотность тока снизилась до 1..3 кА/см2, что позволило реализовать непрерывный режим с достаточно большим ресурсом работы.
Рис. 6.3. Структура с двумя гетеропереходами (а), ее зонная диаграмма (б) и профиль распределения показателя преломления (в)
303 |
|
|
|
304 |
Основные типы лазерных диодов |
Как |
видно |
из рисунка, наряду с главным пиком, в ко- |
|
Лазерные диоды являются источником излучения в пе- |
тором сосредоточена основная мощность излучения, существу- |
|||
редающих оптоэлектронных модулях, применяемых в волокон- |
ют побочные максимумы. Причина |
их связана с условиями |
||
но-оптических системах связи. Наибольшее распространение |
образования стоячих волн. |
|
||
получили 4 основных типа лазерных диодов: с резонатором |
Однако для ряда применений требуются одномодовые |
|||
Фабри - Перо; с распределенной обратной связью; с распреде- |
лазеры, отличающиеся улучшенными |
пространственно - вре- |
||
ленным брэгговским отражением; с внешним резонатором. Как |
менными спектральными характеристиками. |
|||
указывалось ранее, резонатор Фабри - Перо образуется торце- |
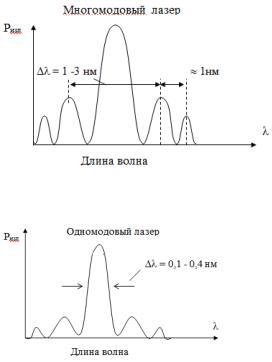
На рис. 6.5 |
показан спектр излучения одномодового ла- |
||
выми поверхностями, окружающими с обеих сторон гетероген- |
зера. Такой спектр имеют три других перечисленных более со- |
|||
ный переход. Одна из поверхностей отражает свет с коэффици- |
вершенных типов лазерных диодов, отличающихся способом |
|||
ентом отражения близким к 100%, другая является полупро- |
организации оптического резонатора, и являющихся в некото- |
|||
зрачной, обеспечивая выход излучения лазера с резонатором |
рой степени модернизацией простого резонатора Фабри-Перо. |
|||
Фабри - Перо. На рис. 6.4 показан спектр излучения лазера с ре- |
Кроме того, одномодовые лазеры отличаются уменьшенной за- |
|||
зонатором Фабри - Пьеро. |
висимостью длины волны лазера от тока инжекции и темпера- |
|||
|
туры, высокой стабильностью одномодовости. Основным недо- |
|||
|
статком одномодовых лазеров является сложная технология из- |
|||
|
готовления и, как следствие, более высокая цена. |
|||
|
Контрольные вопросы |
|
||
|
1. |
Для чего используется гетеропереход? |
||
|
2. |
Объясните структуру лазера на основе односто- |
||
|
ронней гетероструктуры. |
|
||
|
3. |
Что такое волновой эффект? |
||
Рис. 6.4. Спектр излучения лазера с резонатором Фабри- |
4. |
Какова структура двухсторонней гетеростукту- |
||
Перо |
ры? |
|
|
|
|
5. |
Дайте определение суперинжекции. |
||
|
6. |
Каковы основные типы лазерных диодов? |
||
Рис. 6.5. Спектр излучения одномодового лазера
305
Лекция 25 Зонная схема, дефекты структуры
ирадиационные центры окраски
вкристаллах и стеклах
Понятие валентной зоны и зоны проводимости вещества были введены для описания свойств таких материалов, как кристаллы, которые характеризуются высокой степенью пространственной упорядоченности расположения атомов в объеме этого класса веществ. В случае кристаллов, как известно, соблюдается трансляционная симметрия: перемещение ( трансляция) выбранного элементарного структурного фрагмента вдоль ребер элементарной ячейки на расстояния, кратные их длинам, приводит к фрагменту с точно таким же взаимным расположением атомов. Естественно, возникает вопрос о том, можно ли использовать представления о зонной схеме и для описания свойств такого класса оптических материалов, который представлен стеклами, если известно, что они отличаются неупорядоченностью своей структуры и если для них не соблюдается трансляционная симметрия. Какова природа терминов «ловушки носителей зарядов», «центры окраски» в случае кристаллов и стекол, что между ними общего и в чем их отличие друг от друга?
Зонная схема кристаллов. Классификация дефектов их структуры
Энергия электрона в атоме может принимать не любые, а вполне определенные, дискретные значения, говорят, что она квантована, вследствие чего спектры поглощения и испускания энергии атомами являются линейчатыми. При образовании кристалла энергетические уровни атомов превращаются в зоны разрешенных для электронов состояний. Такие зоны отделены друг от друга областями энергий, в которых ни одна электронная атомная орбиталь не является разрешенной.
В литературе области « запрещенных» энергий называются энергетическими щелями или запрещенными зонами (см. рис.
.1). Эти зоны возникают в результате взаимодействия электронов с атомными остовами (ионами). Как это происходит в
306
реальности, проще всего понять на примере образования ще- лочно-галоидных кристаллов из атомов щелочных металлов и галогенов.
При сближении названных типов атомов электроны из s- состояния щелочного металла переносятся на р-орбиталь атома галогена. Этому способствуют два обстоятельства. Вопервых, валентный электрон у атома щелочного элемента располагается на внешней s-орбитали, достаточно удаленной от ядра, вследствие чего сила электростатического притяжения s-электрона к ядру существенно ослаблена по сравнению с таковой для электронов внутренних орбиталей. Такой электрон может быть легко отдан щелочным атомом. Подтверждением этого являются сравнительно низкие значения потенциалов ионизации (единицы эВ) у атомов щелочных элементов. Отдав внешний электрон, атом щелочного металла превращается в положительно заряженный катион со стабильной электронной конфигурацией атома благородного (инертного) газа, стоящего перед ним в таблице Д. И. Менделеева. Вовторых, максимально возможное число электронов на р- орбитали любого атома, характеризуемое максимальной стабильностью электронной конфигурации, равно 6, а у атомов галогена их по 5. По этой причине у них имеется по одной вакансии на p-орбитали, при заполнении которой электроном, отданным атомом щелочного металла, атом галогена превращается в отрицательно заряженный ион и также приобретает очень устойчивую электронную конфигурацию следующего за ним атома благородного газа. Два полученных стабильных иона притягиваются друг к другу силой электростатического притяжения. В случае, например, образования кристалла NaCl имеет место перенос 3 s-электрона Na (электронная конфигу-
рация − 1 s22s22p23s1) на 3 p-орбиталь Cl (1s22s22p23s23р5) с об-
разованием ионов Na+ (1s22s22p2 – конфигурация Ne) и Cl-
(1s22s22p23s23р6 − конфигурация Ar).

307
Рис. 2.1. Зонная схема кристалла.
Энергетические зоны в кристаллах не являются только математической абстракцией, они существуют и в действительности. Из-за наличия запрещенной зоны кристаллы прозрачны в определенных спектральных (энергетических) диапазонах. Табл. 2.1 дает представление о ширине запрещенной зоны ( Eg) для основных щелочно-галоидных кристаллов. Данные, представленные в этой таблице, получены с использованием разных методик, которые дают отличающиеся друг от друга результаты, поэтому в таблице указаны диапазоны значений Eg, а не конкретные точные данные.
Таблица 2.1. Ширина запрещенной зоны щелочно-галоидных кристаллов.
308
Как следует из представленной таблицы, щелочногалоидные кристаллы отличаются достаточно большой шириной запрещенной зоны, чем и объясняется их бесцветность (на энергетической шкале видимый диапазон оптического спектра находится в пределах от 1.77 до 3.10 эВ или от 400 до 700 нм).
Наличие запрещенной зоны является следствием упорядоченности структуры кристалла: электронные волны отражаются от плоскостей спайности кристалла (брэгговское отражение) и интерферируют друг с другом только при определенных значениях волнового вектора. Электростатическое поле, в котором в кристалле движется электронная волна, в силу упорядоченности расположения атомов является периодическим. Решением уравнения Шредингера для электрона при его движении в периодическом поле является так называемая функция Блоха
Ψk(r) = exp(-ikr)*Uk(r). |
( 2 . 1 ) |
В выражении 2.1 жирный шрифт указывает на векторную природу величин – волнового вектора k и радиус-вектора r точки, в которой находится электрон. Первый сомножитель в этом произведении есть уравнение плоской волны, а второй отражает периодичность потенциального поля решетки. Решения уравнения Шредингера такого вида состоят из стоящих волн. Из таких решений можно составить волновой пакет, который будет представлять электрон, свободно распространяющийся в периодическом потенциальном поле, созданном атомными остовами.
Идеальный кристалл характеризуется строгим соблюдением трансляционной симметрии: как отмечалось, весь кристалл может быть построен путем трансляции элементарной ячейки в трех направлениях. Последнее означает, что физические свойства кристалла в некоторой точке пространства r точно воспроизводятся в любой другой точке, координаты кото-
рой удовлетворяют условию: |
|
r + l = r + l1 a1 + l2 a2 + l3 a3, |
( 2 . 2 ) |
где a1, a2 и a3 – три некомпланарных (т. е. несводимых друг к другу вектора), а l1, l2 и l3 – целые числа. В реальности, од-

309
нако, структура кристаллов отличается от идеальной, представленной схематически на рис. 2.2. Как видно из этого рисунка, катионы и анионы изображены кружками разного размера, это никакая не ошибка, а, как правило, отражение реального соотношения размеров ионов щелочных элементов и галогенов.
В самом деле, ионные радиусы (в Ангстремах) у них равны 0.78 (Li+), 0.98 (Na+), 1.33 (K+), 1.47 (Rb+), 1.65 (Cs+), 1.36 (F-), 1.81 (Cl-), 1.96 (Br-), 2.20 (I-). Любое отклонение от периодической структуры кристалла называется точечным дефектом. К обычным точечным дефектам относятся:
-химически инородные примеси;
-вакансии (т. е. узлы кристаллической решетки, в которых нет атомов);
-атомы внедрения.
Дефекты существенно влияют на функциональные свойства кристалла, вызывая появление окраски, люминесценции, изменение оптических и механических свойств, поэтому познакомимся с основными их типами.
Рис. 2.2. Схема расположения ионов в идеальном кристалле (малые кружки – щелочные катионы, большие кружки – анионы галогена).
Простейший тип дефекта – вакансия. Различают вакансии по Шоттки, их 3 типа (рис. 2.3): 1) положительная вакансия; 2) связанная пара вакансий противоположного знака; 3) анионная вакансия.
310
Рис. 2.3. Типы точечных дефектов по Шоттки.
Вакансия по Шоттки создается при переносе атома из объема кристалла в узел на его поверхности. В кристаллах с плотной упаковкой при температурах, близких к температуре плавления, доля свободных узлов кристаллической решетки достигает 10-3 – 10-4 (0.1 – 0.01) %)]. В ионных кристаллах числа вакансий разного знака одинаковы, что обеспечивает макроскопическую электронейтральность кристалла.
Другим типом точечных дефектов является дефект по Френкелю – атом, смещенный в междоузлие (отмечено стрелками на рис. 2.4). Дефекты по Шоттки в щелочно-галоидных кристаллах более распространены, их образование понижает плотность кристалла, тогда как создание дефектов по Френкелю оставляет плотность кристалла неизменной, но структура кристалла в окрестностях дефектов сильно деформируется (рис. 2.4).
Рис. 2.4. Типы точечных дефектов кристалла по Френкелю. Если в щелочно-галоидном кристалле (например, в KCl) какойлибо узел занимает инородный катион ( например, Са2+

311
вместо К+), то электронейтральность кристалла обеспечивается образованием катионной вакансии по соседству с ионом Са2+. В самом деле, отсутствие катиона К+ в узле решетки означает наличие нескомпенсированного отрицательного заряда, который как раз и нейтрализует один дополнительный положительный заряд, привнесенный в кристалл KCl ионом Са2+.
Образование такой катионной вакансии в кристалле KCl при введении в него добавки CaCl2 подтверждается понижением плотности кристалла по сравнению с плотностью чистого KCl. Если бы катионная вакансия не образовывалась, то плотность должна была бы возрасти, так как кальций имеет более высокую атомную массу, чем калий.
Центры окраски в щелочно-галоидных кристаллах Окраска представляет собой суперпозицию световых волн, которые не поглотились минералом при прохождении
света через минерал или отражении от его поверхности
Как уже отмечалось, номинально чистые щелочногалоидные кристаллы бесцветны. Появление у них окраски может быть вызвано:
-химическими примесями или добавками;
-избыточным количеством ионов металла по сравнению со стехиометрическим (т. е. отвечающим химической формуле кристалла) составом (можно, например, нагреть кристалл в парах щелочного металла и затем быстро охладить его: нагрев NaCl в парах Na делает кристалл желтым, KCl в парах К – красным);
-облучением кристалла ионизирующим излучением;
-электролизом кристалла.
Центром окраски называется дефект кристаллической решетки, который поглощает видимый свет. Появление окраски у кристалла означает, что в его запрещенной зоне появляются энергетические уровни, переходы электронов между которыми при облучении кристалла светом вызы-
вают его поглощение. Известно, что появление вакансий анионов не приводит к окрашиванию щелочно-галоидных кристаллов, тогда как вакансии катионов вызывают их окраску.
312
Простейшими центрами окраски в кристаллах являются F - центры (от немецкого слова Farbe, означающего цвет, окраску). F - центры могут образовываться либо при нагревании кристалла в парах щелочного металла, либо в результате облучения. В спектре поглощения кристалла при этом обнаруживаются достаточно широкие полосы поглощения в видимой области спектра (табл. 2.2).
Как следует из этой таблицы, полосы поглощения у таких кристаллов, как LiF и NaF, полностью или частично находятся вне видимой области спектра, тем не менее и к ним отнесено понятие F - центров, которое изначально было введено только для характеристики видимой окраски кристаллов. В дальнейшем мы будем понимать под центрами окраски дефекты кристаллической решетки, которые приводят к появлению дополнительной окраски во всей области прозрачности бездефектного кристалла, а не только в видимой части оптического диапазона электромагнитного излучения.
Таблица 2.2. Положение максимумов полос поглощения (Emax) F-центров в щелочно-галоидных кристаллах.
С помощью метода электронного парамагнитного резонанса (ЭПР) было установлено, что F-центр представляет собой образование, состоящее из анионной вакансии, захватившей и удерживающей электрон (рис. 2.5). Модель эта была предложена де Буром. В пользу такой модели свидетельствует тот факт, что плотность окрашенных кристаллов ниже, чем таковая неокрашенных. При возникновении анионной вакансии (например, при прогреве кристалла в парах щелочного металла или при облучении) появляется вероятность захвата ею электрона, поскольку анионная вакансия в идеальном кристалле

313
ведет себя как изолированный положительный заряд, который как раз и притягивает электрон.
Рис. 2.5. Модель F-центра в кристалле по де Буру.
Кроме F-центров, в щелочно-галоидных кристаллах могут образовываться и другие типы электронных центров окраски ( слово «электронный» в названии центра окраски означает, что дефектом структуры кристалла захвачен электрон). Так, если часть катионов в кристалле замещается катионами другого щелочного металла, возникают центры окраски с двумя полосами поглощения – FA - центры. Два соседних F- центра образуют М - центр, три F-центра – R-центр.
Помимо электронных, существуют, однако, и «дырочные» центры окраски, которые образуются при захвате дырок дефектами структуры кристалла. К наиболее известным дырочным центрам окраски относятся Vk - центры (один такой центр обозначен на рис. 2.6 прямоугольником). Vg - центр в хлоридном кристалле – это молекулярный ион (Cl2)-, расстояние между ядрами галоида в котором на (30 – 40) % меньше, чем расстояние между обычными соседними атомами галоида в бездефектном кристалле. Возникает Vk - центр при ионизации иона Cl- под действием ионизирующего излучения или света, вызывающего электронные переходы «зона – зона», т. е. света с энергией квантов, превышающей ширину запрещенной зоны кристалла:
Cl- + hν = (Cl-)* = Cl0 + e-. |
(2 . 3) |
314
Рис. 2.6. Vk - центр в щелочно-галоидном кристалле.
Возникающий нейтральный атом Cl0 неустойчив и в процессе релаксации (перестройки решетки) образует с соседним ионом Cl- молекулярный ион (Cl2)-, который оказывается
достаточно устойчивым:
C l0 + Cl- = (Cl2)- ≡ Vk - центр. (2 . 4)
Таблица 2.3 дает представление о полосах поглощения Vk -центров. Могут возникать гетероядерные Vk - центры смешанного состава типа XY- (например, BrCl-), где X – основной галоген, Y – примесный или намеренно введенный галоген другой природы. Vk - центр, локализованный рядом с катионной вакансией, называется VF - центром, Vk - центр, у которого один из соседних катионов замещен более легким, − VKA - центром.
Таблица 2.3. Положение максимумов полос поглощения (Emax) Vk - центров в щелочно- и щелочноземельно-галоидных кристаллах.
315
Лекция 26 Окраска природных цветных сапфиров
Значительную часть среди драгоценных камней зани-
мают ювелирные разновидности корунда (рубин, сапфир, цвет-
ные сапфиры).
Окраска является самой визуально заметной характеристикой драгоценных камней и во многом предопределяет их стоимость. Наиболее ценными разновидностями прозрачного корунда являются рубин (красный), сапфир (синий) и сапфир падпараджа (розово-оранжевый). Остальные цветные разновидности корунда (цветные сапфиры) по стоимости уступают вышеуказанным. По интенсивности окраски наиболее дорогими считаются яркие насыщенные камни. Стоимость камня снижается также из-за неравномерности окраски. Несмотря на наличие некоторых объективных критериев, оценка ювелирных корундов и качества их оттенка представляет собой сложную проблему и по большей части очень субъективна. В противоположность алмазу эти камни ценятся не столько за чистоту, сколько за цвет: оригинальный оттенок в сочетании с небольшим дефектом предпочтительнее, чем цвет более заурядный.
Корунд α-Al2O3 кристаллизуется в тригональной сингонии. Кристаллическая структура корунда представляет собой плотнейшую гексагональную упаковку из анионов О2-, в которой две трети октаэдрических пустот заняты ионами алюминия Al3+. Окраска корундов обусловливается, главным образом, ионами Al3+ , которые замещаются 3d – ионами (ионами элементов, таких как Sc, Ti, V, Mn, Fe, Ni, Cu, Zn, которые имеют неспаренные электроны на внешних орбиталях) во время кристаллизационного процесса. Это возможно потому, что размер ионов 3d – переходного элемента близок к размеру ионов Al3+ . Имеющиеся данные по параметрам кристаллического поля 3d – переходных элементов, замещающих ионы Al3+ в структуре корунда (Al2О3) предполагают, что несколько первых возбужденных состояний всех элементов лежат в видимой области. Все 3d – элементы, если они присутствуют в корунде, будут участвовать в механизмах окраски. Механизмы могут вызывать поло-
316
сы поглощения от слабых до сильных, электронные переходы в которых приводят к целому ряду окрасок сапфира в пределах от фиолетовой до красной.
Окраска представляет собой суперпозицию световых волн, которые не поглотились минералом при прохождении света через минерал или отражении от его поверхности, по-
этому ответственными за окраску являются те или иные оптически активные центры в минерале, которые избирательно поглощают свет тех или иных длин волн. В корунде такими центрами и являются переходные d-элементы, присутствующие в минерале как изоморфная примесь. Эти элементы часто называют хромофорными. Хромофорные ионы могут быть как изолированными, так и объединенными и занимать различные структурные позиции относительно друг друга. Хромофорный эффект от вхождения ионов переходных элементов сильно зависит от структурной составляющей. Так, ионы-примеси могут занимать либо отдельные друг от друга октаэдрические позиции в решетке, либо располагаться в соседних октаэдрах. В этом случае между ионами переходных металлов могут возникать интенсивные электронные обменные взаимодействия, сопровождаемые формированием дополнительных уровней энергии у этих ионов и появлением в спектрах дополнительных полос поглощения. В минералогической литературе эти полосы называют по-разному: полосы поглощения переноса заряда металл металл или полосы поглощения обменно-связанных пар. Эти полосы в десятки-сотни раз интенсивнее полос поглощения спинразрешенных d-d -полос поглощения, так как они отвечают d-d- переходам со значительной примесью электронных состояний. Нередки случаи, когда изолированные примеси сами по себе не дают существенного вклада в общую окраску минерала, тогда как при одновременном их нахождении в соседних положения решетки вызывают видимые изменения в окраске минерала.
Основные примеси, образующие центры окраски в исследуемых цветных сапфирах, это примеси хрома(III), железа(II и III) и титана (IV). Примеси хрома(III) и железа(II и III) находятся в виде ионов, а примесь титана (IV) может быть как в виде ионов, так и в виде твердой фазы (вростки рутила TiO2). В зави-
317
симости от концентраций и количественных соотношений хромофорных примесей окраска корундов будет обладать различной интенсивностью. Влияние на окраску цветных сапфиров основных хромофорных центров представлено в табл. 1.
|
|
|
|
|
|
Таблица 1. |
||
Хромофорные примеси, центры окраски с их участием |
|
|
||||||
|
|
и окраска, вызываемая ими |
|
|
|
|
|
|
Назва- |
Окраска |
Центры окраски |
Особенности |
|
||||
Изолирован- |
Неизолиро- |
|
||||||
ние |
|
ные |
ванные |
|
|
|
|
|
|
|
|
|
|
|
|
||
Cr |
красный |
Cr3+ |
возможны |
В |
видимой |
|
||
(III) |
|
|
Cr3+ - Cr3+ |
области |
оп- |
|
||
|
|
|
|
тического |
|
|||
|
|
|
|
спектра |
|
про- |
|
|
|
|
|
|
являются |
две |
|
||
|
|
|
|
интенсивные |
|
|||
|
|
|
|
широкие |
по- |
|
||
|
|
|
|
лосы |
погло- |
|
||
|
|
|
|
щения, |
|
обу- |
|
|
|
|
|
|
словленные |
|
|||
|
|
|
|
разрешенны- |
|
|||
|
|
|
|
ми |
по |
спину |
|
|
|
|
|
|
электронны- |
|
|||
|
|
|
|
ми |
перехода- |
|
||
|
|
|
|
ми |
в |
ионах |
|
|
|
|
|
|
Сr3+ |
|
|
|
|
Fe |
желтый |
Fe3+ |
Fe3+ - Fe3+ |
Желтая |
|
|
|
|
(III) |
|
|
|
окраска таких |
|
|||
|
|
|
|
корундов |
|
|
||
|
|
|
|
обусловлена |
|
|||
|
|
|
|
совместным |
|
|||
|
|
|
|
влиянием |
ин- |
|
||
|
|
|
|
тенсивного |
|
|||
|
|
|
|
коротковол- |
|
|||
|
|
|
|
нового |
|
края |
|
|
|
|
|
|
поглощения, |
|
|||
318
Назва- |
Окраска |
Центры окраски |
Особенности |
|||||
Изолирован- |
Неизолиро- |
|||||||
ние |
|
ные |
ванные |
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
связанного |
с |
|||
|
|
|
|
полосой |
|
пе- |
||
|
|
|
|
реноса заряда |
||||
|
|
|
|
и |
полосами |
|||
|
|
|
|
поглощения в |
||||
|
|
|
|
видимой |
|
об- |
||
|
|
|
|
ласти |
|
спек- |
||
|
|
|
|
тра, |
|
|
боль- |
|
|
|
|
|
шинство |
|
из |
||
|
|
|
|
которых |
обу- |
|||
|
|
|
|
словлены |
d-d |
|||
|
|
|
|
- переходами |
||||
|
|
|
|
в ионах Fe3+ . |
||||
|
|
|
|
Полосы |
|
|
по- |
|
|
|
|
|
глощения Fe3+ |
||||
|
|
|
|
- Fe3+ прояв- |
||||
|
|
|
|
ляются в том |
||||
|
|
|
|
же |
|
|
спек- |
|
|
|
|
|
тральном |
|
|||
|
|
|
|
диапазоне, |
|
|||
|
|
|
|
что |
и |
изоли- |
||
|
|
|
|
рованных |
|
|||
|
|
|
|
ионов Fe3+, но |
||||
|
|
|
|
имеют |
|
при |
||
|
|
|
|
этом |
гораздо |
|||
|
|
|
|
большую ин- |
||||
|
|
|
|
тенсивность и |
||||
|
|
|
|
четко |
выра- |
|||
|
|
|
|
женную |
|
|
||
|
|
|
|
структуру, |
|
|||
|
|
|
|
обусловлен- |
||||
|
|
|
|
ную |
расщеп- |
|||
|
|
|
|
лением |
|
уров- |
||
|
|
|
|
ней |
за |
|
счет |
|

|
|
|
|
|
|
319 |
|
|
|
|
|
|
|
|
|
Назва- |
Окраска |
Центры окраски |
Особенности |
||||
Изолирован- |
Неизолиро- |
||||||
ние |
|
ные |
ванные |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
обменного |
|
||
|
|
|
|
взаимодей- |
|||
|
|
|
|
ствия. |
|
|
|
|
|
|
|
|
|
||
Fe(II) |
зеленова- |
Fe2+ |
Fe2+ - Fe3+ |
Полосы |
по- |
||
|
тые и го- |
|
|
глощения, |
|
||
|
лубоватые |
|
|
связанные |
с |
||
|
тона |
|
|
Fe2+ и Fe2+ - |
|||
|
|
|
|
Fe3+ лежат вне |
|||
|
|
|
|
видимого |
|
||
|
|
|
|
диапазона |
|
||
|
|
|
|
оптического |
|||
|
|
|
|
излучения |
и |
||
|
|
|
|
слабо влияют |
|||
|
|
|
|
на окраску |
|
||
Fe(II) |
синий |
Fe2+ и Ti4+ |
Fe2+ - Ti4+ |
Если |
сапфир |
||
и |
|
|
|
содержит |
|
||
Ti(IV) |
|
|
|
только |
малое |
||
|
|
|
|
количество |
|||
|
|
|
|
ионов |
Fe2+ |
||
|
|
|
|
или |
|
только |
|
|
|
|
|
Ti4+, то он |
|||
|
|
|
|
может |
оста- |
||
|
|
|
|
ваться |
бес- |
||
|
|
|
|
цветным. |
|
||
|
|
|
|
Однако, когда |
|||
|
|
|
|
и Fe2+ и Ti4+ |
|||
|
|
|
|
присутствуют |
|||
|
|
|
|
одновремен- |
|||
|
|
|
|
но и в сосед- |
|||
|
|
|
|
них |
положе- |
||
|
|
|
|
ниях |
решет- |
||
|
|
|
|
ки, |
получает- |
||
|
|
|
|
ся |
интенсив- |
||
|
|
|
|
|
|
320 |
|
|
|
|
|
|
|
Назва- |
|
Центры окраски |
|
|
||
Окраска |
Изолирован- |
Неизолиро- |
Особенности |
|||
ние |
|
ные |
ванные |
|
|
|
|
|
|
|
|||
|
|
|
|
ный |
синий |
|
|
|
|
|
цвет. |
|
Этот |
|
|
|
|
тип поглоще- |
||
|
|
|
|
ния |
вызыва- |
|
|
|
|
|
ется |
интерва- |
|
|
|
|
|
лентным |
пе- |
|
|
|
|
|
реносом |
за- |
|
|
|
|
|
ряда |
Fe2+ - |
|
|
|
|
|
Ti4+. |
Ионы |
|
|
|
|
|
титана связа- |
||
|
|
|
|
ны в |
пары с |
|
|
|
|
|
ионами желе- |
||
|
|
|
|
за, |
образуя |
|
|
|
|
|
«бичастицы» |
||
|
|
|
|
(Fe, Ti)6+. По- |
||
|
|
|
|
лоса |
погло- |
|
|
|
|
|
щения в |
ви- |
|
|
|
|
|
димом диапа- |
||
|
|
|
|
зоне |
спектра |
|
|
|
|
|
обусловлена |
||
|
|
|
|
переносом |
||
заряда Fe2+
Ti4+ .
Кроме выше приведенных хромофорных примесей за оттенки в окраске сапфиров ответственны также некоторые количества примесей V, Ni, Mn, Mg и других элементов. Поскольку в исследуемых цветных сапфирах эти примеси не являются первостепенными, подробное их рассмотрение не проводится.
