
Содержание
Введение_____________________________________________________3
-
Структура атомного ядра_______________________________________3
-
Протон______________________________________________________4
-
Нейтрон_____________________________________________________4
-
Характеристика атомного ядра __________________________________5
-
Спин ядра____________________________________________________7
-
Масса и энергия связи ядра_____________________________________7
-
Природа ядерных сил__________________________________________9
Заключение__________________________________________________15
Источники___________________________________________________16
Введение
В начале XX в. Благодаря опытам Резерфорда возникло представление о том, что в центре атома находится крохотное по своим размерам, но массивное ядро. Но созданию этой модели предшествовали попытки построить модель атома на основе представлений классической электродинамики и механики. В 1904 году появились публикации о строении атома, одни из которых принадлежали японскому физику Хантаро Нагаока, другие - английскому физику Д.Д. Томсону.
Нагаока представил строение атома аналогичным строению солнечной системы: роль Солнца играет положительно заряженная центральная часть атома, вокруг которой по установленным кольцеобразным орбитам движутся «планеты» - электроны. При незначительных смещениях электроны возбуждают электромагнитные волны.
В атоме Томсона положительное электричество «распределено» по сфере, в которую вкраплены электроны. В простейшем атоме водорода электрон находится в центре положительно заряженной сферы. В многоэлектронных атомах электроны располагаются по устойчивым конфигурациям, рассчитанным Томсоном. Томсон считал каждую такую конфигурацию определяющей химические свойства атомов. Он предпринял попытку теоретически объяснить периодическую систему элементов Д.И. Менделеева. Позднее Бор указал, что со времени этой попытки идея о разделении электронов в атоме на группы сделалась исходным пунктом.
Но вскоре оказалось, что новые опытные факты опровергают модель Томсона и, наоборот, свидетельствуют в пользу планетарной модели атома Резерфорда.
-
Состав и характеристика атомного ядра
У физиков начала XX в. Существовала важная проблема: обладает ли атомное ядро структурой и какой эта структура могла бы быть? Оказалось, что ядро достаточно сложно. Тем не менее в начале 30-х годов была разработана модель атомного ядра, которая по-прежнему находит широкое применение. Согласно этой модели, ядро состоит из частиц двух типов — протонов и нейтронов. (Не следует забывать о том, что эти «частицы» обладают волновыми свойствами, но для большей наглядности мы будем говорить о протонах и нейтронах просто как о частицах.) Эти частицы носят название нуклонов.
Протон.
Протон (р) есть не что иное, как ядро атома водорода. Он обладает зарядом +е и массой
mр = 938,7Мэв1. (1.1)
Для сравнения укажем, что масса электрона, выраженная в единицах энергии, составляет
me= 0,511Мэв. (1.2)
Из сопоставления (1.1) и (1.2) следует, чтотр = = 1836 т.е.
Протон имеет спин, равный половине(s= 1/2), и собственный магнитный момент
μp=+2,79μ0
где
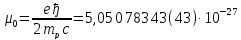 Дж/Тл
(1.3)
Дж/Тл
(1.3)
—единица
магнитного момента, называемая ядерным
магнетоном.
Из сравнения с Дж/Тл
вытекает,
что
Дж/Тл
вытекает,
что
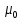 в1836
раз меньше магнетона Бора
в1836
раз меньше магнетона Бора
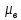 .
Следовательно, собственный магнитный
момент протона примерно в 660 раз меньше,
чем магнитный момент электрона.
.
Следовательно, собственный магнитный
момент протона примерно в 660 раз меньше,
чем магнитный момент электрона.
Нейтрон.
Нейтроном (n) называется не обладающая электрическим зарядом частица 2 с массой
тп = 939,5Мэв, (1.4)
очень близкой к массе протона. Разность масс нейтрона и протона
тп —тр составляет 1,3Мэв, т. Е. 2,5 те.
Нейтрон обладает спином, равным половине (s = 1/2), и (несмотря на отсутствие электрического заряда) собственным магнитным моментом
μn=-1,91 μ0
(знак минус указывает на то, что направления собственных механического и магнитного моментов противоположны) .
В свободном состоянии нейтрон нестабилен (радиоактивен)— он самопроизвольно распадается, превращаясь в протон и испуская электрон (е-) и еще одну частицу, называемую антинейтрино3(ῦ). Период полураспада равен ~ 12мин. Схему распада можно записать следующим образом:
n→р + е-+ ῦ. (1.5)
Масса покоя антинейтрино равна нулю. Масса нейтрона, как мы видели, больше массы протона на 2,5 те. Следовательно, масса нейтрона превышает суммарную массу частиц, фигурирующих в правой части уравнения (5), на 1,5 те, т. Е. на 0,77Мэв. Эта энергия выделяется при распаде нейтрона в виде кинетической энергии образующихся частиц.
Характеристика атомного ядра.
Ядро атома водорода состоит из одного протона, тогда как ядра атомов других химических элементов содержат и нейтроны, и протоны. Различные типы ядер часто называютнуклидами.Количество протоновZ,входящих в состав ядра(в состав нуклида), определяет его заряд, который равен +Ze.Число Zназывается атомным номером (оно определяет порядковый номер химического элемента в периодической таблице Менделеева) или зарядовым числом ядра. Суммарное число нуклонов, т.е. нейтронов и протонов, обозначается буквой А и называетсямассовым числом. Такое название это число получило потому, что произведение А на массу отдельного нуклона очень близко к массе ядра. У нуклида с 7 протонами и 8 нейтронами Z= 7 и А = 15. Число нейтронов в ядре N = = А—Z.
Для обозначения ядер применяется символZXA, где под X подразумевается химический символ данного элемента. Слева вверху ставится массовое число, слева внизу—атомный номер (Z часто опускают).
Большинство химических элементов имеет по нескольку разновидностей — изотопов, отличающихся значениями массового числа А. Так, например, водород имеет три изотопа:
1H1— обычный водород, или протий (Z= 1, N = 0),
1H2— тяжелый водород, или дейтерий (Z= 1, N=1),
1H3– тритий (Z=l, N = 2)4.
У кислорода имеется три стабильных изотопа:8O16, 8O17 , 8O18 , у олова — десять, и т. Д.
Изотопы представляют собой ядра с одинаковым числом протоновZ.Ядра с одинаковым массовым числом Аназываются изобарами. В качестве примера можно привести 18Ar40и. 20Са40. Ядра с одинаковым числом нейтронов N = А — Zносят название изотонов(6C13,7N14). Наконец, существуют радиоактивные ядра с одинаковымиZи А, отличающиеся периодом полураспада. Они называются изомерами. Например, имеется два изомера ядра35Вr80, у одного из них период полураспада равен 18мин, у другого — 4,4 часа.
Радиус ядра довольно точно определяется формулой:
r= 1,3 • 10-13A1/3см = 1,ЗA1/3ферми (1.6)
(ферми— название применяемой в ядерной физике единицы длины, равной 10-13см). Из соотношения (1.6) следует, что объем ядра пропорционален числу нуклонов в ядре.
В настоящее время известно около 1500 ядер, различающихся Z, либо А, либо и тем и другим. Около 1/4 этих ядер устойчивы, остальные радиоактивны. Многие ядра были получены искусственным путем с помощью ядерных реакций.
В
природе встречаются элементы сZот
1 до 92, исключая технеций (Тс,Z=
43) и прометий (Pm,
Z
= 61). Плутоний
(Pu,Z—
94) после получения его искусственным
путем был обнаружен в ничтожных
количествах в природном минерале —
смоляной обманке. Остальные трансурановые
(т. Е. заурановые) элементы (сZот
93 до 104) были получены только искусственным
путем посредством различных ядерных
реакций.
Трансурановые элементы кюрий (96 Cm), эйнштейний (99 Es), фермий (100 Fm) и менделевий (101 Md) получили названия в честь выдающихся ученых П. иМ. Кюри, А. Эйнштейна, Э. Ферми и Д. И. Менделеева. Лоуреисий (103 Lw) назван в честь изобретателяА- лотрона-Э. Лоуренса.
Элемент 104 был получен в 1964 г. В СССР вЛаборатории ядерных реакций Объединенногоинститутаядерных исследований в Дубне Г. Н. Флеровыми егосотрудниками путем бомбардировки плутониевоймишени (Z = 94) пучком ионов 10Ne22 (Z= 10), ускоренных до энергии 115Мэв. Свое название «курчатовий»104-йэлемент получил в честь выдающегося советскогофизика И. В. Курчатова.
Рис. 1
Для устойчивых ядер характерно определенноеотношение числа нейтронов N к числу протоновZ.У легкихядер это отношение близко к единице. Помереувеличения числа нуклонов в ядреN/Zрастет, достигаядля урана значения 1,6 (см. рис. 1, на которомпо осиабсцисс отложено массовое число А, по оси ординат — отношение N к Z;точки на рисунке соответствуют отдельным стабильным ядрам).
Спин ядра.
Спины нуклонов складываются в результирующий спин ядра. Спин нуклона равен1/2. Поэтому согласно квантовым законам сложения моментов квантовое число спина ядра I будет полуцелым при нечетном числе нуклонов А и целым или нулем при четном А. Спины ядер I не превышают нескольких единиц. Это указывает на то, что спины большинства нуклонов в ядре взаимно компенсируют друг друга, располагаясь антипараллельно. У всех четно-четных 5 ядер (т. Е. ядер с четным числом протонов и четным числом нейтронов) спин равен нулю.
Результирующий момент ядра МI складывается с моментом электронной оболочки МJв полный момент импульса атома MF, который определяется квантовым числомF.
С механическими моментами связаны магнитные моменты. Взаимодействие магнитных моментов электронов и ядра приводит к тому, что состояния атома, соответствующие различным взаимным ориентациям МIи МJ(т. Е. различнымF),имеют немного отличающуюся энергию.Взаимодействием моментов (μLи μSобусловливается тонкая структура спектров. Взаимодействием μIиμJ определяется сверхтонкая структура атомных спектров. Расщепление спектральных линий, соответствующее сверхтонкой структуре, настолько мало (порядка нескольких сотых ангстрема), что может наблюдаться лишь с помощью приборов самой высокой разрешающей силы.
