
- •3. Вычислить стандартную энтальпию реакции при 298к
- •3. Вычислить стандартную энтальпию реакции при 298к
- •3. Вычислить стандартную энтальпию реакции при 298к
- •3. Вычислить стандартную энтальпию реакции при 298к
- •3. Вычислить стандартную энтальпию реакции при 298к
- •3. . Вычислить стандартную энтальпию реакции при 298к
- •3. Вычислить стандартную энтальпию реакции при 298к
- •3. Вычислить стандартную энтальпию реакции при 298к
3. Вычислить стандартную энтальпию реакции при 298к
на основании данных:

4. Гальванический элемент. Электроды сравнения.
5. В каком случае равновесие сместиться влево:
![]()
- при повышении давления.
- при понижении температуры,
- при понижении концентрации NН3
- при повышении температуры
6. Классификация дисперсных систем. Дисперсионная среда (ДС) и дисперсная фаза (ДФ).
Задание 14.
1. Законы Рауля для разбавленных растворов. Отклонения от законов Рауля.
2. Второй и третий закон термодинамики. Понятие энтропия.
3. Вычислить стандартную энтальпию реакции при 298к
2 С2Н5ОН(газ)→С4Н6(газ)+Н2(газ)+2Н2О(газ)
на основании следующих данных:
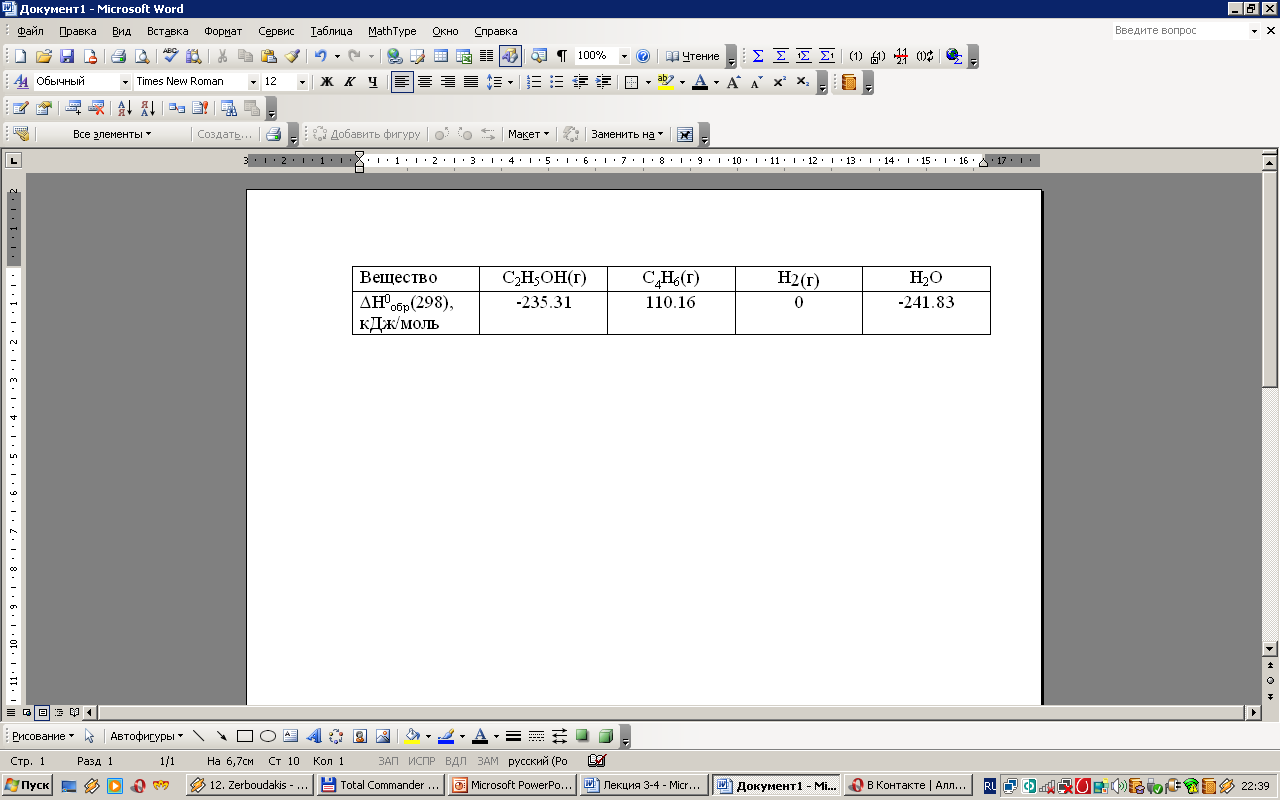
4. Константа скорости химической реакции. Закон действующих масс.
5. В каком случае равновесие сместиться вправо:
![]()
- при повышении давления.
- при понижении температуры,
- при уменьшении концентрации СО2
- при повышении температуры
6. Адгезия и когезия, смачивание и растекание (дать определение).
Задание 15.
1. Энтальпия. Стандартные энтальпии образования и горения.
2. Химическое равновесие. Константа равновесия. Факторы влияющие на состояние равновесия.
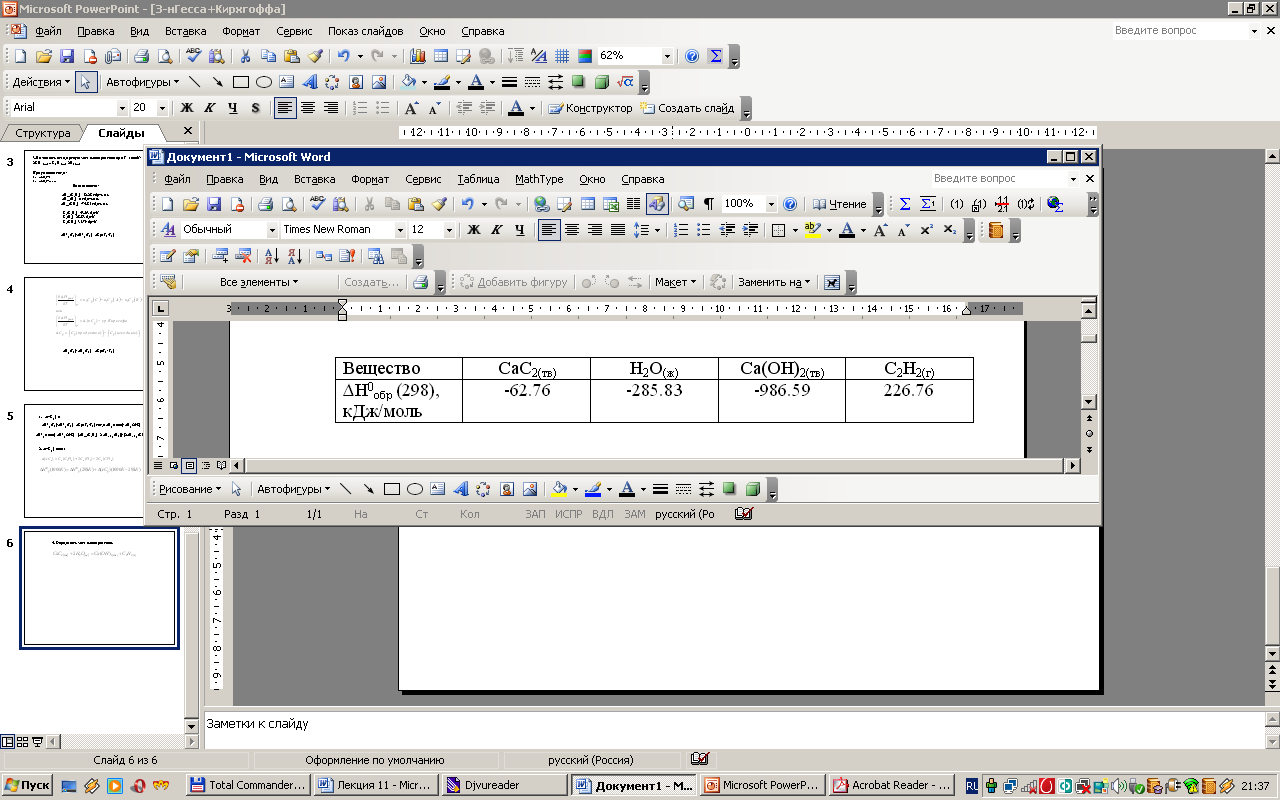
3. Вычислить стандартную энтальпию реакции при 298к
![]()
на основании следующих данных:
4. Агрегатные состояние веществ и их характеристики.
5. Горение аммиака
4 NH3 (г) + 3O2 (г) = 2 N2 (г) + 6 H2O (ж) + Q
является реакцией
1) соединения, каталитической, эндотермической
2) замещения, каталитической, экзотермической
3) окислительно-восстановительной, некаталитической, экзотермической
4) обмена, некаталитической, эндотермической
6. Коллоидные системы: золи и гели. Характеристика и взаимопревращения. Коагуляция и синерезис.
Задание 16.
1. Скорость гомогенной и гетерогенной химической реакции
2. Тепловой эффект химической реакции. Теплоемкость. Зависимость теплового эффекта от температуры.
3. . Вычислить стандартную энтальпию реакции при 298к
![]()
на основании следующих данных:

4. Электрохимическая цепь. Электроды первого и второго рода.
5. В каком случае равновесие сместится влево:
СО2 (г) + С(ТВ) ↔ 2 СО(г) + Q
- при повышении давления.
- при понижении температуры,
- при повышении концентрации СО
- при повышении температуры
6. Седиментация в дисперсных системах.
Задание 17.
1. Реакции нулевого и первого порядка. Кинетические уравнения нулевого, первого и второго порядка.
2. Изобарно-изотермический потенциал. Условия термодинамического равновесия, самопроизвольного и не самопроизвольного протекания процесса.
3. Вычислить стандартную энтальпию реакции при 298к
![]()
на основании следующих данных:

4. В каком случае равновесие сместиться влево:
![]()
- при повышении давления.
- при понижении температуры,
- при повышении концентрации NО
- при повышении температуры
5. Как изменяется скорость химической реакции при повышении температуры и увеличении концентрации реагирующих веществ (аргументируйте ответ, применяя законы и уравнения).
6. Лиофобные и лиофильные коллоидные системы.
Задание 18.
1. Правило фаз Гиббса. Диаграмма состояния воды.
2. Первый и второй закон термодинамики.
