
- •3. Вычислить стандартную энтальпию реакции при 298к
- •3. Вычислить стандартную энтальпию реакции при 298к
- •3. Вычислить стандартную энтальпию реакции при 298к
- •3. Вычислить стандартную энтальпию реакции при 298к
- •3. Вычислить стандартную энтальпию реакции при 298к
- •3. . Вычислить стандартную энтальпию реакции при 298к
- •3. Вычислить стандартную энтальпию реакции при 298к
- •3. Вычислить стандартную энтальпию реакции при 298к
Задание 1.
1. Предмет и основные понятия термодинамики: система, процесс, фаза.
2. Дать определение, что такое термохимия
-
В
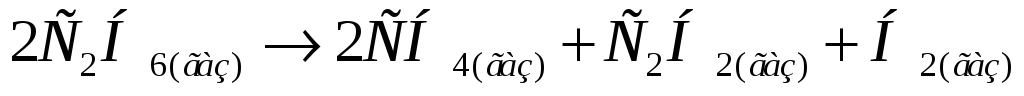 ычислить
стандартную энтальпию реакции при 298К
ычислить
стандартную энтальпию реакции при 298К
на основании следующих данных:
-
Дать определение скорости химической реакции, порядка и молекулярности реакции. Описать способы определения порядка химической реакции.
-
Для увеличения скорости химической реакции
Mg (ТВ) + 2 Н+ → Mg2+ + H2 (г)
Необходимо:
1) добавить несколько кусочков магния;
2) увеличить концентрацию ионов водорода;
3) уменьшить температуру;
4) увеличить концентрацию ионов магния
6. Какие гетерогенные системы называются дисперсными?
Можно ли назвать дисперсной системой молоко, раствор сахара в воде, зубную пасту, сливочное масло, железные опилки в воде, дым
Задание 2.
1. Сформулируйте первый закон термодинамики.
2. Равновесные процессы. Принцип Ле Шателье.
Применить принцип Ле Шателье для решения задачи о смещении
химического равновесия в системе
СО2 (г) + С(ТВ) ↔ 2 СО(г) - Q
В каком случае равновесие сместится вправо:
- при повышении давления.
- при понижении температуры,
- при повышении концентрации СО
- при повышении температуры
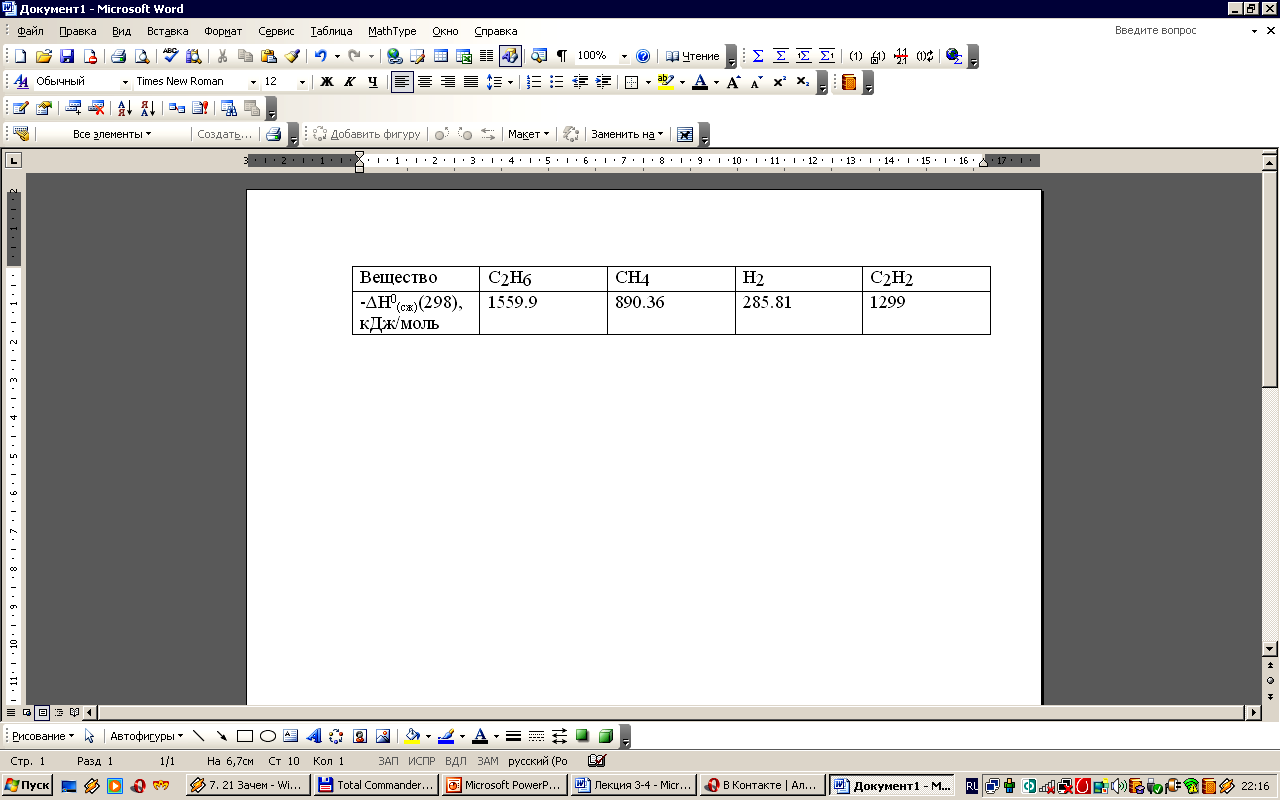
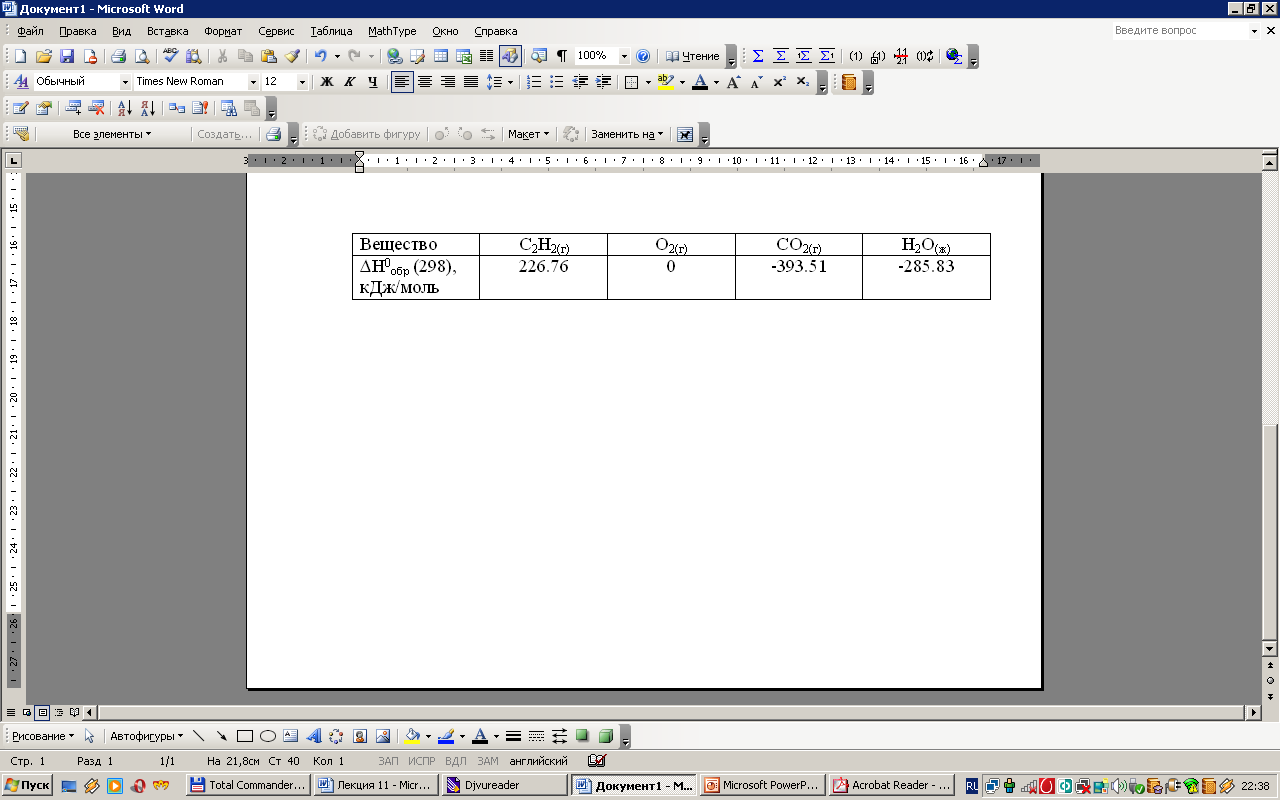
3. Вычислить стандартную энтальпию реакции при 298к
2 С2Н5ОН(газ)→С4Н6(газ)+Н2(газ)+2Н2О(газ)
на основании следующих данных:
4. Классификация систем по числу компонентов, фаз и числу степеней свободы. Правило фаз Гиббса.
5. Что такое дисперсионная среда (ДС) и дисперсная фаза (ДФ)?
Приведите классификацию дисперсных систем по агрегатному состоянию
ДС и ДФ, а также по размерам частиц ДФ.
6. Каким воздействием на обратимую химическую реакцию
CO(г) + Cl2(г) ↔ COCl2 (г) + Q
Можно максимально сместить равновесие в сторону образования продуктов?
а) увеличить температуру и уменьшить давление;
б) уменьшить температуру и уменьшить давление;
в) увеличить температуру и увеличить давление;
г) уменьшить температуру и увеличить давление.
Задание 3.
-
Сформулируйте второй и третий законы термодинамики.
-
Дайте определение, что такое термодинамические функции. Приведите примеры термодинамических функций.
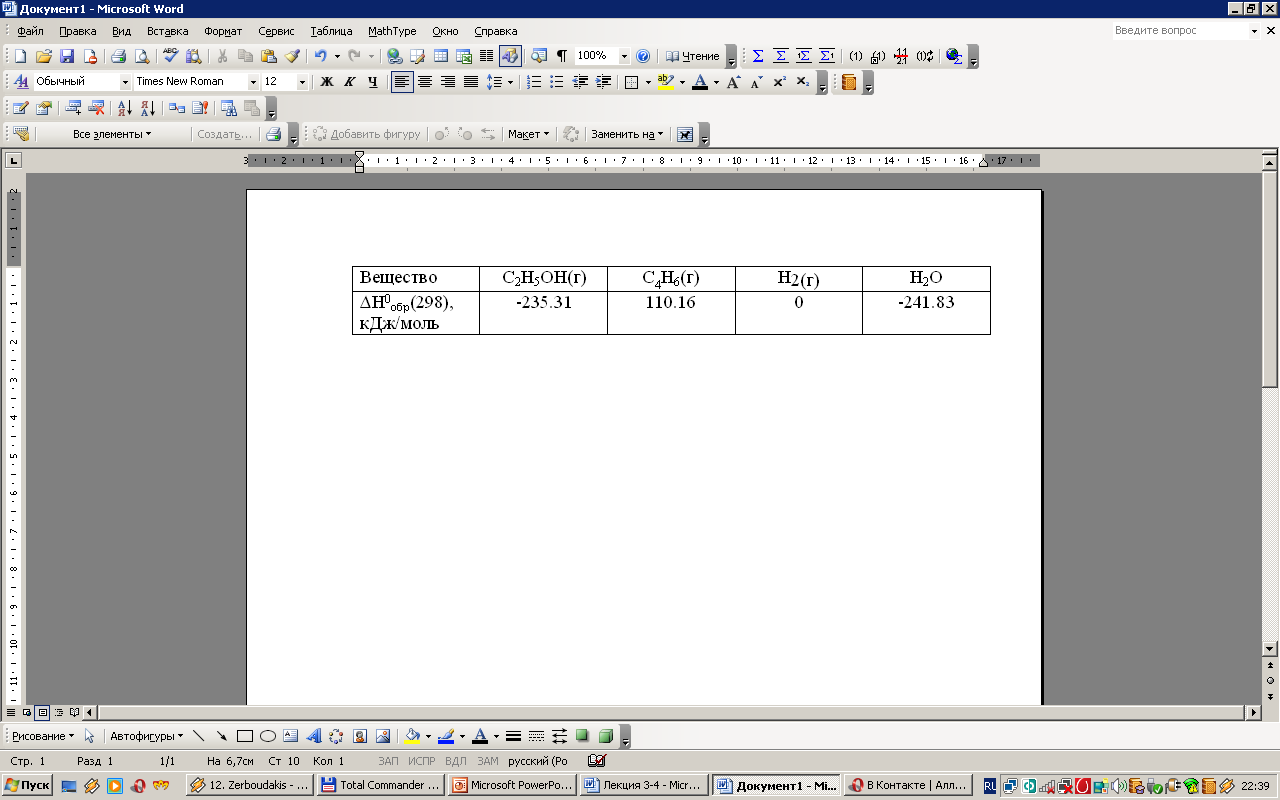
3. Вычислить стандартную энтальпию реакции при 298К
![]()
на основании следующих данных:
4. Зависимость скорости реакции от температуры и концентрации веществ.
5. В каком случае равновесие сместится вправо:
CO(г) + Cl2(г) ↔ COCl2 (г) - Q
- при повышении давления.
- при понижении температуры,
- при повышении концентрации СО
- при повышении температуры
6. Что называют истинным раствором? Каковы основные отличия истинного
раствора от коллоидного? Приведите примеры растворов всех типов.
Задание 4.
1. Дайте определение энтальпии, энтропии и внутренней энергии системы.
2. Тепловой эффект химической реакции. Закон Гесса и следствия из него.
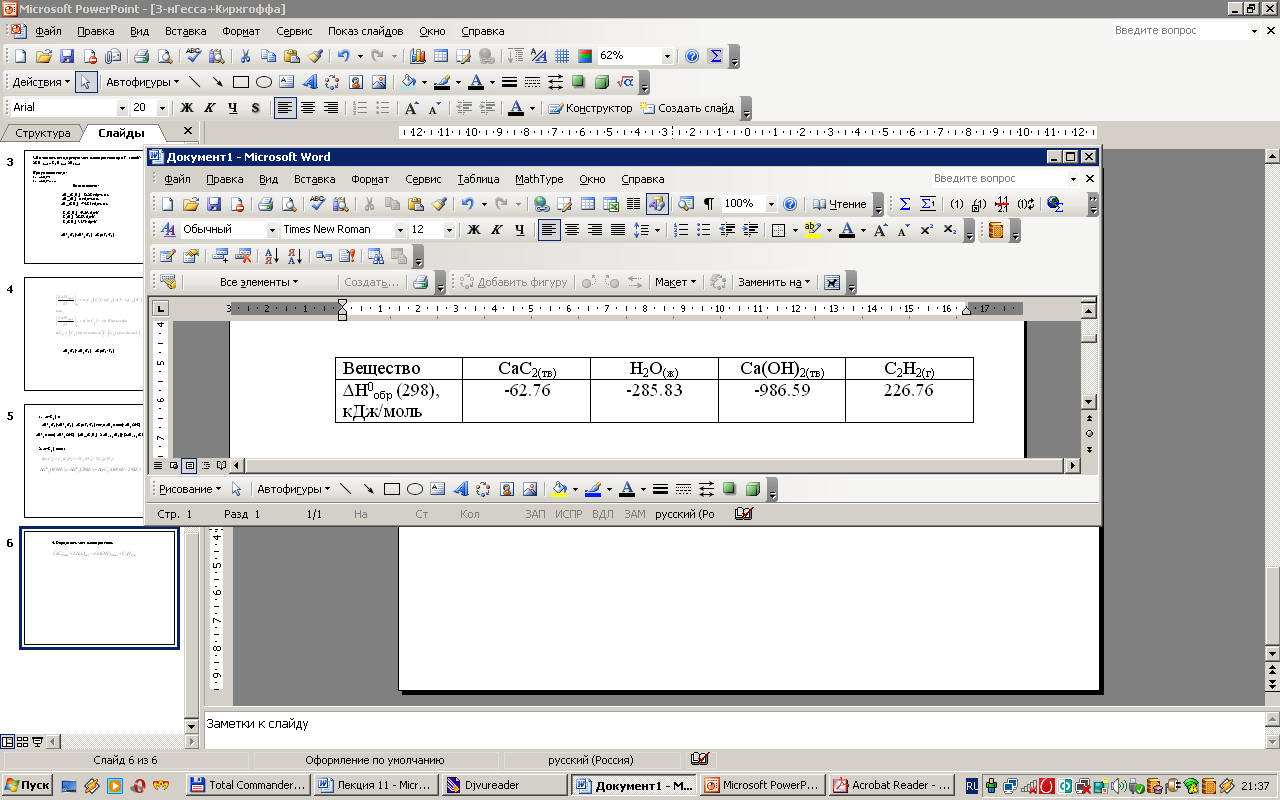
3. Вычислить стандартную энтальпию реакции при 298К
![]()
на основании следующих данных:

4. Дать определение скорости химической реакции. Константа скорости. Закон действия масс.
5. В каком случае равновесие сместится вправо:
СО2 (г) + С(ТВ) ↔ 2 СО(г) + Q
- при повышении давления.
- при понижении температуры,
- при повышении концентрации СО
- при повышении температуры
6. Что такое коллоидные системы, чем они отличаются от взвесей.
Задание 5.
1. Химическое равновесие. Константа химического равновесия.
2. Изобарно-изотермический потенциал и его физический смыл.
3![]() .
Вычислить
стандартную энтальпию реакции при 298К
.
Вычислить
стандартную энтальпию реакции при 298К
на основании следующих данных:
4. Как измениться скорость химической реакции при увеличении концентрации продуктов химической реакции и уменьшении температуры. Объясните, применяя законы и соотношения.
5![]() .
В каком случае равновесие сместиться
влево:
.
В каком случае равновесие сместиться
влево:
- при повышении давления.
- при понижении температуры,
- при повышении концентрации NО
- при повышении температуры
6. Что называется коагуляцией коллоидного раствора? Какие воздействия
на коллоидный раствор могут вызвать его коагуляцию?
Задание 6.
1. Химическая кинетика. Принцип формальной кинетики - Закон действующих масс.
2. Что такое внутренняя энергия системы? Из чего она складывается?
