
Глава 2.
2.1. Анализ амбулаторных карт пациентов впервые вставших на учет с диагнозом «меланома кожи» за период с 2006 по 2008гг. и умерших до 2010г. включительно.
Материалы и методы:ретроспективный анализ проводился путем исследования и статистической обработки полученных данных из амбулаторных карт пациентов (форма №025/у) с впервые установленным диагнозом: «меланома кожи» за период с 2006 по 2008гг. и умерших от каких-либо причин до 2010г. включительно. Всего в выборку вошли 76 амбулаторных карт пациентов впервые вставших на диспансерный учет в ГУЗ РКОД МЗ УР за 2006 – 2008гг. и умерших от различных факторов до 2010 года включительно.
В сформированной выборке основными критериями и параметрами ретроспективного анализа явились:
1. оценить длительность временного интервала с момента появления первых жалоб у пациента по поводу пигментного образования кожи и его первичного обращения за специализированной медицинской помощью в поликлинику ГУЗ РКОД МЗ УР.
2. оценить полноценность набора диагностических мероприятий и своевременность направления пациента на госпитализацию в хирургическое отделение №3 онкологического диспансера на оперативное лечение.
3. оценить адекватность лечебных мероприятий, проводимых каждому пациенту с верифицированным диагнозом «меланома кожи» и сроки безрецидивного периода у пациентов, получивших только оперативное лечение по радикальной программе, по отношению к лицам, завершивших комбинированное лечение (операция и курсы иммунохимиотерапии).
В состав нашей выборке вошли 76 амбулаторных карт пациентов (форма №025/у) состоящих на учете в республиканском клиническом онкологическом диспансере с верифицированным диагнозом: «меланома кожи» за трехлетний период (2006 – 2008гг. включительно), но умерших от различных причин по 2010 год.
Возраст по данной выборке колебался в достаточно широких пределах: от 35 до 92 лет. Средний возраст по выборке составил 62,42±1,45 года.
Половой состав выборки был также неоднороден: мужчины – 33 человека (43,42±5,70%), женщины – 43 (56,58±5,70%) соответственно. При этом в нашей выборке достоверно преобладали женщины (χ²=2,132; n=1;p<0,5).
Диаграмма №1.

В состав нашей выборки также входили лица, проживавшие как в городе Ижевске, так и в районах Удмуртской республики. При анализе распределения контингента выборки между городом Ижевском и районами Удмуртской республики были получены следующие данные: на жителей столицы приходилось 40 (52,63±5,70%) случаев, в то время как на районы лишь 36 (47,37±5,70%). При этом статистически достоверно значимого преобладания контингента жителей города Ижевска над населением районов Удмуртской республики не было (χ²=0,237; n=1; р>0,5).
Диаграмма №2.

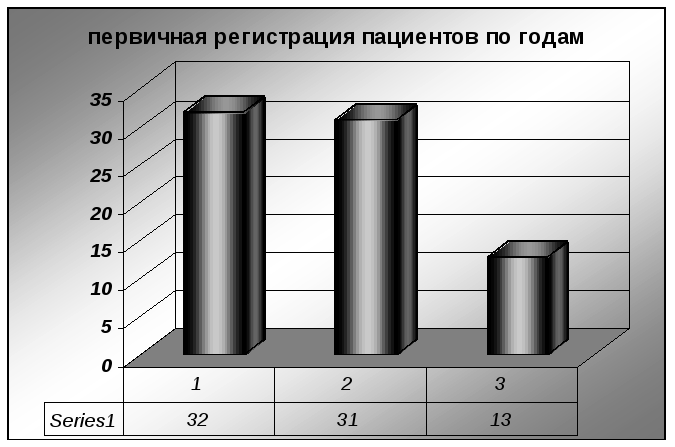
Первичная регистрация лиц с верифицированным диагнозом «меланома кожи» за анализируемый нами период с 2006 по 2008гг. была различной с преимущенной постановкой на учет в 2006 и 2007 годах и с последующим резким спадом в 2008 году. При этом случаи первичной регистрации пациентов в 2006 году достоверно преобладали над аналогичным показателем в 2007 и 2008гг. (χ²=3,184; n=1; р<0,1).
Диаграмма №3.
При анализе 76 амбулаторных карт, вошедших в нашу выборку, было отмечено, что сроки обращения пациентов в поликлинику ГУЗ РКОД МЗ УР колеблются в широких пределах (от 2 недель до 10 лет). Средний период обращения за специализированной медицинской помощью по выборке составил 16,49±2,91 мес.
Анализируя топографическую локализацию меланомы кожи нами были получены следующие данные: ведущими локализациями первичной опухоли явились туловище, нижние и верхние конечности: 32 (42,10±5,70%), 25 (32,90±5,40%) и 10 (13,15±3,90%) случаев соответственно. Довольно редко встречалось поражение лица и волосистой части головы и шеи – 3 (3,95±2,20%) и 6 (7,90±3,10%) клинических наблюдений соответственно. При этом достоверно чаще среди прочих локализаций первичной опухоли встречалось туловище (χ²=3,184; n=1; р<0,1), что не противоречит данным отечественных и зарубежных литературных источников.
Диаграмма №4.

В распределении контингента изучаемой нами выборке по стадиям заболевания имеет некоторые особенности. В частности, ведущей стадией выборки была II-ая – 35 (46,05±5,70%) случаев, остальные стадии первичной распространенности опухолевого процесса распределились следующим образом:III-я стадия – 18 (23,68±4,90%),I-ая стадия – 13 (17,11±4,30%) иIV-ая стадия – 10 (13,16±3,90%) наблюдений соответственно. Это и демонстрирует следующая диаграмма.
Диаграмма №5.

При этом вторая стадия заболевания достоверно встречалась чаще (χ²=0,658; n=1; р<0,5).
В нашем исследовании уделялось особое внимание таким параметрам как уровень инвазии в дерму опухолевых клеток по Clarkи измерение толщины первичной опухоли поBreslau, что обусловливает в большинстве клинических наблюдений раннее прогрессирование опухолевого процесса и, соответственно, сокращение сроков безрецидивного периода после проведенного радикального лечения. При исследовании в амбулаторных картах 76 пациентов, вошедших в выборку, результатов патоморфологического исследования операционного материала нами были получены следующие результаты:
1. при изучении уровня инвазии в дерму опухолевых клеток по Clarkвыявлена следующая картина. Достоверно чаще в анализируемой выборке встречалсяIIIуровень инвазии опухолевых клеток в дерму 22 (28,95±5,20%) (χ²=25,289;n=1; р<0,001). Показатели инвазии меланоцитов в дерму поClarkпо результатам ретроспективного исследования были представлены следующими значениями:I-ый уровень инвазии по данной выборке не встречался, наII-ой,IV-ый иV-ый уровни инвазии пришлось 4 (5,26±2,60%), 21 (27,63±5,10%) и 11 (14,47±4,00%) соответственно. Заслуживают отдельного внимания 18 (23,69±4,90%) амбулаторных карт, в которых при анализе данных патоморфологического исследования уровень инвазии в дерму поClarkне был установлен, вследствие того, что первоначальное хирургическое вмешательство проводилось по месту амбулаторного наблюдения пациентов, а присланный патологический материал был низкого качества и зачастую линии резекции проходили по опухолевой ткани.
Диаграмма №6.
 2. при анализе такого параметра как
толщина первичной опухоли поBreslau,
были получены следующие результаты.
Достоверно чаще по результатам
патоморфологического исследования
встречалась первичная опухоль толщиной
4 и более миллиметров – 27 (35,53±5,50%) случаев
(χ²=11,605;n=1; р<0,001).
Ретроспективное исследование показало,
что в изучаемой выборке наблюдений
первичной опухоли толщиной менее 0,75 мм
не было, на интервалы от 0,75 до 1,5 мм. и от
1,5 – 4,0 мм. пришлось 5 (6,57±2,80%) и 19
(25,00±5,00%) случаев соответственно. Обращает
на себя внимание и тот факт, что в 25
(32,90±5,40%) случаях толщина первичной
опухоли не была выставлена, что,
по-видимому, обусловлено теми же
причинами, по которым не был выставлен
и уровень инвазии в дерму поClark.
2. при анализе такого параметра как
толщина первичной опухоли поBreslau,
были получены следующие результаты.
Достоверно чаще по результатам
патоморфологического исследования
встречалась первичная опухоль толщиной
4 и более миллиметров – 27 (35,53±5,50%) случаев
(χ²=11,605;n=1; р<0,001).
Ретроспективное исследование показало,
что в изучаемой выборке наблюдений
первичной опухоли толщиной менее 0,75 мм
не было, на интервалы от 0,75 до 1,5 мм. и от
1,5 – 4,0 мм. пришлось 5 (6,57±2,80%) и 19
(25,00±5,00%) случаев соответственно. Обращает
на себя внимание и тот факт, что в 25
(32,90±5,40%) случаях толщина первичной
опухоли не была выставлена, что,
по-видимому, обусловлено теми же
причинами, по которым не был выставлен
и уровень инвазии в дерму поClark.
Диаграмма №7.

При анализе корреляционной зависимости уровня инвазии опухолевых клеток в дерму по Clarkс толщиной первичной опухоли поBreslauбыла выявлена сильная прямая связь этих показателей (r>0,5; при р<0,5). Таким образом, при росте одного параметра (уровень инвазии в дерму) происходит достоверный рост другого (толщина первичной опухоли). Что не противоречит литературным источникам. Помимо этого, при анализе корреляционной зависимости толщины превичной опухоли поBreslauсо стадией заболевания была выявлена сильная прямая связь этих параметров (r>0,5; при р<0,5), иными словами чем толще первичная опухоль, тем, соответственно, выше стадия опухолевого процесса.
Первичная диагностика в поликлинике ГУЗ РКОД МЗ УР основывалась в основном на объективном осмотре больного: осмотра первичной опухоли, измерении размеров, в случае ее изъязвления – брались мазки-отпечатки; проводилась пальпация групп регионарных лимфатических узлов; в сомнительных случаях применялся метод ультразвукового исследования с целью детального осмотра печени и увеличенных регионарных лимфатических узлов, выполнялась рентгенография грудной клетки. При дальнейшем динамическом наблюдении инструментальные методы диагностики использовались чаще: ультразвуковое исследование печени и в сомнительных случаях регионарных лимфатических узлов если отмечалось их увеличение в размерах, рентгенография легких, компьютерная и магнитно-резонансная томография в случаях очаговой неврологической симптоматики у пациентов с целью исключения метастатического поражения головного мозга. Объективный осмотр заключался в осмотре послеоперационного рубца и пальпации всех групп регионарных лимфатических узлов.
В зависимости от катамнестических данных, полученных от пациента, данных объективного осмотра пациента строилась дальнейшая тактика ведения и планировалось специализированное лечение пациента по радикальной программе. При ретроспективном анализе методов специализированного лечения, применяемого в каждом конкретном случае, были получены следующие результаты. Хирургический метод достоверно занимал ведущее место в структуре специализированной медицинской помощи пациентам, не только в качестве единственного ее способа, но и как ведущий этап комбинированного лечения (радикальная операция и последующие курсы лекарственной терапии) (χ²=73,921; n=1; р<0,001). Следует отметить, что в среднем по изучаемой нами выборке было выполнено 1,57±0,1 оперативных вмешательств на каждом пациенте. Оперативные вмешательства, в большинстве своем применявшиеся у пациентов, носили радикальный характер. 55 пациентам из 76 были выполнены радикальные операции в объеме широкого иссечения образования на коже, с последующей пластикой свободно-перемещенным кожным лоскутом, дополненные в случаях регионарного метастазирования и/или местной распространенности опухолевого процесса операциями типа Дюкена, Дюкена-Мельникова (при локализации первичной опухоли на коже нижних конечностей или при метастатическом поражении паховых и подвздошных лимфатических узлов при опухолях различной локализации); футлярно-фасциальной лимфодиссекцией (при локализациях первичной опухоли на кожных покровах лица и волосистой части головы и шеи); подмышечно-подлопаточно-подключичной лимфодиссекцией (при локализациях меланомы на коже верхних конечностяей и туловища, в случае регионарного метастазирования в соответствующие группы лимфатических узлов. В случаях увеличения регионарных лимфатических узлов, уровне инвазии по КларкI\/, \/, нерадикально выполненных операциях по месту медицинского обслуживания (8) и в условиях поликлиники ГУЗ РКОД МЗ УР (2, в объеме лазерной вапоризации и радикальной электрокоагуляции (РЭК), оперативные вмешательства выполнялись в объеме широкого иссечения прежнего послеоперационного рубца с последующим патоморфологическим исследованием последнего и выполнения удаления регионарных групп лимфатических узлов (операции типа Дюкена, подмышечно-подлопаточно-подключичная лимфаденэктомия).
Диаграмма №8.

Курсы химиотерапии применялись в качестве дополнительного этапа комбинированного метода лечения. По нашей выборке комбинированное лечение было выполнено в 27 случаях, при этом среднее число курсов химиотерапии составило 3,32±0,58. Обращает на себя внимание, что помимо курсов полихимиотерапии с применением препарата имидазолкарбоксамида (дакарбазин) применялись препараты рекомбинантного α2-интерферона в стандартных дозах (5 – 6 млн. ЕД. в течение 6-ти дней, Σ=30 – 35 млн. ЕД. на курс), оценить адекватность применения только интерферонотерапии не представляется возможным ввиду ее сочетанного применения наряду с дакарбазином и в ряде случаев происходило чередование курсов полихимиотерапии и иммунотерапии. Следует иметь ввиду, что курсы химио- и иммунотерапии применялись в основном с паллиативной целью и использовались для попытки стабилизации опухолевого процесса у пациентов (перевода в ремиссию), при этом нередко на фоне длительного приема препаратов рекомбинантного α2-интерферона в дозировках 5-6 млн. ЕД. 2-3 раза в неделю в течение 6-ти месяцев нередко возникало прогрессирование процесса, что приводило к преждевременной отмене препарата.
Следует обратить внимание на тот факт, что безрецидивный период по выборке, получавшей только хирургический метод специализированного лечения, (38 объектов) составил 20,59±2,58 месяцев, в то время как в аналогичной выборке, получившей комбинированное специализированное лечение, состоявшее из хирургического этапа с последующей химио-иммунотерапией период до прогрессирования составил лишь 11,33±1,7 месяцев. При сравнении данных выборок отмечается достоверно значимое превышение сроков безрецидивного периода в группе, получившей тольеко оперативное лечение (t=2,74;n=63; р<0,008).
Анализируя данную выборку нами были выявлены 11 (14,47±4,00%) случаев отказа пациентов от специализированного лечения, причинами большинства отказов в этих случаях явились собственное решение пациента и тяжелая сопутствующая сердечно-сосудистая и дыхательная патология в фазе декомпенсации.
При анализе такого показателя как длительность безрецидивного периода нами были получены следующие результаты. Безрецидивный период по анализируемой выборке в среднем составил 15,94±1,64 месяца. При исследовании корреляционной зависимости сроков безрецидивного периода от стадии заболевания была получена сильная обратная связь (r>-0,5; при р<0,5), т.е. на поздних стадиях заболевания сроки безрицидивного периода сокращаются.
Заслуживает так же внимания и распределение случаев летального исхода в последующие годы после первичной постановки пациентов на учет в республиканский клинический онкологический диспансер.
Диаграмма №9.

Следует отметить, что достоверно чаще случаи летального исхода пациентов по нашей выборке приходились на 2008 год – 23 (30,26±5,30%) случая (χ²=22,132; n=1; р<0,001), по остальным годам картина была следующей: на 2006 год пришлось 5 (6,58±2,80%), 2007 год – 9 (11,84±3,70%), 2009 год – 19 (25,00±5,00%) и 2010 год – 20 (26,32±5,10%) случаев.
Среди непосредственных причин летального исхода в анализируемой выборке достоверно чаще встречалась меланома кожи в 71 (93,42±2,80%) случае (χ²=111,184; n=1; р<0,001). На другие причины летального исхода, в частности сердечно-сосудистую патологию, печеночную недостаточность и т.д. пришлось 5 (6,58±2,80%) случаев.
Диаграмма №10.

Таким образом, анализируя выборку из 76 амбулаторных карт пациентов, впервые вставших на учет с верифицированным диагнозом «меланома кожи» за 2006 – 2008 годы, но умерших от различных причин до 2010 года включительно, нами были получены следующие результаты. Возраст по данной выборке колебался в достаточно широких пределах: от 35 до 92 лет. Средний возраст по выборке составил 62,42±1,45 года. Половой состав выборки был также неоднороден: мужчины – 33 человека (43,42±5,70%), женщины – 43 (56,58±5,70%) соответственно. При этом в нашей выборке достоверно преобладали женщины (χ²=2,132; n=1;p<0,5). При анализе распределения контингента выборки между городом Ижевском и районами Удмуртской республики были получены следующие данные: на жителей столицы приходилось 40 (52,63±5,70%) случаев, в то время как на районы лишь 36 (47,37±5,70%). При этом статистически достоверно значимого преобладания контингента жителей города Ижевска над пациентами из районов Удмуртской республики не было (χ²=0,237;n=1; р>0,5). Первичная регистрация лиц с верифицированным диагнозом «меланома кожи» за анализируемый нами период с 2006 по 2008гг. была различной с преимущенной постановкой на учет в 2006 и 2007 годах и с последующим резким спадом в 2008 году. При этом случаи первичной регистрации пациентов в 2006 году достоверно преобладали над аналогичным показателем в 2007 и 2008гг. (χ²=3,184;n=1; р<0,1). Средний период обращения за специализированной медицинской помощью по выборке составил 16,49±2,91 мес. Анализируя топографическую локализацию меланомы кожи были получены следующие данные: ведущими локализациями первичной опухоли явились туловище, нижние и верхние конечности: 32 (42,10±5,70%), 25 (32,90±5,40%) и 10 (13,15±3,90%) случаев соответственно. Довольно редко встречалось поражение лица и волосистой части головы и шеи – 3 (3,95±2,20%) и 6 (7,90±3,10%) случаев соответственно. При этом достоверно чаще среди прочих локализаций первичной опухоли встречалось туловище (χ²=3,184;n=1; р<0,1). Ведущей стадией по нашей выборке былаII-ая – 35 (46,05±5,70%) случаев, остальные стадии первичной распространенности опухолевого процесса распределились следующим образом:III-я стадия – 18 (23,68±4,90%),I-ая стадия – 13 (17,11±4,30%) иIV-ая стадия – 10 (13,16±3,90%) наблюдений соответственно. При этом вторая стадия заболевания достоверно встречалась чаще (χ²=0,658;n=1; р<0,5). Достоверно чаще в анализируемой выборке встречалсяIIIуровень инвазии опухолевых клеток в дерму 22 (28,95±5,20%) случая (χ²=25,289;n=1; р<0,001). Показатели инвазии меланоцитов в дерму поClarkпо результатам ретроспективного исследования были представлены следующими значениями:I-ый уровень инвазии по данной выборке не встречался, наII-ой,IV-ый иV-ый уровни инвазии пришлось 4 (5,26±2,60%), 21 (27,63±5,10%) и 11 (14,47±4,00%) соответственно. Заслуживают отдельного внимания 18 (23,69±4,90%) амбулаторных карт, в которых уровень инвазии в дерму поClarkне был установлен, вследствие низкого качества гистологических препаратов и наличия линий резекции проходивших по опухолевой ткани. Достоверно чаще по результатам патоморфологического исследования встречалась первичная опухоль толщиной 4 и более миллиметров – 27 (35,53±5,50%) случаев (χ²=11,605;n=1; р<0,001). Ретроспективное исследование показало, что в изучаемой выборке наблюдений первичной опухоли толщиной менее 0,75 мм не было, на интервалы от 0,75 до 1,5 мм. и от 1,5 – 4,0 мм. пришлось 5 (6,57±2,80%) и 19 (25,00±5,00%) случаев соответственно. Обращает на себя внимание и тот факт, что в 25 (32,90±5,40%) случаях толщина первичной опухоли не была выставлена, что, по-видимому, обусловлено теми же причинами, по которым не был выставлен и уровень инвазии в дерму поClark. При анализе корреляцинной зависимости уровня инвазии опухолевых клеток в дерму поClarkс толщиной первичной опухоли поBreslauбыла выявлена сильная прямая связь этих показателей (r>0,5; при р<0,5). При ретроспективном анализе методов специализированного лечения, применяемого в каждом конкретном случае, были получены следующие результаты. Хирургический метод достоверно занимал ведущее место в структуре специализированной терапии пациентов, не только в качестве единственного ее способа, но и как ведущий этап комбинированного лечения (радикальная операция и последующие курсы химиотерапии) (χ²=73,921;n=1; р<0,001). Следует отметить, что в среднем по изучаемой нами выборке было выполнено 1,57±0,1 оперативных вмешательств на каждом пациенте. Курсы химиотерапии применялись в качестве дополнительного этапа комбинированного метода лечения. По нашей выборке комбинированное лечение было выполнено в 27 случаях, при этом среднее число курсов химиотерапии составило 3,32±0,58 по каждому пациенту. Оценить адекватность применения только иммунотерапии не представляется возможным ввиду ее сочетанного применения наряду с дакарбазином. В ряде случаев происходило чередование курсов полихимиотерапии и иммунотерапии. Следует иметь ввиду, что курсы химио- и иммунотерапии применялись в основном с паллиативной целью и использовались для попытки стабилизации опухолевого процесса у пациентов (перевод в ремиссию), при этом нередко на фоне длительного приема препаратов рекомбинантного α2-интерферона в дозировках 5-6 млн. ЕД. 2-3 раза в неделю в течение 6-ти месяцев нередко возникало прогрессирование опухолевого процесса, что приводило к преждевременной отмене препарата и, соответственно, переводу пациента на симптоматическую терапию по месту амбулаторного обслуживания. Безрецидивный период по выборке, получившей только хирургический метод специализированного лечения, (38 объектов) составил 20,59±2,58 месяцев, в то время как в выборке, получившей комбинированное специализированное лечение, состоявшее из хирургического этапа с последующей химио-иммунотерапией, (27 объектов) период до прогрессирования заболевания составил лишь 11,33±1,7 месяцев. При сравнении данных выборок отмечается достоверно значимое превышение сроков безрецидивного периода в группе, получившей только оперативное лечение (t=2,74;n=63; р<0,008). Анализируя данную выборку нами были выявлены 11 (14,47±4,00%) случаев отказа пациентов от специализированного лечения, причинами большинства отказов в этих случаях явились собственное решение пациента и тяжелая сопутствующая сердечно-сосудистая и дыхательная патология в фазе декомпенсации. Безрецидивный период по анализируемой выборке в среднем составил 15,94±1,64 месяца. Следует отметить, что достоверно чаще случаи летального исхода пациентов по нашей выборке приходились на 2008 год – 23 (30,26±5,30%) случая (χ²=22,132;n=1; р<0,001), по остальным годам картина была следующей: на 2006 год пришлось 5 (6,58±2,80%), 2007 год – 9 (11,84±3,70%), 2009 год – 19 (25,00±5,00%) и 2010 год – 20 (26,32±5,10%) случаев. Среди непосредственных причин летального исхода в анализируемой выборке достоверно чаще встречалось прогрессирование меланомы кожи в 71 (93,42±2,80%) случае (χ²=111,184;n=1; р<0,001). На другие причины летального исхода, в частности тяжелую сердечно-сосудистую патологию, печеночную недостаточность и т.д. пришлось 5 (6,58±2,80%) случаев.
2.2Анализ амбулаторных карт пациентов с диагнозом «меланома кожи» впервые вставших на учет в ГУЗ РКОД МЗ УР с 2006 по 2008гг. и продолжающие жить по настоящее время.
Материалы и методы:ретроспективный анализ проводился путем детального исследования данных амбулаторных карт пациентов (ф. №025/у) впервые взятых на учет с верифицированным диагнозом «меланома кожи» за период с 2006 по 2008 года. Всего в данную выборку было включено 97 (68,31%) амбулаторных карт пациентов из 142. 45 амбулаторных карт ввиду их отсутствия в регистратуре на момент формирования выборки были нами сознательно из нее исключены.
В сформированной нами выборке основными критериями и параметрами ретроспективного и статистического анализа явились:
1. оценка длительности временного интервала с момента появления первых жалоб у пациента по поводу пигментного образования кожи и его первичного обращения за специализированной медицинской помощью в поликлинику ГУЗ РКОД МЗ УР.
2. оценка полноценности набора диагностических мероприятий и своевременность направления пациента на госпитализацию в профильное хирургическое отделение №3 онкологического диспансера на оперативное лечение.
3. оценка адекватности лечебных мероприятий, проводимых каждому пациенту с верифицированным диагнозом «меланома кожи» и сроки безрецидивного периода у пациентов, получивших только оперативное лечение по радикальной программе, по отношению к лицам, завершивших комбинированное лечение (операция и курсы иммунохимиотерапии).
Контингент нашей выборки состоял из 97 амбулаторных карт пациентов впервые вставших на учет с верифицированным диагнозом «меланома кожи» за трех летний период (с 2006-й по 2008-ой исследуемые годы).
Возрастной критерий по нашей выборке колебался в широких пределах от 28-ми до 93-х лет. При этом средний возраст по выборке составил 58,04±1,53 года.
Половой состав был также неоднороден. При изучении данного параметра было выявлено значительное преобладание в контингенте выборки лиц женского пола 69 (71,13±4,50%) человек, в то время как на лица мужского пола пришлось 28 (28,87±4,50%) случаев. Следует отметить, что преобладание в нашей выборке женщин было также и статистически достоверным (χ²=32,990; n=1; р<0,001).
Диаграмма №11.

При изучении места проживания контингента анализируемой нами выборки были получены следующие данные. На контингент из районов Удмуртской республики пришлось 58 (59,79±5,00%) случаев, в то время как на жителей города Ижевска – 39 (40,21±5,00%) человек. Следует также отметить, что преобладание населения из районов Удмуртской республики над проживающими в городе Ижевске было статистически достоверным (χ²=6,680; n=1; р<0,01).
Диаграмма №12.

Распределение объектов анализируемой нами выборки по дате первичной регистрации было следующим. Большинство случаев первичного взятия на учет пациентов с верифицированным диагнозом «меланома кожи» отмечалось в 2008 году – 36 (37,11±4,90%). На 2006-й и 2007-й исследуемые годы первичное взятие на учет и регистрация пациентов по поводу меланомы кожи составило 32 (32,99±4,80%) и 29 (29,90±4,60%) случаев соответственно. При этом численное большинство случаев первичной регистрации и учета пациентов с меланомой кожи, пришедшихся на 2008 год было еще и статистически достоверным (χ²=11,876; n=1; р<0,001).
Диаграмма №13.

В анализируемой нами выборке, состоящей из 97 амбулаторных карт пациентов, впервые вставших на учет в республиканский клинический онкологический диспансер с верифицированным диагнозом «меланома кожи» особое значение отводилось временному интервалу между появлением у пациентов первых симптомов заболевания (жалобы на изменение окраски пигментного образования, быстрый его рост, появление зуда кожных покровов, наличие кроточивости пигментного образования) и датой первого обращения за специализированной медицинской помощью к врачам-онкологам в поликлинику ГУЗ РКОД МЗ УР. Следует отметить, что данный показатель по выборке колебался в широких пределах от 2 недель до нескольких десятков лет. Средний период обращения по поводу вышеуказанных жалоб к онкологам поликлиники по данной выборке составил 22,11±4,43 месяца.
При изучении топографической локализации пигментного образования на коже 97 объектов, вошедших в нашу выборку было отмечено, что ведущими локализациями пигментных образований по данным выборки явились кожа туловища и нижних конечностей – 46 (47,42±5,10%) и 26 (26,81±4,50%) случаев соответственно. Из других локализаций встречалось поражение кожи верхних конечностей в 11 (11,34±3,20%), лица в 6 (6,19±2,40%), волосистой части головы в 3 (3,09±1,08%), уха и наружного слухового прохода в 3 (3,09±1,08%) случаев.
Диаграмма №14.

Следует отметить, что локализация первичной опухоли на коже туловища и нижних конечностей были не только ведущими по данной выборке, но и статистически достоверно чаще встречались (χ²=43,629; n=1; р<0,001).
При анализе нашей выборки мы также уделяли внимание такому показателю, как распределение контингента выборки по стадиям опухолевого процесса. По полученным данным ведущей явилась 2 стадия заболевания 46 (47,42±5,10%) случаев. На другие стадии меланомы кожи пришлось: на 1-ую – 42 (43,30±5,00%), на 3-ью – 7 (7,22±2,60%) и на 4-ую – 2 (2,06±1,40%) случаев. Следует отметить, что в данной выборке ведущими были ранние стадии опухолевого процесса, которые помимо значительного численного преимущества (88 случаев) были еще и статистически достоверны (χ²=125,443; n=1; р<0,001).
Диаграмма №15.

При анализе данной выборки также уделялось внимание таким показателям как уровень инвазии в дерму опухолевых клеток по Clark, так и толщина первичной опухоли поBreslau.
При изучении первого показателя (уровень инвазии в дерму по Clark) были получены следующие данные. Ведущим уровнем инвазии в дерму опухолевых клеток по нашей выборке былIII– 30 (30,93±4,70%) случаев. На остальные уровни пришлись следующие значения: наI-ый – 6 (6,19±2,40%), наII-ой – 22 (22,68±4,30%), наIV-ый – 15 (15,46±3,70%) и наV-ый – 8 (8,25±2,80%) случаев соответственно. Следует также отметить, что в 16 амбулаторных картах уровень инвазии в дерму не был выставлен. Вероятнее всего это объясняется плохим качеством присланного патоморфологического материала или же его отсутствием вообще. При статистической обработке данного показателя имеется также и статистическая достоверность преобладанияIII-его уровня инвазии опухолевых клеток в дерму (χ²=26,722;n=1; р<0,001).
Диаграмма №16.

При анализе показателя толщины первичной опухоли по Breslauпо материалам нашей выборки были получены следующие результаты. Ведущими значениями толщины первичной опухоли были показатели, расположенные в интервалах от 1,5 до 4 миллиметров и более 4-х миллиметров, что составило в абсолютных цифрах 45 из 97 случаев. При этом в интервале от 1,5 до 4 мм. было 23 (23,71±4,30%), а в интервале более 4 мм. – 22 (22,68±4,30%) случаев соответственно. На остальные интервалы: до 0,75 мм. и от 0,75 до 1,5 мм. пришлось – 4 (4,12±2,00%) и 19 (19,59±4,00%) объектов соответственно. Следует отметить, что толщина первичной опухоли, находящаяся в промежутке от 1,5 до 4 мм. является статистически достоверным показателем (χ²=12,971;n=1; р<0,001). Обращает на себя внимание и тот факт, что в 29 амбулаторных картах толщина первичной опухоли не была выставлена. Вероятно, это связано с теми же причинами, что и в случае с показателем уровня инвазии в дерму опухолевых клеток, хотя в ряде амбулаторных карт был следующий парадокс: уровень инвазии в дерму стоял, а толщины опухоли не было или же данные показатели менялись местами.
Диаграмма №17.

При изучении корреляционной зависимости показателей уровня инвазии в дерму по Clark, толщины первичной опухоли поBreslauи стадии опухолевого процесса были получены следующие результаты. При сравнении изменения стадии заболевания от уровня инвазии в дерму опухолевых клеток была выявлена сильная прямая связь этих показателей (r>0,5; при р<0,5); при анлогичном сравнении изменении стадии опухолевого процесса от толщины первичной опухоли также была выявлена сильная прямая связь этих показателей (r>0,5; при р<0,5); наконец, при сравнении показателей уровня инвазии опухолевых клеток в дерму с толщиной первичной опухоли также была выявлена сильная прямая связь (r>0,5; при р<0,5). Иными словами, в анализируемой выборке имеется прямая корреляционная зависимость между показателями уровня инвазии в дерму опухолевых клеток поClark, толщиной первичной опухоли поBreslauи стадией опухолевого процесса, т.е. с изменением одного из этих показателей в сторону увеличения параметра его значения происходит соответствующее увеличение значений других показателей (с увеличениет толщины опухоли увеличивается уровень инвазии опухолевых клеток в дерму и, соответственно, происходит увеличение распространенности процесса (растет стадия заболевания)).
Первичная диагностика в поликлинике ГУЗ РКОД МЗ УР основывалась в основном на объективном осмотре больного: осмотра первичной опухоли, измерении размеров, в случае ее изъязвления – брались мазки-отпечатки; проводилась пальпация групп регионарных лимфатических узлов; в сомнительных случаях применялся метод ультразвукового исследования с целью детального осмотра печени и увеличенных регионарных лимфатических узлов, выполнялась рентгенография грудной клетки. При дальнейшем динамическом наблюдении инструментальные методы диагностики использовались чаще: ультразвуковое исследование печени и в сомнительных случаях регионарных лимфатических узлов если отмечалось их увеличение в размерах, рентгенография легких, компьютерная и магнитно-резонансная томография в случаях очаговой неврологической симптоматики у пациентов с целью исключения метастатического поражения головного мозга. Объективный осмотр заключался в осмотре послеоперационного рубца и пальпации всех групп регионарных лимфатических узлов.
В зависимости от катамнестических данных, полученных от пациента, данных объективного осмотра пациента строилась дальнейшая тактика ведения и планировалось специализированное лечение пациента по радикальной программе. При ретроспективном анализе методов специализированного лечения, применяемого в каждом конкретном случае, были получены следующие результаты. Хирургический метод достоверно занимал ведущее место в структуре специализированной медицинской помощи пациентам, не только в качестве единственного ее способа, но и как ведущий этап комбинированного лечения (радикальная операция и последующие курсы лекарственной терапии). По данным нашей выборке хирургический метод лечения применялся самостоятельно в 70 из 97 случаев, что является статистически достоверным параметром (χ²=36,371; n=1; р<0,001). Анализируя данную выборку мы выявили, что в среднем каждому пациенту было выполнено 1,39±0,07 оперативных вмешательств. Оперативные вмешательства, в большинстве своем применявшиеся у пациентов, носили радикальный характер. 74 пациентам из 97 были выполнены радикальные операции в объеме широкого иссечения образования на коже, с последующей пластикой свободно-перемещенным кожным лоскутом, дополненные в случаях регионарного метастазирования и/или местной распространенности опухолевого процесса операциями типа Дюкена, Дюкена-Мельникова (при локализации первичной опухоли на коже нижних конечностей или при метастатическом поражении паховых и подвздошных лимфатических узлов при опухолях различной локализации); футлярно-фасциальной лимфодиссекцией (при локализациях первичной опухоли на кожных покровах лица и волосистой части головы и шеи); подмышечно-подлопаточно-подключичной лимфодиссекцией (при локализациях меланомы на коже верхних конечностяей и туловища, в случае регионарного метастазирования в соответствующие группы лимфатических узлов. В случаях увеличения регионарных лимфатических узлов, уровне инвазии по КларкI\/, \/, нерадикально выполненных операциях по месту медицинского обслуживания и в условиях поликлиники ГУЗ РКОД МЗ УР , в объеме лазерной вапоризации и радикальной электрокоагуляции (РЭК) (18), оперативные вмешательства выполнялись в объеме широкого иссечения прежнего послеоперационного рубца с последующим патоморфологическим исследованием последнего и выполнения удаления регионарных групп лимфатических узлов (операции типа Дюкена, подмышечно-подлопаточно-подключичная лимфаденэктомия). Выполняемые в стационарных условиях республиканского клинического онкологического диспансера оперативные вмешательства были адекватны в объеме своего выполнения.
Курсы лекарственной терапии, включающие назначение производного имидазол карбоксамида (дакарбазин) и препаратов рекомбинантного α2-интерферона по данной выборке назначались только после прогрессирования опухолевого процесса как вспомогательный этап комбинированного лечения и применялись только после выполнения оперативного вмешательства. Проанализировав результаты комбинированного лечения, было выявлено, что объекты выборки, завершившие комбинированное лечение, в среднем получали 4,30±0.68 курсов лекарственной терапии. Оценить эффективность только интерферонотерапии крайне затруднительно, так как они применялись сочетанно с химиопрепаратами других групп, в частности с дакарбазином.
Диаграмма №18.

Следует обратить внимание, что по нашей выборки ведущим методом лечения являлся хирургический, на его долю пришлось 70 (72,17±4,60%) всех случаев. Доля других методов лечения была следующей: на комбинированное лечение (радикальная операция с последующими курсами лекарственной терапии) – 22 (22,68±4,3%) и на модификацию лучевая терапия, с последующей лекарственной терапией 1 (1,03±1,00%). В 4 (4,12±2,00%) случаях отмечался добровольный отказ пациентов от специализированной медицинской помощи.
Анализируя показатель длительности безрецидивного периода по данной выборке нами были получены следующие результаты. Средняя длительность безрецидивного периода по нашей выборке составила 40,09±1,67 месяца.
Таким образом, проведенный анализ выборки, состоящей из 97 амбулаторных карт пациентов, впервые взятых на учет с верифицированным диагнозом «меланома кожи» за исследуемый интервал с 2006 по 2008 года выявил следущее. Возрастной состав выборки колебался в широких пределах от 28-ми до 93-х лет. При этом средний возраст по выборке составил 58,04±1,53 года. Половой состав был также неоднороден. При изучении данного параметра было выявлено значительное преобладание в контингенте выборки лиц женского пола 69 (71,13±4,50%) человек, в то время как на лица мужского пола пришлось 28 (28,87±4,50%) случаев. Следует отметить, что преобладание в нашей выборке женщин было также и статистически достоверным (χ²=32,990;n=1; р<0,001). На контингент из районов Удмуртской республики пришлось 58 (59,79±5,00%) случаев, в то время как на жителей города Ижевска – 39 (40,21±5,00%) человек. Следует также отметить, что преобладание населения из районов Удмуртской республики над проживающими в городе Ижевске было статистически достоверным (χ²=6,680;n=1; р<0,01). Большинство случаев первичного взятия на учет пациентов с верифицированным диагнозом «меланома кожи» отмечалось в 2008 году – 36 (37,11±4,90%). На 2006-й и 2007-й исследуемые годы первичное взятие на учет и регистрация пациентов по поводу меланомы кожи составило 32 (32,99±4,80%) и 29 (29,90±4,60%) случаев соответственно. При этом численное большинство случаев первичной регистрации и учета пациентов с меланомой кожи, пришедшихся на 2008 год было еще и статистически достоверным (χ²=11,876;n=1; р<0,001). Средний период обращения по поводу вышеуказанных жалоб к онкологам поликлиники по данной выборке составил 22,11±4,43 месяца. При изучении топографической локализации пигментного образования на коже 97 объектов, вошедших в нашу выборку было отмечено, что ведущими локализациями пигментных образований по данным выборки явились кожа туловища и нижних конечностей – 46 (47,42±5,10%) и 26 (26,81±4,50%) случаев соответственно. Из других локализаций встречалось поражение кожи верхних конечностей в 11 (11,34±3,20%), лица в 6 (6,19±2,40%), волосистой части головы в 3 (3,09±1,08%), уха и наружного слухового прохода в 3 (3,09±1,08%) случаев, локализация первичной опухоли на коже туловища и нижних конечностей были не только ведущими по данной выборке, но и статистически достоверно чаще встречались (χ²=43,629;n=1; р<0,001). По полученным данным ведущей явилась 2 стадия заболевания 46 (47,42±5,10%) случаев. На другие стадии меланомы кожи пришлось: на 1-ую – 42 (43,30±5,00%), на 3-ью – 7 (7,22±2,60%) и на 4-ую – 2 (2,06±1,40%) случаев. Следует отметить, что в данной выборке ведущими были ранние стадии опухолевого процесса, которые помимо значительного численного преимущества (88 случаев) были еще и статистически достоверны (χ²=125,443;n=1; р<0,001). Ведущим уровнем инвазии в дерму опухолевых клеток по нашей выборке былIII– 30 (30,93±4,70%) случаев. На остальные уровни пришлись следующие значения: наI-ый – 6 (6,19±2,40%), наII-ой – 22 (22,68±4,30%), наIV-ый – 15 (15,46±3,70%) и наV-ый – 8 (8,25±2,80%) случаев соответственно. Следует также отметить, что в 16 амбулаторных картах уровень инвазии в дерму не был выставлен. Вероятнее всего это объясняется плохим качеством присланного патоморфологического материала или же его отсутствием вообще. При статистической обработке данного показателя имеется также и статистическая достоверность преобладанияIII-его уровня инвазии опухолевых клеток в дерму (χ²=26,722;n=1; р<0,001). Ведущими значениями толщины первичной опухоли были показатели, расположенные в интервалах от 1,5 до 4 миллиметров и более 4-х миллиметров, что составило в абсолютных цифрах 45 из 97 случаев. При этом в интервале от 1,5 до 4 мм. было 23 (23,71±4,30%), а в интервале более 4 мм. – 22 (22,68±4,30%) случаев соответственно. На остальные интервалы: до 0,75 мм. и от 0,75 до 1,5 мм. пришлось – 4 (4,12±2,00%) и 19 (19,59±4,00%) объектов соответственно. Следует отметить, что толщина первичной опухоли, находящаяся в промежутке от 1,5 до 4 мм. является статистически достоверным показателем (χ²=12,971;n=1; р<0,001). Обращает на себя внимание и тот факт, что в 29 амбулаторных картах толщина первичной опухоли не была выставлена. Вероятно, это связано с теми же причинами, что и в случае с показателем уровня инвазии в дерму опухолевых клеток. При изучении корреляционной зависимости показателей уровня инвазии в дерму поClark, толщины первичной опухоли поBreslauи стадии опухолевого процесса были получены следующие результаты. При сравнении изменения стадии заболевания от уровня инвазии в дерму опухолевых клеток была выявлена сильная прямая связь этих показателей (r>0,5; при р<0,5); при анлогичном сравнении изменении стадии опухолевого процесса от толщины первичной опухоли также была выявлена сильная прямая связь этих показателей (r>0,5; при р<0,5); наконец, при сравнении показателей уровня инвазии опухолевых клеток в дерму с толщиной первичной опухоли также была выявлена сильная прямая связь (r>0,5; при р<0,5). Иными словами, в анализируемой выборке имеется прямая корреляционная зависимость между показателями уровня инвазии в дерму опухолевых клеток поClark, толщиной первичной опухоли поBreslauи стадией опухолевого процесса, т.е. с изменением одного из этих показателей в сторону увеличения параметра его значения происходит соответствующее увеличение значений других показателей (с увеличениет толщины опухоли увеличивается уровень инвазии опухолевых клеток в дерму и, соответственно, происходит увеличение распространенности процесса (растет стадия заболевания)). По данным нашей выборке хирургический метод лечения применялся самостоятельно в 70 из 97 случаев, что является статистически достоверным параметром (χ²=36,371;n=1; р<0,001). Анализируя данную выборку мы выявили, что в среднем каждому пациенту было выполнено 1,39±0,07 оперативных вмешательств. Проанализировав результаты комбинированного лечения, было выявлено, что объекты выборки, завершившие комбинированное лечение, в среднем получали 4,30±0.68 курсов лекарственной терапии. Оценить эффективность только интерферонотерапии крайне затруднительно, так как они применялись сочетанно с химиопрепаратами других групп, в частности с дакарбазином. Ведущим методом лечения являлся хирургический, на его долю пришлось 70 (72,17±4,60%) всех случаев. Доля других методов лечения была следующей: на комбинированное лечение (радикальная операция с последующими курсами лекарственной терапии) – 22 (22,68±4,3%) и на модификацию лучевая терапия, с последующей лекарственной терапией 1 (1,03±1,00%). В 4 (4,12±2,00%) случаях отмечался добровольный отказ пациентов от специализированной медицинской помощи. Средняя длительность безрецидивного периода по нашей выборке составила 40,09±1,67 месяца.
ЗАКЛЮЧЕНИЕ.
После формировании двух выборок нами был проведен ретроспективный анализ 173 амбулаторных карт пациентов впервые вставших на учет в ГУЗ РКОД МЗ УР за исследуемый нами трехлетний интервал (с 2006 по 2008 года, включительно). При этом вся совокупность была сознательно разделена на две выборки. Первая выборка состояла из 76 амбулаторных карт пациентов впервые вставших на учет в ГУЗ РКОД МЗ УР с верифицированным диагнозом «меланома кожи» с 2006-го по 2008-ой год, включительно, но умерших от различных причин до 2010 года, включительно. Вторая выборка включала в себя 97 амбулаторных карт пациентов, также впервые вставших на учет с диагнозом «меланома кожи» в ГУЗ РКОД МЗ УР с 2006 по 2008 исследуемые года, но продолжающие жить по настоящее время. За время исследования нами был проведен статистический анализ результатов по обеим выборкам.
При изучении объектов, входящих в состав первой и второй групп пациентов нами были получены следующие результаты.
Возрастной состав в обеих выборках колебался в достаточно широких пределах: по первой группе пациентов он составил от 35 до 92 лет. Средний возраст по выборке составил 62,42±1,45 года. Во второй группе пациентов – от 28-ми до 93-х лет. При этом средний возраст по выборке составил 58,04±1,53 года.
Половой состав обеих выборок также был разнороден: по первой группе пациентов – мужчины составили 33 человека (43,42±5,70%), женщины – 43 (56,58±5,70%) соответственно. При этом в нашей выборке достоверно преобладали женщины (χ²=2,132; n=1;p<0,5). Во второй группе пациентов – женщины составили 69 (71,13±4,50%) человек, в то время как мужчины 28 (28,87±4,50%) случаев, преобладание в нашей выборке женщин было статистически достоверным (χ²=32,990;n=1; р<0,001).
При анализе распределения контингента обеих выборок между городом Ижевском и районами Удмуртской республики были получены следующие данные: в первой группе пациентов на жителей столицы приходилось 40 (52,63±5,70%) случаев, в то время как на районы лишь 36 (47,37±5,70%). При этом статистически достоверно значимого преобладания контингента жителей города Ижевска над пациентами из районов Удмуртской республики не было (χ²=0,237; n=1; р>0,5). Во второй группе пациентов – на районы Удмуртской республики пришлось 58 (59,79±5,00%) случаев, в то время как на жителей города Ижевска – 39 (40,21±5,00%) человек. Преобладание населения из районов Удмуртской республики над проживающими в городе Ижевске было статистически достоверным (χ²=6,680;n=1; р<0,01).
Первичная регистрация лиц с верифицированным диагнозом «меланома кожи» по первой группе пациентов за анализируемый нами период с 2006 по 2008гг. была различной с преимущенной постановкой на учет в 2006 и 2007 годах и с последующим резким спадом в 2008 году. При этом случаи первичной регистрации пациентов в 2006 году достоверно преобладали над аналогичным показателем в 2007 и 2008гг. (χ²=3,184; n=1; р<0,1). Во второй группе пациентов – большинство случаев первичного взятия на учет пациентов с диагнозом «меланома кожи» отмечалось в 2008 году – 36 (37,11±4,90%). На 2006-й и 2007-й исследуемые годы первичное взятие на учет и регистрация пациентов по поводу меланомы кожи составило 32 (32,99±4,80%) и 29 (29,90±4,60%) случаев соответственно. При этом первичная регистрация пациентов с меланомой кожи, пришедшихся на 2008 год было статистически достоверным (χ²=11,876;n=1; р<0,001).
Средний период обращения за специализированной медицинской помощью в первой группе пациентов составил 16,49±2,91 мес. Во второй анализируемой группе – средний период обращения составил 22,11±4,43 месяца. При этом период обращения за медицинской помощью объектов первой выборки был достоверно меньше, чем у контингента второй (t=-0,998;n=171; р<0,5).
Ведущими локализациями первичной опухоли у пациентов первой группы явились туловище, нижние и верхние конечности: 32 (42,10±5,70%), 25 (32,90±5,40%) и 10 (13,15±3,90%) случаев соответственно. Довольно редко встречалось поражение лица и волосистой части головы и шеи – 3 (3,95±2,20%) и 6 (7,90±3,10%) случаев соответственно. При этом достоверно чаще среди прочих локализаций первичной опухоли встречалось туловище (χ²=3,184; n=1; р<0,1). У пациентов второй анализируемой группы была иная картина: ведущими локализациями пигментных образований по данным выборки явились кожа туловища и нижних конечностей – 46 (47,42±5,10%) и 26 (26,81±4,50%) случаев соответственно. Из других локализаций встречалось поражение кожи верхних конечностей в 11 (11,34±3,20%), лица в 6 (6,19±2,40%), волосистой части головы в 3 (3,09±1,08%), уха и наружного слухового прохода в 3 (3,09±1,08%) случаев, локализация первичной опухоли на коже туловища и нижних конечностей были статистически достоверными (χ²=43,629;n=1; р<0,001).
Ведущей стадией у пациентов первой группы была II-ая – 35 (46,05±5,70%) случаев, остальные стадии первичной распространенности опухолевого процесса распределились следующим образом:III-я стадия – 18 (23,68±4,90%),I-ая стадия – 13 (17,11±4,30%) иIV-ая стадия – 10 (13,16±3,90%) наблюдений соответственно. При этом вторая стадия заболевания достоверно встречалась чаще (χ²=0,658;n=1; р<0,5). Во второй анализируемой группы была иная картина - ведущей явилась 2 стадия заболевания 46 (47,42±5,10%) случаев. На другие стадии меланомы кожи пришлось: на 1-ую – 42 (43,30±5,00%), на 3-ью – 7 (7,22±2,60%) и на 4-ую – 2 (2,06±1,40%) случаев. Следует отметить, что в данной выборке ведущими были ранние стадии опухолевого процесса, которые были статистически достоверными (χ²=125,443;n=1; р<0,001).
Достоверно чаще у пациентов первой группы встречался IIIуровень инвазии опухолевых клеток в дерму 22 (28,95±5,20%) случая (χ²=25,289;n=1; р<0,001). Показатели инвазии меланоцитов в дерму поClarkпо результатам ретроспективного исследования были представлены следующими значениями:I-ый уровень инвазии по данной выборке не встречался, наII-ой,IV-ый иV-ый уровни инвазии пришлось 4 (5,26±2,60%), 21 (27,63±5,10%) и 11 (14,47±4,00%) соответственно. Заслуживают отдельного внимания 18 (23,69±4,90%) амбулаторных карт, в которых уровень инвазии в дерму поClarkне был установлен, вследствие низкого качества гистологических препаратов и наличия линий резекции проходивших по опухолевой ткани. У пациентов второй анализируемой группы были следующие данные – ведущим уровнем инвазии в дерму опухолевых клеток по нашей выборке былIII– 30 (30,93±4,70%) случаев, отмечена и его статистическая достоверность (χ²=26,722;n=1; р<0,001). На остальные уровни пришлись следующие значения: наI-ый – 6 (6,19±2,40%), наII-ой – 22 (22,68±4,30%), наIV-ый – 15 (15,46±3,70%) и наV-ый – 8 (8,25±2,80%) случаев соответственно. Следует также отметить, что в 16 амбулаторных картах уровень инвазии в дерму не был выставлен. Вероятнее всего это объясняется плохим качеством присланного патоморфологического материала или же его отсутствием вообще.
Достоверно чаще по результатам первой группы пациентов встречалась первичная опухоль толщиной 4 и более миллиметров – 27 (35,53±5,50%) случаев (χ²=11,605; n=1; р<0,001). Ретроспективное исследование показало, что в изучаемой выборке наблюдений первичной опухоли толщиной менее 0,75 мм не было, на интервалы от 0,75 до 1,5 мм. и от 1,5 – 4,0 мм. пришлось 5 (6,57±2,80%) и 19 (25,00±5,00%) случаев соответственно. Обращает на себя внимание и тот факт, что в 25 (32,90±5,40%) случаях толщина первичной опухоли не была выставлена, что, по-видимому, обусловлено теми же причинами, по которым не был выставлен и уровень инвазии в дерму поClark. Ведущими значениями толщины первичной опухоли у пациентов второй группы были показатели, расположенные в интервалах от 1,5 до 4 миллиметров и более 4-х миллиметров, что составило в абсолютных цифрах 45 из 97 случаев. При этом в интервале от 1,5 до 4 мм. было 23 (23,71±4,30%), а в интервале более 4 мм. – 22 (22,68±4,30%) случаев соответственно. На остальные интервалы: до 0,75 мм. и от 0,75 до 1,5 мм. пришлось – 4 (4,12±2,00%) и 19 (19,59±4,00%) объектов соответственно. Следует отметить, что толщина первичной опухоли, находящаяся в промежутке от 1,5 до 4 мм. является статистически достоверным показателем (χ²=12,971;n=1; р<0,001). Обращает на себя внимание и тот факт, что в 29 амбулаторных картах толщина первичной опухоли не была выставлена. Вероятно, это связано с теми же причинами, что и в случае с показателем уровня инвазии в дерму опухолевых клеток.
Хирургический метод достоверно занимал ведущее место в структуре специализированной медицинской помощи пациентам первой группы, не только в качестве единственного ее способа, но и как ведущий этап комбинированного лечения (радикальная операция и последующие курсы химиотерапии) (χ²=73,921; n=1; р<0,001). У пациентов второй анализируемой группы хирургический метод лечения также являлся ведущим методом лечения как в качестве самостоятельного, так и ведущего этапа комбинированного лечения, что является статистически достоверным параметром (χ²=36,371;n=1; р<0,001).
По результатам первой выборки: безрецидивный период по выборке, получившей только хирургический метод специализированного лечения, (38 объектов) составил 20,59±2,58 месяцев, в то время как в выборке, получившей комбинированное специализированное лечение, состоявшее из хирургического этапа с последующей химио-иммунотерапией, (27 объектов) период до прогрессирования заболевания составил лишь 11,33±1,70 месяцев. При сравнении данных выборок отмечается достоверно значимое превышение сроков безрецидивного периода в группе, получившей только оперативное лечение (t=2,74;n=63; р<0,008).
Анализируя первую группу нами были выявлены 11 (14,47±4,00%) случаев отказа пациентов от специализированного лечения, причинами большинства отказов в этих случаях явились собственное решение пациента и тяжелая сопутствующая сердечно-сосудистая и дыхательная патология в фазе декомпенсации. Во второй группе было 4 (4,12±2,00%) случая добровольного отказа пациентов от специализированной медицинской помощи.
Безрецидивный период в среднем по первой выборке составил 15,94±1,64 месяца. По второй выборке - средняя длительность безрецидивного периода по составила 40,09±1,67 месяца. Следует отметить, что при сравнении данного показателя обеих выборок была выявлена статистически достоверное превышение сроков безрецидивного периода по объектам второй выборки (t=10,150;n=171; р<0,001).
Достоверно чаще случаи летального исхода пациентов по нашей выборке приходились на 2008 год – 23 (30,26±5,30%) случая (χ²=22,132; n=1; р<0,001), по остальным годам картина была следующей: на 2006 год пришлось 5 (6,58±2,80%), 2007 год – 9 (11,84±3,70%), 2009 год – 19 (25,00±5,00%) и 2010 год – 20 (26,32±5,10%) случаев. Среди непосредственных причин летального исхода в анализируемой выборке достоверно чаще встречалось прогрессирование меланомы кожи в 71 (93,42±2,80%) случае (χ²=111,184;n=1; р<0,001). На другие причины летального исхода, в частности тяжелую сердечно-сосудистую патологию, печеночную недостаточность и т.д. пришлось 5 (6,58±2,80%) случаев.
При изучении показателя пятилетней выживаемости пациентов, впервые вставших на учет в ГУЗ РКОД МЗ УР в 2006-ом году, по обеим выборкам при использовании метода Каплан-Мейера была выстроена кривая выживаемости у этой группы пациентов. Показатель пятилетней выживаемости составил 50,00±6,20%, с медианой выживаемости 3 года.
ВЫВОДЫ.
Исходя из всего сказанного выше, злокачественная меланома кожи остается по-прежнему одной из наиболее агрессивных опухолей, первичная диагностика которых в настоящее время основывается в основном на данных первичного осмотра пациента, при этом инструментальные методы исследования используются в качестве вспомогательных методов, применяющихся, в основном, с целью исключения регионарного и отдаленного метастазирования опухолевого процесса. Основным методом лечения при меланоме кожи является хирургический, заключающийся в широком иссечении первичного пигментного образования кожи с последующей пластикой дефекта перемещенным кожным лоскутом, дополняемый при наличии метастазов в регионарные лимфатические узлы лимфодиссекцией соответствующей области. Другим методам лечения (химиотерапия, иммунотерапия, лучевая терапия), ввиду отсутствия унифицированных программ лечения и малой чувствительности к ним самой опухоли, отводится лишь вспомогательное значение. Так как применение этих методов не оказывает на течение и исход опухолевого процесса какого-либо существенного влияния.
В целом, анализируя амбулаторные карты пациентов, включенных в ту или иную группу, нами были сделаны выводы, что хирургический метод лечения, применявшийся в зависимости от стадии и распространенности опухолевого процесса в каждом конкретном случае, был вполне адекватным. Оценить адекватность применения курсов химиотерапии и иммунотерапии крайне затруднительно, так как они применялись, в основном, в качестве дополнительных к основному, хирургическому, методу лечения, чаще в сочетании друг с другом и практически не оказывали на течение и исход заболевания какого-либо существенного положительного влияния.
Следует также отметить, что показатель пятилетней выживаемости пациентов с диагнозом «меланома кожи» за анализируемый период с 2006-его по 2008-й гг. включительно по Удмуртской республике составил: в 2006-ом году – 63%, в 2007-ом – 62,5% и в 2008-ом году – 62,4%.
СПИСОК ЛИТЕРАТУРЫ
Анисимов В.В.Меланома кожи (перспективы улучшения диагностики и лечения): Автореф. дис. …д-ра.мед.наук. – Спб., 2000. – С. 3.
Барчук А.С. Хирургическое лечение меланом. Практическая онкология 2001.; 4 (8): 30-6.
Вельшер Л.З., Стаханов М.Л., Цалко С.Э. с соавт. Неинвазивная дифференциальная диагностика пигментных новообразований кожи при помощи аутофлюоресцентного исследования. // Российский онкологический журнал, №4, 2008. С. 4-6.
Галайчук I.Й. Клiнiчна онкологiя. В: Меланома шкiри. Тернопiль: Укрмедкнига, 2003: 74-91.
Георгиев Г.П. Молекулярно-генетические механизмы прогрессии опухолей // Соросовский образовательный журнал – 2000. – Т. 6, №11. С. 2-7.
Демидов Л.В., Харкевич Г.Ю. // Русский медицинский журнал – 2003. – Т.11, №11. С. 658-665.
Константинов М.М., Гершанович М.Л., Акимо М.А. и др. Открытая, несравнительная, многоцентровая оценка эффективности и безопасности Мюстофорана, цисплатина, тамоксифена при лечении диссеминированной меланомы. Результаты программы IC4-10036-46-RU. Современная онкология. 2005; 3.
Коровин С.И., Толстопятов Б.А., Паливец А.Ю. и др. Лечение больных с меланомой кожи с регионарными лимфогенными метастазами. Онкология 2004; 6 (2): 150 – 2.
Коровин С.И., Кукушкина М.Н. Адъювантная химиотерапия больных с метастазами меланомы кожи в регионарных лимфатических узлах. Онкология. Т. 9 №4. 2007. С. 377-378.
Котова О.Е. Применение аутофлюоресцентного исследования в диагностике… :Дис. … канд. мед. – М., 2007.
Кудрявцев Д.В., Кудрявцева Г.Т., Мардынский Ю.С. Адъювантная химиотерапия как компонент комплексного лечения больных меланомой кожи. // Вопросы онкологии, 2008, том 54 №2. С. 170-177.
Минимальные клинические рекомендации Европейского Общества Медицинской Онкологии (ESMO2007): англ. – М.: Изд. группа РОНЦ им. Н.Н. Блохина РАМН, 2007.
Пак Д.Д., Белова Е.А., Лазутина Т.Н. Исследование сторожевых лимфатических узлов у больных с меланомой кожи. // Российский онкологический журнал №4, 2008, с 10-17.
Сергеева Н.С., Лазутина Т.Н., с соавт. Определение белка S-100 как серологического опухолассоциируемого маркера при меланоме. // Российский онкологический журнал №4, 2008, с 19-22.
Соколов Д.В., Ворожцов Г.Н., с соавт. Комплексный метод ранней диагностики меланомы кожи. // Российский онкологический журнал, №4, 2008, с 6-9.
Федоренко З.П., Гулак Л.О. Бюллетень нацiонального канцер-реестру Украiни. Кiев, 2006; (7); 96 с.
Фрадкин С.З., Залуцкий И.В. Меланома кожи. Минск, Беларусь, 2000. 220 с.
Эскин В.Г. Регистрация двухмерного аутофлюоресцентного изображения в диагностике опухолей кожи: дис. … канд.мед.наук. – М., 2002.
Balch C.M., Buzaid A.C., Soong S.J., et al. // J. Clin. Oncol. – 2001. – Vol. 19. – P. 3635-3648.
De Marco F., Foppoli C., Coccia R., et al. Ectopic deposition of melanin pigments as detoxifying mechanism: a paradigm basal nuclei pigmentation // Biochem. Biophis. Res. Commun. 2004. – Vol. 19. – P. 631-637.
Hakansson A., Gustafsson B., Abdiu A., et al. Bcl-2 expression in metastatic malignant melanoma. Importance for the therapeutic efficacy of biochemotherapy // Cancer Immunol. Immunother. – 2003. – Vol. 52. – P. 249-254.
Liedert B., Materna V., Schadendorf D., et al. Over-expression of cMOAT (MRP 2/ABCC 2) is Associated with Decreased Formation of Platinum-DNA Adducts and Decreased G2-Arrest in Melanoma Cells Resistant to Cisplatin. // J. Invest. Dermatol. 2003.- Vol. 121. – P. 172-176.
Pagani E., Falcinelli S., Pepponi R., et al. Combined effect of temosolamide and hyperthermia on human melanoma cell growth and O6-methylguanine-DNA methyltransferase activity //Int. J. Oncol. – 2007. – Vol. 30. – P. 443-451.
Soder S., Oliveira A.M., et al. // Pathology. – 2006. – Vol. 1,N 1. – P.35-38.
Verma S., Quirt I., et al. Systematic review of systematic adjuvant therapy for patients at high risk for recurrent melanoma. // Cancer (philad.). – 2006. – Vol. 106. – P. 1431-1442.
