
get_2 физика
.pdf
Подставляя в (4) выражения (5), (6) и (7), находим окончательно:
|
|
1 |
|
|
|
|
|
|
pd 2 p |
|
|
|
|
|
2pd 2 p2V |
|
|
|
|||||||
|
|
8RT (pM ) |
2 |
|
p |
|
|
|
|
|
|
||||||||||||||
Z = |
|
|
|
|
V |
= |
|
RT |
. |
||||||||||||||||
2 |
|
|
|
|
|
kT |
|
|
kT |
|
k 2T 2 |
|
|
pM |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
Подставляя числовые значения в (3) и (8), получим |
|||||||||||||||||||||||||
|
|
2 × 3,14 × (2,9 ×10−10 )2 (1,0 ×105 )2 2,0 ×10−3 |
|
||||||||||||||||||||||
Z = |
|
8,31× 300 |
|||||||||||||||||||||||
|
|
|
|
|
|
|
(1,38 ×10−23 )2 (300)2 |
|
|
|
|
|
3,14 × 32 ×10−3 |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
= 9,0 ×1028 с-1, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
l = |
|
|
|
|
|
1,38 ×10−23 |
× 300 |
|
|
|
= 3,56 ×10 |
|
−8 м. |
|
|
||||||||||
|
|
|
|
|
× 3,14 × |
(2,9 ×10 |
−10 )2 |
1,0 ×105 |
|
|
|
|
|||||||||||||
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
||||||||||||
Ответ: Z = 9,0 ×1028 с-1, l |
|
= 3,56 ×10−8 м. |
|
|
|
|
|
||||||||||||||||||
(8)
=
Пример 9. Определить коэффициенты диффузии и внутреннего трения азота, находящегося при температуре 300 К и давлении 1,0 кПа.
Дано:
r0 =1,25 кг/м3,
M = 28 ×10−3 кг/моль,
T = 300 К,
p =1,0 кПа =1,0 ×105 Па, d = 3,1×10−10 м.
Найти: D , η .
Решение. Коэффициент диффузии определяется из соотно-
шения [12.7]: |
|
D = (1/ 3) u l , |
(1) |
где u – средняя арифметическая скорость молекул, |
равная |
[10.5]: |
|
131 |
|
u = |
|
8RT |
|
, |
(2) |
|
pM |
||||||
|
|
|
|
|
 l
l – средняя длина свободного пробега молекул.
– средняя длина свободного пробега молекул.
Для |
нахождения l |
воспользуемся соотношением (3) из |
||||
примера 8: |
|
|||||
l = |
|
|
kT |
|
||
|
|
|
|
. |
(3) |
|
|
|
|
pd 2 p |
|||
|
|
2 |
||||
Подставляя (2) и (3) в соотношение (1), получим выражение для коэффициента диффузии:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
D = |
1 |
|
8RT kT |
|
|
= |
2kT |
|
|
RT |
. |
(4) |
||||
3 |
|
pM |
|
|
|
|
|
|
p 2 |
|
|
|||||
|
|
|
|
2pd |
2 |
p |
p |
|
pM |
|
||||||
|
|
|
|
|
|
|
3 d |
|
|
|
|
|||||
Коэффициент внутреннего трения определяется из соотноше-
ния [12.9]:
h = (1/ 3) u l r , |
(5) |
где ρ – плотность газа при температуре 300 К и давлении 105 Па.
Для нахождения плотности воспользуемся уравнением состояния идеального газа [9.3]. Запишем его для двух состояний азота – при
нормальных |
условиях |
(T = 273 К, |
p |
0 |
=1,01×105 |
Па) и условиях |
||||||
задачи: |
|
|
|
|
|
0 |
|
|
|
|
||
|
|
|
m |
|
|
m |
|
|
|
|
|
|
p |
V |
0 |
= |
RT , pV = |
RT . |
|
|
|
(6) |
|||
|
|
|
|
|
||||||||
0 |
|
|
M |
0 |
|
M |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|||
Учитывая, что r0 |
= m V0 (плотность азота при нормальных |
|||||||||||
условиях, см. в приложении табл. 5), r = m V , имеем:
V , имеем:
r = |
r0 pT |
. |
(7) |
|
|||
|
p0T |
|
|
Коэффициент внутреннего трения газа может быть выражен через коэффициент диффузии (см. (1) и (5)):
h = Dr = D |
r0 pT |
. |
(8) |
|
|||
|
p0T |
|
|
Подставляя числовые значения в (4) и (8), получим:
132

2 ×1,38 ×10 |
−23 × 300 |
|
|
8,31× 300 |
|
|
×10−5 м2/с, |
|||
D = |
|
|
|
|
|
|
= 4,7 |
|||
3 × 3,14 × 3,12 ×10−20 ×1,0 ×105 |
3,14 × 28 ×10−3 |
|||||||||
h = 4,7 ×10−5 ×1,25 × |
1,0 ×105 × 273 |
|
= |
5,23 ×10−5 Па×с. |
|
|||||
1,01×105 × 300 |
|
|
||||||||
|
|
|
|
|
|
|
|
|
||
Ответ: D = 4,7 ×10 |
−5 м2/с, h = 5,23 |
×10−5 Па×с. |
|
|
|
|||||
Пример 10. Кислород массой 160 г нагревают при постоянном давлении от 320 до 340 К. Определить количество теплоты, поглощенное газом, изменение внутренней энергии и работу расширения газа.
Дано:
m = 160 г = 0,16 кг,
T1 = 320 К,
T2 = 340 К.
Найти: Q , U , A .
Решение. Количество теплоты, необходимое для нагревания газа при постоянном давлении [13.7]:
Q = mc p (T2 - T1 )= Mm Cμp (T2 - T1 ), (1)
где c p и Cμp = Mcp – удельная и молярная теплоемкости газа при
постоянном давлении соответственно; M = 32 ×10−3 кг/моль – молярная масса кислорода. Для всех двухатомных газов число степе-
ней |
свободы |
i = 5 , тогда молярная |
теплоемкость равна [13.10] |
||||
Cμp |
= |
i + 2 |
R = |
|
7 |
R или численно Cμp |
= 29,09 Дж/(моль×К). |
|
2 |
||||||
|
2 |
|
|
|
|||
Внутренняя энергия идеального газа определяется выражением [13.1], тогда изменение внутренней энергии газа находим из соотношения:
DU = |
m |
C |
μV |
(T - T ), |
(2) |
|
|||||
|
M |
2 1 |
|
||
|
|
|
|
||
|
|
|
|
|
133 |
где CμV – молярная теплоемкость газа при постоянном объеме. Для всех двухатомных газов молярная теплоемкость при постоян-
ном |
объеме |
равна |
CμV = |
i |
R = |
5 |
R |
или |
численно |
|
|
||||||||
CμV |
= 20,78 Дж/(моль×К). |
2 |
2 |
|
|
|
|||
|
|
|
|
|
|
|
|||
|
Работа расширения |
газа при |
изобарном |
процессе [13.13] |
|||||
A = p V , где DV = V2 -V1 |
– изменение объема газа, которое мож- |
||||||||
но найти из уравнения Менделеева–Клапейрона [9.3]. При изобарном процессе:
pV = |
|
|
m |
|
RT , |
|
(3) |
||||||||
|
|
|
|
||||||||||||
1 |
|
|
|
M |
|
1 |
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|||||
pV |
2 |
|
= |
|
m |
RT . |
|
(4) |
|||||||
|
|
|
|
||||||||||||
|
|
|
|
|
M |
|
2 |
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Вычитая (4) из (3), находим: |
|||||||||||||||
p(V |
2 |
-V )= |
|
m |
R(T - T ). |
||||||||||
|
|
||||||||||||||
|
|
1 |
|
|
|
M |
2 |
1 |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Следовательно, выражение для работы примет окончатель- |
|||||||||||||||
ный вид: |
|
m |
|
|
|
|
|
|
|
|
|
||||
A = |
|
|
R(T |
2 |
|
- T ). |
|
(5) |
|||||||
|
|
|
|
|
|||||||||||
|
|
|
M |
1 |
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|||||||
Подставляя числовые значения в соотношения (1), (2) и (5), получаем:
Q= 16 ×10−2 29,09 × (340 - 320)= 2909 Дж, 32 ×10−3
DU = 16 ×10−2 20,78 × (340 - 320)= 2078 Дж, 32 ×10−3
A= 16 ×10−2 8,31× (340 - 320)= 831 Дж. 32 ×10−3
Согласно первому началу термодинамики [13.2]:
Q = U + A .
Подставляя полученные значения количества теплоты, изме-
134
нения внутренней энергии, работы, убеждаемся, что величины определены верно:
2909 Дж = 2078 Дж + 831 Дж.
Ответ: Q = 2909 Дж, U = 2078 Дж, A = 831Дж.
Пример 11. Объем аргона, находящегося под давлением 80 кПа, увеличился от 1,0 до 2,0 л. На сколько изменится внутренняя энергия газа, если расширение производилось: а) изобарно; б) адиабатно.
Дано:
V1 =1,0 л =1,0 ×10−3 м3, V2 = 2,0 л = 2,0 ×10−3 м3, p = 0,80 ×105 Па,
M= 40 ×10−3 кг/моль,
i= 3,0 .
Найти: U .
Решение. Согласно первому началу термодинамики, количество теплоты Q , переданное системе, расходуется на увеличение
внутренней энергии |
U и на механическую работу, совершенную |
||||||||||||||
системой A [13.2]: |
|
|
|
|
|
|
|
||||||||
Q = U + A . |
|
|
|
|
|
|
(1) |
||||||||
Так как внутренняя энергия идеального газа [13.1]: |
|||||||||||||||
U = |
i |
|
|
m |
RT , то ее изменение: |
|
|||||||||
2 M |
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||
DU = |
i |
|
m |
RDT = |
i |
|
m |
R(T |
- T ), |
(2) |
|||||
|
|
|
|
||||||||||||
|
|
|
2 M |
|
2 M |
2 |
1 |
|
|||||||
где i – число степеней свободы молекулы, |
M – молярная масса |
||||||||||||||
газа, R – универсальная газовая постоянная. |
|
||||||||||||||
Найти |
U для аргона по формуле (2) нельзя, так как масса |
||||||||||||||
газа и температура в условии задачи не даны. Поэтому необходимо провести преобразование выражения (2).
135

Для этого запишем уравнение Менделеева–Клапейрона [9.3] для начального и конечного состояний газа:
pV1 = Mm RT1 и pV2 = Mm RT2
или |
|
|
|
|
|
m |
|
|
|
|
|
p(V |
2 |
-V )= |
R(T |
- T ). |
(3) |
||||||
|
|||||||||||
|
1 |
|
M |
2 |
1 |
|
|||||
|
|
|
|
|
|
|
|
|
|||
Подставив (3) в выражение (2), получим для изменения внут- |
|||||||||||
ренней энергии соотношение: |
|
||||||||||
DU = |
i |
p(V |
2 |
-V ), |
|
|
(4) |
||||
|
|
|
|||||||||
|
|
2 |
|
1 |
|
|
|
||||
|
|
|
|
|
|
|
|
U при изобарном |
|||
которое является расчетным для определения |
|||||||||||
расширении. |
|
|
|
|
|
|
|||||
При адиабатном расширении газа теплообмен с внешней сре-
дой не происходит, поэтому Q = 0 . |
Выражение первого начала |
термодинамики (1) запишется в виде: |
|
U + A = 0 . |
(5) |
Это соотношение устанавливает, что работа расширения газа может быть произведена только за счет уменьшения внутренней
энергии газа (знак минус перед |
U ): |
|||||||||||
A = − U . |
|
|
|
|
|
|
|
(6) |
||||
Выражение для нахождения работы газа при адиабатном про- |
||||||||||||
цессе имеет вид: |
|
|
|
|
|
|
|
|
||||
|
m RT1 |
é |
æ |
|
ö |
γ−1 |
ù |
|
|
|||
|
ê |
|
|
ú |
|
|
||||||
A = |
ç V1 |
÷ |
|
|
|
|||||||
|
|
|
|
1 |
- ç |
|
÷ |
|
|
, |
(7) |
|
M g -1 |
|
|
|
|||||||||
|
ê |
èV2 |
ø |
|
ú |
|
|
|||||
|
|
|
|
|
ë |
|
|
|
|
û |
|
|
где γ |
– показатель адиабаты, равный отношению теплоемкостей |
||||||
[13.5]: |
g = |
C p |
= |
i + 2 |
. Для аргона (как одноатомного газа) i = 3 |
, |
|
C |
i |
||||||
|
|
|
|
|
|||
|
|
V |
|
|
|
|
|
тогда γ =1,67 .
Находим изменение внутренней энергии при адиабатном процессе для аргона, учитывая соотношения (6) и (7):
136

|
m |
|
RT1 |
|
éæ |
V1 |
öγ−1 |
ù |
|
|
DU = |
|
|
êç |
÷ |
ú |
(8) |
||||
|
|
|
||||||||
M g -1 |
ç |
|
÷ |
-1 . |
||||||
|
êèV2 |
ø |
ú |
|
||||||
|
|
|
|
|
ë |
|
|
û |
|
|
Для определения работы расширения аргона соотношение (8) следует преобразовать, учитывая при этом параметры, заданные в условии задачи. Применив уравнение Менделеева–Клапейрона для
данного случая p1V1 = Mm RT1 , получим выражение для расчета изменения внутренней энергии:
|
p1V1 |
éæ |
V1 |
|
öγ−1 |
|
ù |
|
|
|
|
|
|
|
|||
DU = |
êç |
|
÷ |
|
ú |
|
|
|
|
|
|
(9) |
|||||
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
ç |
|
÷ |
-1 . |
|
|
|
|
|
|
||||||
|
g -1 |
êèV2 |
ø |
|
ú |
|
|
|
|
|
|
|
|||||
|
|
|
ë |
|
|
|
|
|
û |
|
|
|
|
|
|
|
|
Подставляя числовые значения в (4) и (9), получим: |
|||||||||||||||||
а) при изобарном расширении: |
|
|
|
|
|
||||||||||||
DU = |
3 |
0,8 ×105 |
×10−3 |
=1,2 ×102 Дж; |
|
|
|
|
|||||||||
2 |
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
б) при адиабатном расширении: |
|
ö1,67−1 |
|
|
|
||||||||||||
|
0,8 ×10 |
5 |
×1,0 ×10 |
−3 éæ |
1,0 ×10 |
−3 |
|
ù |
|
||||||||
DU = |
|
êç |
|
÷ |
- |
ú |
= -44,6 Дж. |
||||||||||
|
|
|
|
|
|
|
|
|
ç |
|
|
|
÷ |
1 |
|||
|
|
1,67 |
-1 |
|
|
2,0 × |
10 |
−3 |
|||||||||
|
|
|
|
êè |
|
ø |
|
ú |
|
||||||||
|
|
|
|
|
|
|
|
|
ë |
|
|
|
|
|
û |
|
|
Ответ: а) DU =1,2 ×102 Дж; б) |
|
U = −44,6 Дж. |
|||||||||||||||
Пример 12. Температура нагревателя тепловой машины 500 К. Температура холодильника 400 К. Определить КПД тепловой машины, работающей по циклу Карно, и полную мощность машины, если нагреватель ежесекундно передает ей 1,68 кДж теплоты.
Дано:
T = 500 К,
T0 = 400 К,
Q =1,68 ×102 Дж.
Найти: η , N .
137

Решение. КПД машины определяется из соотношения [14.1; 14.3]:
h = |
T - T0 |
или h = |
A |
, |
(1) |
|
T |
Q |
|||||
|
|
|
|
|||
где A – |
работа цикла, |
Q – количество теплоты, |
подведенное к |
|||
системе. Из выражений (1) находим, что:
A = hQ = T - T0 Q . T
Произведя вычисления, получим:
A = 500 - 400 1,68 ×102 = 335 Дж. 500
Эта работа совершается за 1,0 с. Полная мощность машины определяется выражением:
N = At , следовательно, N = 335 Вт.
Ответ: η = 0,20 , N = 335 Вт.
Пример 13. Рабочим телом в цикле Карно является воздух, масса которого 7,25 кг. Состояние 1 характеризуется давлением
2,1×106 Па и температурой 505,4 К, а состояние 3 – давлением
2,67 ×104 Па и температурой 252,7 К. Определите полезную работу, совершаемую за один цикл, изменения энтропии нагревателя и холодильника, коэффициент полезного действия.
Дано:
m = 7,25 кг,
p1 = 2,1×106 Па, p3 = 2,67 ×104 Па,
T1 = 505,4 К,
T3 = 252,7 К,
M = 2,9 ×10−2 кг/моль.
Найти: A , DSнагр , DS хол , η .
138
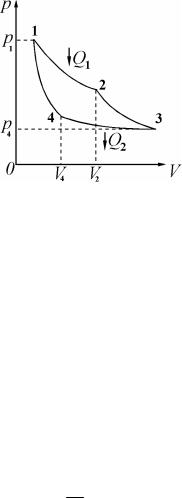
Решение. Цикл Карно – квазистатический процесс, в котором систему приводят в тепловой контакт с нагревателем и холодильником, имеющим постоянные температуры T1 и T3 . Работа, со-
вершаемая рабочим телом в тепловой машине, определяется вы-
ражением [14.1; 14.2]:
A = |
|
Q1 |
|
- |
|
Q2 |
|
, |
(1) |
|
|
|
|
где Q1 – количество теплоты, полученное рабочим телом от нагревателя, Q2 – количество тепло-
ты, отданное холодильнику. Проанализируем работу ма-
шины по циклу Карно.
Участок 1-2 (изотермическое расширение U = 0 ). Рабочее тело получает количество теплоты [13.2; 13.14]:
Рис. 2.11 |
Q = |
m |
RT ln |
V2 |
. |
(2) |
|
|
|
||||
|
1 |
M |
1 |
V1 |
|
|
|
|
|
|
|||
Участок 3-4 (изотермическое сжатие). Рабочее тело отдает количество теплоты:
Q |
2 |
= |
m |
RT ln |
V4 |
. |
(3) |
|
|
||||||
|
|
M |
3 |
V3 |
|
||
|
|
|
|
|
|||
На участках 2-3 (адиабатное расширение) и 4-1 (адиабатное сжатие) теплота к рабочему телу не подводится и не отводится от него. Следовательно, работа газа за цикл с учетом (1), (2) и (3):
|
m |
æ |
|
|
V |
2 |
|
|
V |
3 |
|
|
ö |
|
|
|
|
|
|
||||||||
A = |
|
RçT |
ln |
|
- T |
ln |
|
|
|
÷ . |
|||
M |
V |
V |
|
||||||||||
|
ç |
1 |
|
3 |
|
|
|
|
÷ |
||||
|
|
è |
|
|
|
1 |
|
|
|
4 |
|
|
ø |
|
|
|
|
|
|
|
|
|
|||||
Рассмотрим состояние газа в узловых точках.
Для состояний 1 и 3 заданы два параметра – давление и температура. Используя уравнение состояния газа Менделеева– Клапейрона [9.3], получим:
pV = Mm RT ,
находим:
139

|
|
m |
|
RT1 |
|
7,25 × 8,31× 505,4 |
|
3 |
||||||||
V |
= |
|
|
|
= |
|
|
|
|
|
|
|
|
|
= 0,50 |
м . |
M |
|
p |
|
× |
|
|
× |
|
× |
|
|
|||||
1 |
|
|
|
2,9 |
10 |
−2 |
2,1 |
10 |
6 |
|
|
|||||
|
|
|
1 |
|
|
|
|
|
|
|
|
|||||
Аналогично вычислим V2 =19,8 м3.
Используя уравнения Пуассона [13.18] для процессов 2-3 и 4- 1, получаем:
T1V2γ−1 = T3V3γ−1 ,
T3V4γ−1 = T1V1γ−1 ,
откуда:
|
V4 |
= |
V2 |
, |
(4) |
|
V |
V |
|||||
|
|
|
|
|||
3 |
1 |
|
|
|||
а с учетом того, что показатель адиабаты γ =1,4 (воздух считаем двухатомным газом), получим:
|
|
|
1 |
|
|
|
1 |
|
|
|
æ T |
ö |
γ−1 |
æ |
252,7К ö |
|
|
||
|
1,4−1 |
3 |
|||||||
V2 |
ç |
3 |
÷ |
|
|
|
|
|
|
|
=19,8 × ç |
505,4К |
÷ |
|
= 3,5 м . |
||||
=V3 ç T |
÷ |
|
|
||||||
|
è 1 |
ø |
|
è |
|
ø |
|
|
|
Аналогично вычисляем V4 = 2,83 м3.
Подставляя значения всех величин в (2), вычисляем работу:
|
7,25 |
|
æ |
|
|
|
|
3,5 |
|
|
|
|
2,83 |
|
|
ö |
|
|
6 Дж. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
A = |
|
8,31× ç |
505,4 |
× |
|
ln |
- 252,7 × |
|
ln |
|
|
÷ |
=1,02 |
×10 |
|
|||||
|
−3 |
|
|
|
||||||||||||||||
|
29 ×10 |
ç |
|
|
|
0,5 |
|
|
|
19,8 |
|
|
÷ |
|
|
|
|
|||
|
|
è |
|
|
|
|
|
|
|
|
ø |
|
|
Q = 0 |
, |
|||||
|
|
|
|
|
|
|
|
|
||||||||||||
Процессы |
2-3 и 4-1 |
являются |
изоэнтропийными |
( |
||||||||||||||||
S = const ). Изменение энтропии нагревателя равно по модулю и противоположно по знаку изменению энтропии газа при изотермическом процессе 1-2.
Изменение энтропии согласно [15.4; 13.2]:
2 |
dQ |
2 |
dU + pdV |
2 |
dU |
2 |
pdV |
|
|
DS = ò |
|
= ò |
|
= ò |
|
+ ò |
|
. |
|
T |
T |
T |
T |
||||||
1 |
1 |
1 |
1 |
|
Так как внутренняя энергия газа при изотермическом процессе не изменяется, то, с учетом уравнения Менделеева-Клапейрона
[9.3] p = nVRT , изменение энтропии определяется из выражения:
140
