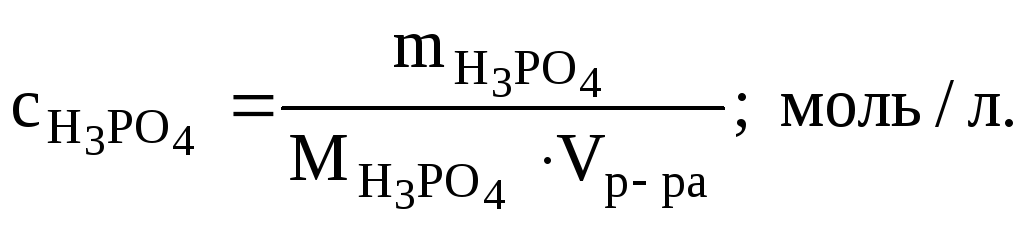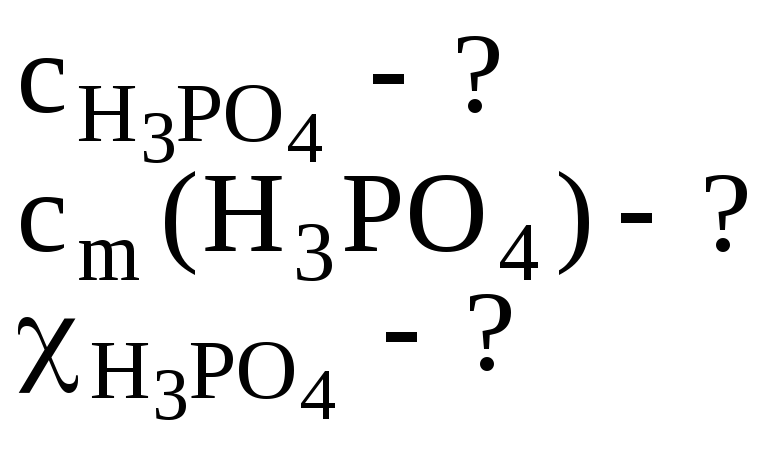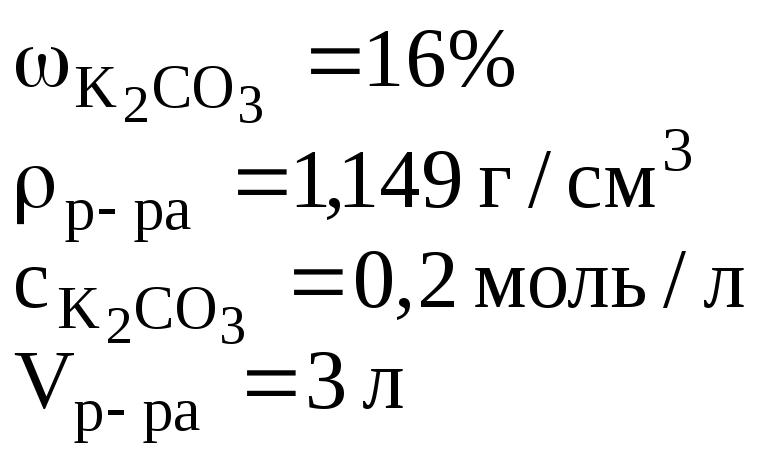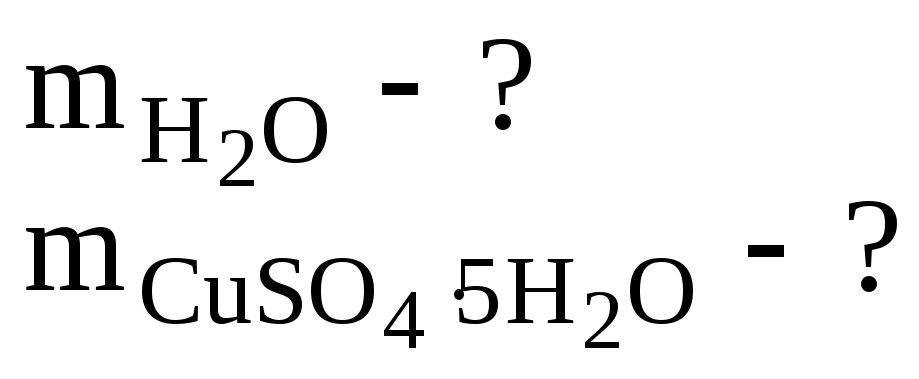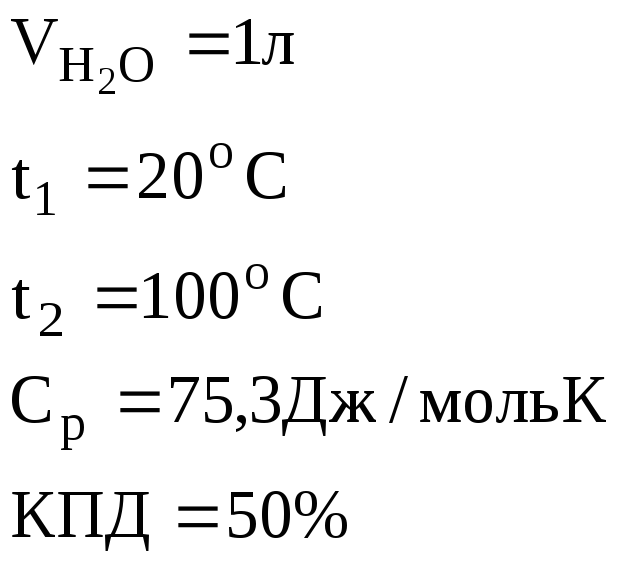- •Уровень в
- •2. Эквивалент. Закон эквивалентов уровень в
- •3. Способы выражения состава раствора уровень b
- •1. Плотность 6% водного раствора ортофосфорной кислоты равна 1,031 г/см3. Рассчитать:
- •2. Определить объем 16%-ного раствора карбоната калия плотностью 1,149 г/см3, необходимого для приготовления 3 л 0,2 м водного раствора данного вещества. Пояснить процесс приготовления раствора.
- •4. Энергетика химических реакций уровень b
- •3. Рассчитать теплотворную способность каменного угля, если известно, что в нем содержится 80% углерода, а в отходящих газах после сгорания угля содержится 14% со2 и 2% со по объему.
- •5. Скорость химических реакций и химическое равновесие уровень в
- •6. Физико-химические свойства растворов уровень в
- •3. Определить кажущуюся степень диссоциации соли, если водный раствор хлорида алюминия с массовой долей 1,5% кристаллизуется (замерзает) при температуре (-0,690с).
- •7. Растворы сильных и слабых электролитов. Уровень в
- •2. Определить, образуется ли осадок, если смешали 100 см0,01м водного раствора хлорида кальция и 200 см0,02м водного раствора карбоната натрия.
- •3.Вычислить рН 0,0im водного раствора hno2, содержащего, кроме того, 0,02 моль/л kno2.
- •8. Гидролиз солей уровень в
- •9. Окислительно - восстановительные реакции (овр) уровень в
- •1. Уравнять реакцию. Указать окислитель и восстановитель.
- •4 Г брома.
- •2. Уравнять реакцию. Указать окислитель и восстановитель:
- •3. Определить направление протекания реакции:
- •10. Гальванические элементы коррозия металлов. Уровень в
- •11. Электролиз растворов
- •Уровень в
- •12. Получение и химические свойства металлов уровень в
3. Способы выражения состава раствора уровень b
1. Плотность 6% водного раствора ортофосфорной кислоты равна 1,031 г/см3. Рассчитать:
а) молярную концентрацию ;
б) моляльность;
в) молярную долю кислоты в растворе.
|
Дано:
|
РЕШЕНИЕ: а) Молярную концентрацию кислоты определяем по формуле:
|
|
|
Согласно условию задачи в 100 г раствора содержится 6 г
Н3РО4. Тогда 6 г Н3РО4 содержится в объеме раствора
![]() ;
;
![]() =
1·3 +31+16·4
=98 г/моль
=
1·3 +31+16·4
=98 г/моль
Следовательно,
![]() ,
,
где 10-3 - пересчет см3 в л.
б) моляльность кислоты в растворе определяем по формуле:
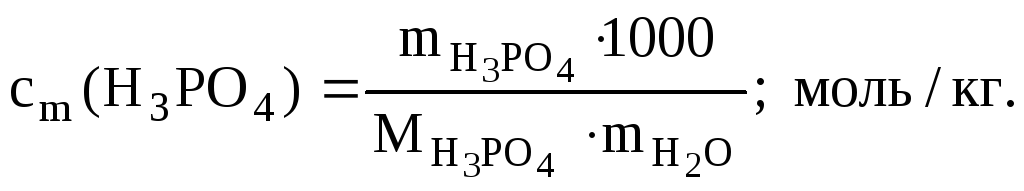
![]()
Тогда
![]()
где 1000 - коэффициент пересчета г в кг.
в) молярную долю кислоты определяют по формуле:
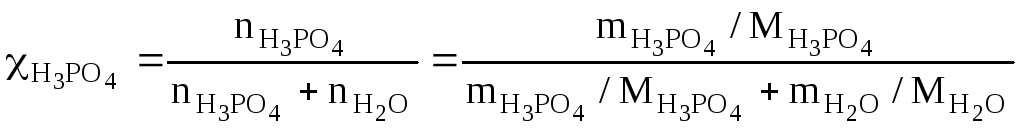 =
=
=
=![]() =
0,011
=
0,011
![]()
![]()
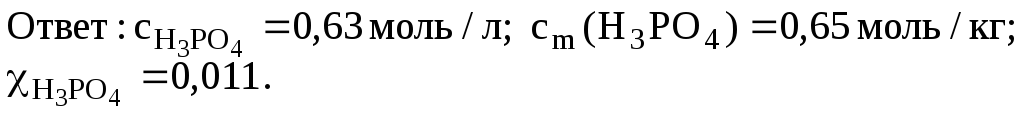
2. Определить объем 16%-ного раствора карбоната калия плотностью 1,149 г/см3, необходимого для приготовления 3 л 0,2 м водного раствора данного вещества. Пояснить процесс приготовления раствора.
|
Дано:
|
РЕШЕНИЕ: а) Молярную концентрацию карбоната калия определяем по формуле:
|
|
|
Следовательно:
![]()
![]()
![]() =
2·39 + 12 +16·3 =138 г/моль
=
2·39 + 12 +16·3 =138 г/моль
![]()
Рассчитываем массу 16%-ного раствора К2СО3, который содержит 82,8 г К2СО3.
Составляем пропорцию:
100 г р-ра - 16 г К2СО3
mр-ра(16%) - 82,8 г К2СО3.
mр-ра(16%)
=
![]() 517,5
г,
517,5
г,
Определим объём 16% - ного раствора:
![]() 450,4
см3
450,4
см3
Ответ: для приготовления 3 л 0,2 М раствора К2СО3 нужно взять 450,4 мл 16%-ного раствора К2СО3 и разбавить его водой до 3 л.
Найти массы воды и кристаллогидрата CuSO4·5H2O, необходимые для приготовления 2 литра раствора, содержащего 8% мас. безводной соли. Плотность 8%-го раствора CuSO4 равна 1,084 г/см3.
|
Дано: Vр-ра = 2 л
ω ρр-ра= 1,084 г/см3 |
РЕШЕНИЕ Массу безводной соли (CuSO4), необходимую для приготовления заданного раствора определяем из формулы:
ω
|
|
|
откуда
![]()
Масса раствора равна
![]()
![]() ,
где 103
коэффициент перевода л в см3.
Тогда масса CuSO4
в растворе составляет:
,
где 103
коэффициент перевода л в см3.
Тогда масса CuSO4
в растворе составляет:
![]() ,
,
Массу CuSO4·5H2O, содержащую 86,7 г CuSO4, определяем из пропорции:
![]() 250
г/моль -160 г/моль
250
г/моль -160 г/моль
![]()
![]() -
173,4 г
-
173,4 г
где
![]() =
64+32+16·4=160 г/моль
=
64+32+16·4=160 г/моль
![]() =
64+32+16·4 +5·(1·2+16)=250 г/моль
=
64+32+16·4 +5·(1·2+16)=250 г/моль
Тогда
![]()
Зная массу раствора и кристаллогидрата, определяем массу воды, необходимую для приготовления заданного раствора:
![]()
Ответ:
![]()
4. Энергетика химических реакций уровень b
1. Найти массу метана (СН4), при полном сгорании которого до СО2(г) и Н2О(г) в тепловом агрегате выделяется теплота, достаточная для нагревания 1 л воды от 20 до 100оС. Мольную теплоемкость воды принять равной 75,3 Дж/моль·К. КПД теплового агрегата составляет 50%.
|
Дано:
|
|
|
Количество теплоты, необходимое
для нагревания 1 л (1000 г) воды от
20 до 100оС определяем по формуле:
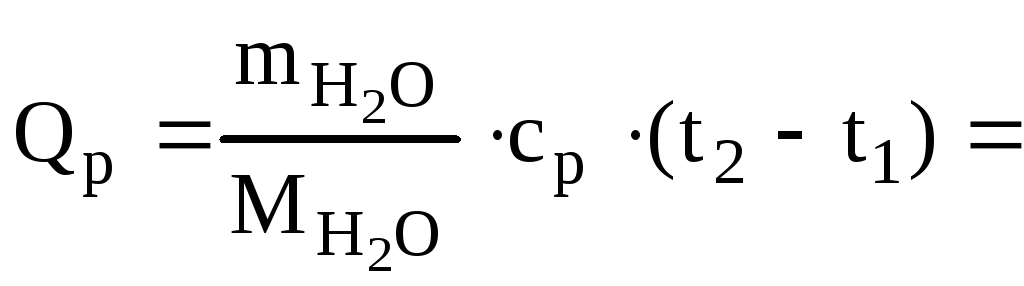
![]()
=
![]()
= 334666,7 Дж = 334,7 кДж
Определим массу метана при горении, которого выделяется такое количество теплоты. Процесс горения метана по условию задачи описывается уравнением:
СН4(г) + 2О2(г) = СО2(г) + 2Н2О(г)
Тепловой эффект этой реакции Dr.Ho(298K) определяем по I следствию из закона Гесса
Dr.Ho(298K) = Df.Ho(298K,CO2(г)) + 2Df.Ho(298K, Н2О(г)) -
- Df.Ho(298K, CН4(г)) - 2Df.Ho(298K, О2(г)) = (-393,5) + 2(-241,8) –
- (-74,9) = - 802,2 кДж
![]()
Таким образом при сгорании 16 г метана выделяется 802,2 кДж тепла. Определяем массу метана, при сгорании которой выделяется 334,7 кДж теплоты. Составляем пропорцию:
16 г СН4 ― 802,2 кДж
![]() ―334,7
кДж
―334,7
кДж
![]() г
г
С учетом КПД теплового агрегата масса метана составляет
![]() г
г
Ответ: масса метана составляет 13,34 г.
Используя справочные данные по DfHo(298K, В) и So(298K, В), определить при каких температурных условиях возможно самопроизвольное протекание реакции
Fe2O3(к) + 3Н2(г) = 2Fe(к) + 3Н2O(г)
|
Дано: Уравнения реакции
|
|
DrGо(298К)-? условия протекания реакции - ? |
Возможность самопроизвольного протекания реакции, определяется знаком перед величиной изменения энергии Гиббса для данной реакции:
если ΔrG°(298К) < 0, самопроизвольное протекание реакции при стандартных условиях возможно в прямом направлении;
если ΔrG°(298К) > 0, то при стандартных условиях прямая реакция невозможна, а возможна обратная реакция..
Значение ΔrG°(298К) рассчитываем по формуле:
ΔrG°(298К) = ΔrН°(298К)·103 - Т ΔrS°(298К)
где ΔrН°(298К) - изменение стандартной энтальпии реакции, кДж: ΔrS°(298К) - изменение стандартной энтропии реакции, Дж/К:
103 - пересчет кДж в Дж.
Значение ΔrН°(298К) и ΔrS°(298К) определяем согласно первому следствию из закона Гесса:
ΔrН°(298К) = [2ΔfН°(298К, Fe(к)) + 3ΔfН°(298К, Н2О(г))] –
- [ΔfН°(298К, Fe2O3(к)) + 3ΔfН°(298К, Н2(г))];
ΔrS°(298К) = [2S°(298К, Fe(к)) + 3S°(298К, Н2О(г))] –
- [S°(298К, Fe2O3(к)) + 3S°(298К, Н2(г))];
где ΔfН°(298К, В) и S°(298К, В) - стандартные энтальпии образования и энтропии веществ, значения которых находим из таблицы стандартных термодинамических величин.
|
|
Fe2O3(к) + |
3Н2(г) |
= 2Fe(к) |
+ 3Н2О(г) |
|
DfHo(298K), кДж/моль |
1(-822,2) |
3(0) |
2(0) |
3(-241,84) |
|
So(298 K), Дж/(моль×К) |
1(87,4) |
3(130.5) |
2 (27.15) |
3(188,74) |
ΔrН°(298К) = [2(0) + 3(-241,84)] - [(-822,2) + 3(0)] = 96,68 кДж
ΔrS°(298К) = [2·27,15 + 3·188,74] - [87,4 + 3·130,5] = 141,62 Дж/К
тогда:
ΔrGо(Т) = 96680 - Т·141,62
Ответ: При высоких температурах значение ΔrGо(Т) < 0 и, следовательно, реакция возможна при нагреве.