
- •Уровень в
- •2. Эквивалент. Закон эквивалентов уровень в
- •3. Способы выражения состава раствора уровень b
- •1. Плотность 6% водного раствора ортофосфорной кислоты равна 1,031 г/см3. Рассчитать:
- •2. Определить объем 16%-ного раствора карбоната калия плотностью 1,149 г/см3, необходимого для приготовления 3 л 0,2 м водного раствора данного вещества. Пояснить процесс приготовления раствора.
- •4. Энергетика химических реакций уровень b
- •3. Рассчитать теплотворную способность каменного угля, если известно, что в нем содержится 80% углерода, а в отходящих газах после сгорания угля содержится 14% со2 и 2% со по объему.
- •5. Скорость химических реакций и химическое равновесие уровень в
- •6. Физико-химические свойства растворов уровень в
- •3. Определить кажущуюся степень диссоциации соли, если водный раствор хлорида алюминия с массовой долей 1,5% кристаллизуется (замерзает) при температуре (-0,690с).
- •7. Растворы сильных и слабых электролитов. Уровень в
- •2. Определить, образуется ли осадок, если смешали 100 см0,01м водного раствора хлорида кальция и 200 см0,02м водного раствора карбоната натрия.
- •3.Вычислить рН 0,0im водного раствора hno2, содержащего, кроме того, 0,02 моль/л kno2.
- •8. Гидролиз солей уровень в
- •9. Окислительно - восстановительные реакции (овр) уровень в
- •1. Уравнять реакцию. Указать окислитель и восстановитель.
- •4 Г брома.
- •2. Уравнять реакцию. Указать окислитель и восстановитель:
- •3. Определить направление протекания реакции:
- •10. Гальванические элементы коррозия металлов. Уровень в
- •11. Электролиз растворов
- •Уровень в
- •12. Получение и химические свойства металлов уровень в
2. Эквивалент. Закон эквивалентов уровень в
При растворении 16,25 г двухвалентного металла в кислоте выделилось 6,52 л водорода, собранного над водой и измеренного при температуре 298К и давлении 730 мм рт. ст. Определить молярную массу эквивалента металла и назвать металл. Давление паров воды при температуре 298К равно 23,76 мм рт. ст.
|
Дано:
В = 2
Т = 298 К
Робщ= 730
мм рт.ст
Мэк(Ме) -
?
Ме - ? |
РЕШЕНИЕ: По закону эквивалентов
Мэк(Ме)
=
|
По объединенному уравнению газового состояния
![]()
где: То = 273 К, Ро = 760 мм рт.ст.
Робщ
=
![]() +
+![]() ;
;![]() =Робщ
-
=Робщ
-
![]()
![]()
определяем
![]()
![]()
![]() =
5,55 л
=
5,55 л
Мэк(Ме)
=
![]() =32,79
г/моль
=32,79
г/моль
Мэк(Ме)
=
![]() ,
г/моль, где В – валентность металла
,
г/моль, где В – валентность металла
ММе = Мэк(Ме) ∙ В = 32,79 ∙ 2 = 65,58 г/моль, что соответствует молекулярной массе атома цинка.
Ответ: Мэк(Zn) = 32,79 г/моль, металл – Zn
При окислении металла израсходовано 3,79 л кислорода, измеренного при 293 К и давлении 740 мм рт.ст. Образовалось 39,43 г оксида. Определить молярные массы эквивалентов металла и оксида. Назвать металл.
|
Дано:
mокс.= 39,43 г
Т = 293 К
Мэк(Окс)
-?
Мэк(Ме) -
?
Ме - ? |
РЕШЕНИЕ: По закону эквивалентов nэк (окс) = nэк(О2)
Мэк(Окс)
=
|
По объединенному уравнению газового состояния
![]()
где: ТО = 273 К, РО = 760 мм рт.ст.
определяем
![]()
![]() =
=
![]() =
3,44 л.
=
3,44 л.
Мэк(Окс)
=
![]() 64,2
г/моль
64,2
г/моль
Мэк(Окс) = Мэк(Ме) + Мэк(О)
Мэк(Ме) = Мэк(Окс) - Мэк(О)
Мэк(Ме) = 64,2 – 8 = 56,2 г/моль
ММе = Мэк(Ме) ∙ В. Если В = 1, то МЭ = 56,2 г/моль. Такого металла в таблице Д.И. Менделеева нет. Если В = 2, то ММе = 112,4 г/моль. Следовательно, металл - кадмий
Ответ: Мэк(Окс) = 64,2 г/моль
Мэк(Ме) = 56,2 г/моль
Ме – Cd
3. Написать уравнения реакций взаимодействия гидроксида железа (III) с хлороводородной кислотой с образованием: а) хлорида дигидроксожелеза (III); б) хлорида гидроксожелеза (III); в) хлорида железа (III).
В каждой реакции вычислить молярную массу эквивалента гидроксида железа (III). В одной из реакций определить массу гидроксида железа (III), необходимую для взаимодействия с 3,65 г хлороводородной кислоты.
|
Дано:
Fe(OH)3
Mэк[Fe(OH)3]
- ?
|
РЕШЕНИЕ:
Мэк
(основ.) =
замещенных в данной реакции на кислотный остаток. По реакциям а), б) и в):
Определяем
|
а) HCl + Fe(OH)3 = Fe(OH)2Cl + H2O
![]() =
=
![]() = 106,8 г/моль
= 106,8 г/моль
б) 2HCl + Fe(OH)3 = FeOHCl2 + 2H2O
Mэк[Fe(OH)3]
=
![]() 53,4 г/моль
53,4 г/моль
в) 3HCl + Fe(OH)3 = FeCl3 + 3H2O
Mэк[Fe(OH)3]
=
![]() 35,6 г/моль.
35,6 г/моль.
По закону эквивалентов:
![]()
![]() ,
т.е.
,
т.е.
![]()
Откуда по реакции (в)
![]()
![]() г,
г,
где Mэк[Fe(OH)3] =35,6 г,моль
Ответ: а) Mэк[Fe(OH)3] = 106,8 г/моль
б) Mэк[Fe(OH)3] = 53,4 г/моль
в) Mэк[Fe(OH)3] = 35,6 г/моль.
![]() г.
г.


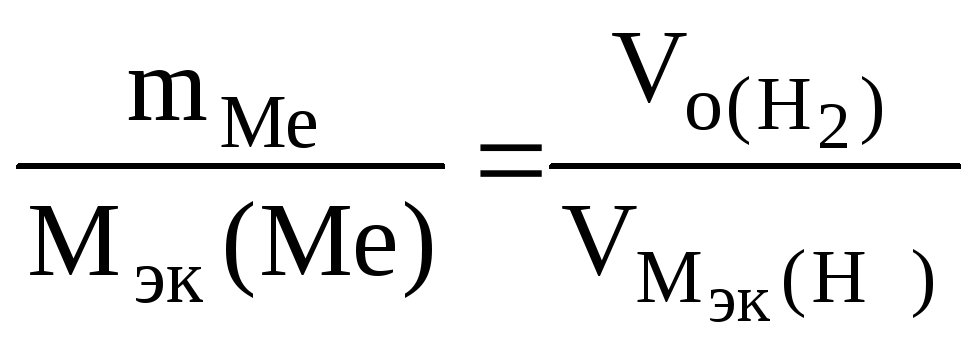
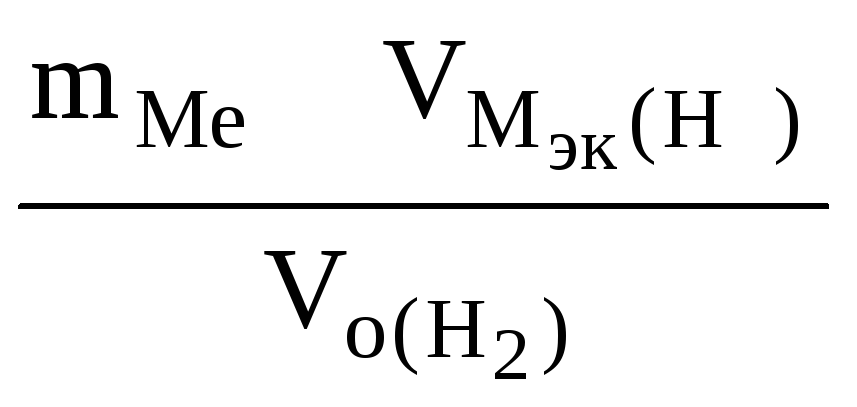 =
=

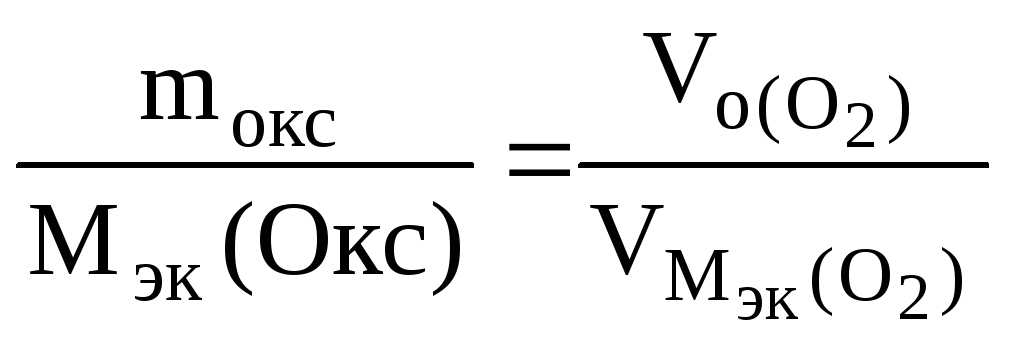
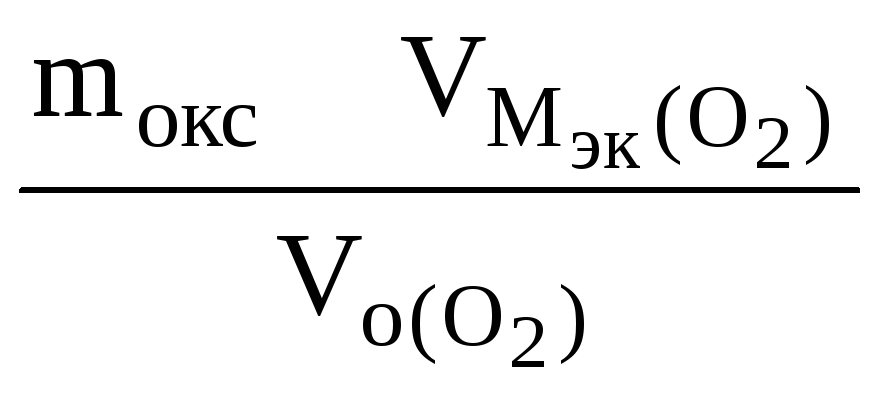

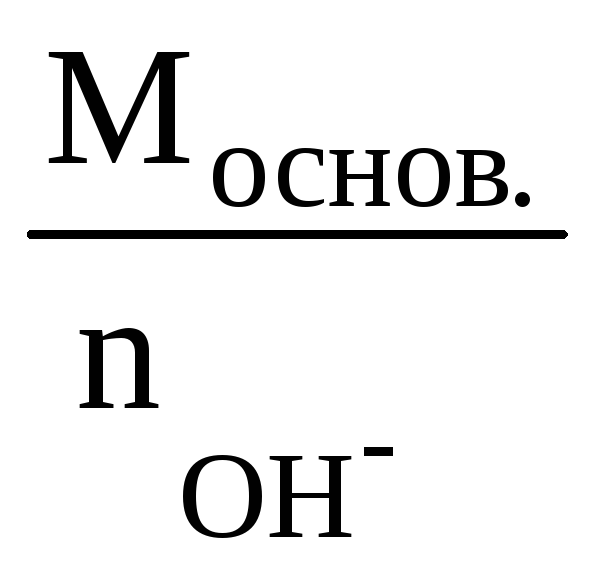 ,
г/моль
,
г/моль