
1.2.3 Химическое равновесие
Для многих химических реакций при определенных внешних условиях наступает такое состояние, когда соотношение между концентрациями продуктов реакции и исходных веществ становится постоянным. Подобное состояние соответствует состоянию устойчивого химического равновесия, а концентрации реагентов называютсяравновесными.
При достижении химически равновесного состояния число молекул веществ перестает меняться и остается постоянным во времени. Для химического равновесия характерны следующие признаки:
1) равенство скоростей прямой и обратной реакций;
2) постоянство концентраций (парциальных давлений) компонентов при постоянстве внешних условий;
3) подвижность, то есть способность самопроизвольно восстанавливаться при небольших смещениях;
4) при р, Т=const величина G достигает минимального значения (dG=0 или ΔG=0);
5) равновесие достигается как прямым, так и обратным течением реакции.
Состояние химического
равновесия характеризуется константой
химического равновесия.
Для химической
реакции aA
+ bB
![]() dD
+ eE,
протекающей в жидкой фазе
dD
+ eE,
протекающей в жидкой фазе
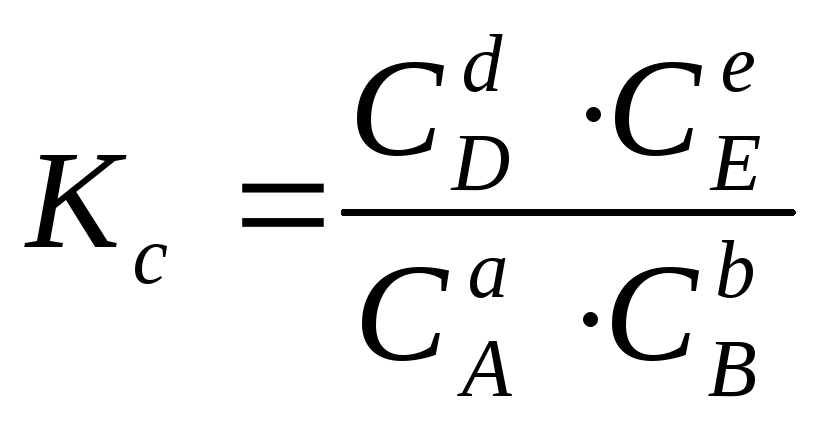 ,
,
где Kc– константа химического равновесия, выраженная через концентрации
компонентов;
![]() – концентрации компонентов, определенные
в состоянии равновесия.
– концентрации компонентов, определенные
в состоянии равновесия.
Если указанная реакция является газофазной, то вместо концентрации компонентов используют их равновесные парциальные давления:
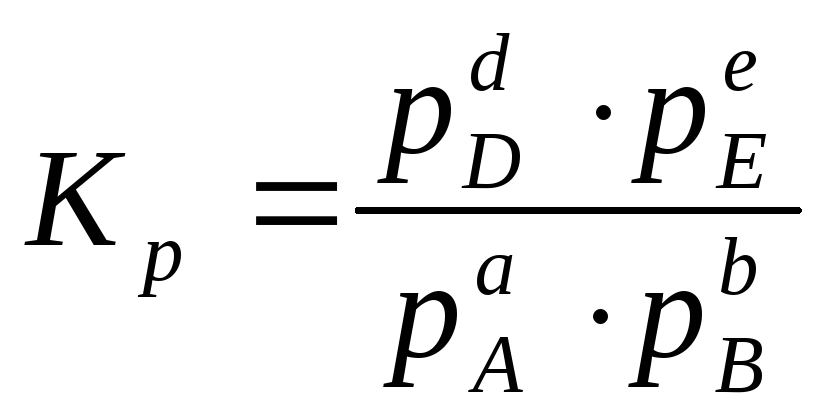
Если все реагенты газообразные и их поведение подчиняется законам идеальных газов, то связь между KpиKcможно выразить уравнением:
Kp = Kc (RT) ,
Где - изменение числа молей газов в результате реакции:
= (d + e) – (a + b).
Если изменить концентрацию хотя бы одного из компонентов равновесной системы, то концентрации всех остальных компонентов (реагентов и продуктов) будут изменяться до тех пор, пока не будут выполнены все приведенные выше5 условий. То же самое происходит, если изменить температуру. Подобные изменения свидетельствуют о подвижном характере химического равновесия. При этом говорят осмещении равновесияв сторону образования либо исходных веществ(влево), либо продуктов реакции (вправо). Суть смещения состояния равновесия заключается в том, что при изменении концентрации и температуры претерпеваютрезкие изменения скорости прямой и обратной реакций. Это нарушает условие их равенства. Изменение скоростей вызывает изменение соотношения концентраций компонентов, а это в свою очередь снова приводит к выравниваниюскоростей прямой и обратной реакций – возникает новое равновесное состояние.
Введение в систему других веществ, например, катализатора, не меняет постоянства соотношения равновесных концентраций реагентов, так как приводит к изменению в одинаковое число раз скорости прямой и обратной реакций.
Направление смещения равновесия в качественной форме определяется принципом Ле Шателье: если на систему, находящуюся в равновесии, оказывается внешнее воздействие, то равновесие смещается в том направлении, которое ослабляет влияние этого воздействия.
О влиянии изменения концентрации можно судит из уравнения изотермы химической реакции. Для приведенной выше реакции оно имеет следующий вид:
 ,
,
где
![]() – неравновесные концентрации компонентов,
моль/л;
– неравновесные концентрации компонентов,
моль/л;
![]() – разница между свободными энергиями
данного состояния и равновесного
состояния системы;
– разница между свободными энергиями
данного состояния и равновесного
состояния системы;
Т– температура системы, К;
R – универсальная газовая постоянная;
Кс– константа равновесия при данной температуре Т;
G = RTlnKc – стандартная энергия Гиббса химической реакции.
Если система находится в состоянии равновесия, то в уравнении 4.3 первый член внутри скобки становится равным lnKc и G= 0. Последний параметр являетсятермодинамическим условием состояния равновесия.
После введения в равновесную систему исходных реагентов концентрация ихвозрастает иG0, то есть смещение равновесия происходит в направлении протекания прямой реакции (слева направо). Такой же результат дает удаление из равновесной системы продуктов реакции. Последним методом смещения равновесия нередко пользуются в технологических процессах для увеличения выхода продуктов равновесных процессов.
Температура также влияет на направление смещения химического равновесия (изобара химической реакции):
 ,
,
где Н – тепловой эффект прямой реакции, Дж/моль;
R– универсальная газовая постоянная, Дж/(мольК);
K1иK2– константы равновесия данной реакционной системы при температурахТ1иТ2.
Действительно, если прямая реакция
является экзотермическим (Н0),
то повышение температуры отТ1доТ2 предполагает
образование соотношения![]() 0. Это свидетельствует о том, что в новом
равновесном состоянии концентрация
продуктов становится меньше, а исходных
больше. Следовательно, повышение
температуры приводит к смещению
равновесия в сторону обратной
эндотермической реакции (справа налево).
0. Это свидетельствует о том, что в новом
равновесном состоянии концентрация
продуктов становится меньше, а исходных
больше. Следовательно, повышение
температуры приводит к смещению
равновесия в сторону обратной
эндотермической реакции (справа налево).
Температура, при которой наступает химическое равновесие, равна:
![]()
Основной особенностью константы гетерогенного равновесия является то, что в уравнение константы гетерогенного равновесия не входят никакие члены, относящиеся к твердым веществам, участвующим в прямой и обратной реакциях. Так как прямая и обратная реакции протекают на одной же поверхности раздела фаз, то площадь поверхности раздела фаз также не входит в уравнение константы химического равновевсия.
