
Основы химической кинетики
С помощью химической термодинамики можно определить направление любой химической реакции при заданных условиях, однако она ничего не может сказать о том, осуществима ли данная реакция и за какое время она закончится. Понятие время в химию вводит химическая кинетика.
Химическая кинетикаизучает скорости химических реакций, их механизмы и закономерности протекания.
Основные различия между химической термодинамикой и кинетикой:
в химической термодинамики нет времени, она предсказывает только конечный результат процесса. Химическая кинетика изучает только изменяющиеся (динамические) системы.
Равновесные свойства определяются состоянием как исходных веществ, так и продуктов реакции. Для термодинамики важны левая и правая части химического уравнения. Скорость реакции определяется только состоянием исходных веществ. Для кинетики важна только левая часть уравнения реакции.
Термодинамические свойства определяются термодинамической активностью веществ, кинетические свойства - их концентрацией.
Скорость химической реакциив газовой фазе или растворе определяется изменением числа молекул (или числа молейn) вещества в единицу времени в единице объема:
![]() ,
,
Где «+» - скорость определяется по продукту реакции;
«-» - скорость определяется по исходному веществу;
Если реакция протекает при постоянном
объеме, то скорость выражают через
молярную концентрацию:
![]() ,
которая имеет размерность моль/л.
,
которая имеет размерность моль/л.
![]()
Для реакций, протекающих в газовой фазе, скорость реакции можно определять также через парциальные давления веществ. Скорость реакции выражают в различных единицах: моль/л с, Па/с.
Большинство химических реакций состоит из нескольких стадий, называемых элементарными реакциями. Под элементарной реакцией обычно понимают образование или разрыв химической связи, протекающий через образование переходного комплекса.
Переходный или активированный комплекс– конфигурация ядер, соответствующая переходу от реагентов к продуктам. Обычно переходному комплексу отвечает область вблизи максимума на энергетической кривой химической реакции.
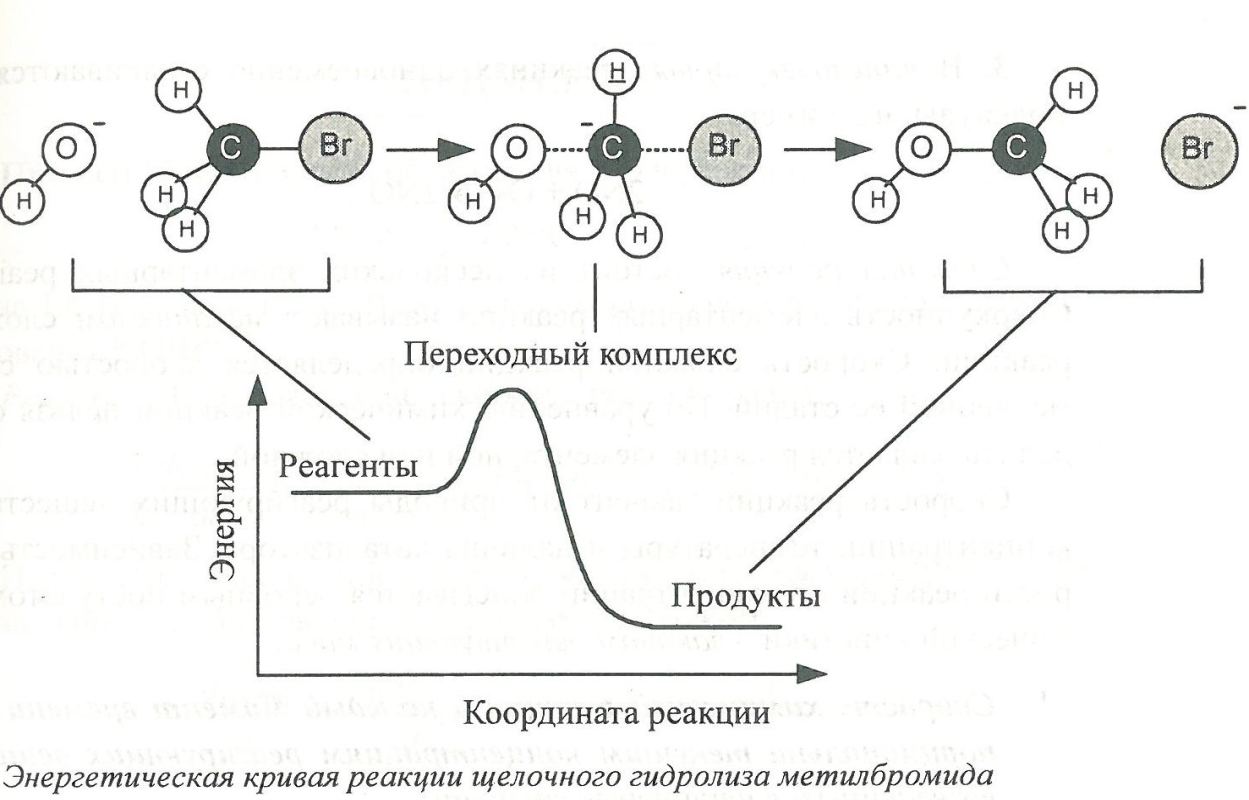
Число частиц, участвующих в элементарной реакции, называют молекулярностью реакции. Элементарные реакции бывают трех типов.
Мономолеклярные реакции– элементарные реакции распада и изомеризации, в которых участвует только одна молекула:
Разрыв связей в исходной молекуле происходит под действием света или при нагревании, например:
CH3Br
![]() CH3 +
Br.
CH3 +
Br.
В бимолекулярных реакциях происходит стокновение двух частиц:
При этом одни связи разрываются, а другие образуются, например:
H+Cl2HCl+Cl
Бимолекулярные реакции - самый распространенный тип элементарной реакции.
В тримолекулярных реакциях одновременно сталкиваются три молекулы:
2 NO+O22NO2
.
По характеру разрыва химической связи элементарные реакции подразделяются на гомолитическиеигетеролитические. В гомолитической реакции электронная пара разрывается. В гетеролитической реакции оба электрона двухэлектронной химической связи переходят к одному из атомов.
В зависимости от фазового состояния компонентов различают гомогенные и гетерогенные реакции. Гомогенные реакции – реакции, протекающие в одной фазе, к гетерогенным реакциям – реакции, протекающие на границе двух фаз.Гомофазные реакции– все компоненты находятся в одной фазе,гетерофазные реакции– компоненты реакции находятся в разных фазах.
Сложная реакциясостоит из нескольких элементарных реакций. Совокупность элементарных реакций называютмеханизмом сложной реакции. Скорость сложной реакции определяется скоростью самой медленной ее стадии –лимитирующей.
Скорость реакции зависит от природы реагирующих веществ, их концентрации, температуры и наличия катализатора. Зависимость скорости реакции от концентрации описывается основным постулатом химической кинетики - законом действующих масс(Гульдберг, Вааге, 1864 - 1867).
Для элементарных или простых реакций скорость химической реакции в каждый момент времени пропорциональна текущим концентрациям реагирующих веществ, возведенных в степени, равные стехиометрическим коэффициентам.
Для химической реакции аА + bВ → продукты
![]() ,
,
Где k– константа скорости химической реакции; САи СВ– молярные концентрации реагирующих веществ,
а и b– стехиометрические коэффициенты.
а – порядок реакции по веществу А;
b– порядок реакции по веществу В.
n=a+b– общий порядок реакции.
При CA = CB = 1 моль/л,v = k. Следовательно,константа скорости реакции- этоудельная скорость(т.е. она равна скорости реакции при концентрации реагирующих веществ, равной единице).
Скорость большинства реакций увеличивается с ростом температуры, т.к. при этом возрастает энергия сталкивающихся частиц и повышается вероятность того, что при столкновении произойдет химическое превращение.
Для количественного описания температурных эффектов в химической кинетике используют два основных соотношения – правило Вант – Гоффа и уравнение Аррениуса.
Правило Вант – Гоффа (1884).При увеличении температуры на 10 градусов скорость химической реакции возрастает в 2 – 4 раза.
 ,
,
Где = 24 - температурный коэффициент скорости – коэффициент Вант – Гоффа;
![]() .
и
.
и![]() - скорость реакции при температуре Т1и Т2.
- скорость реакции при температуре Т1и Т2.
По закону действующих масс скорость реакции и константа скорости пропорциональны друг другу, поэтому правило Вант – Гоффа можно записать так:
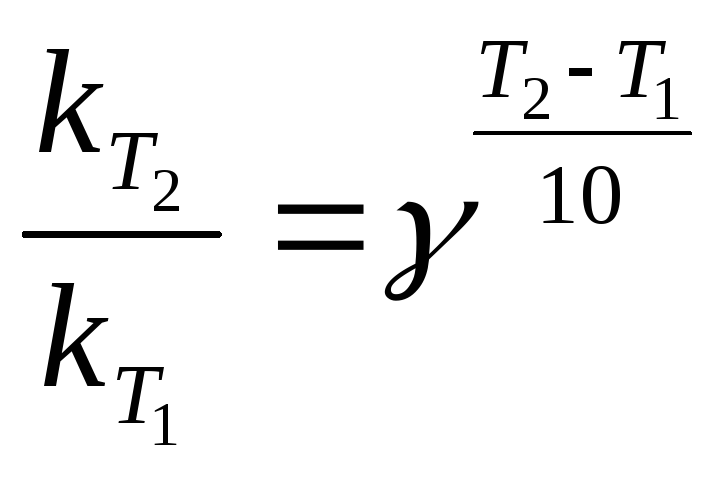 ,
,
Где
![]() .
и
.
и![]() - константы скорости реакции при
температуре Т1и Т2.
- константы скорости реакции при
температуре Т1и Т2.
Правило Вант – Гоффа приближенно описывает экспериментальные данные и применимо только в очень ограниченном интервале температур.
Гораздо более точным является уравнение Аррениуса, описывающее температурную зависимость константы скорости:
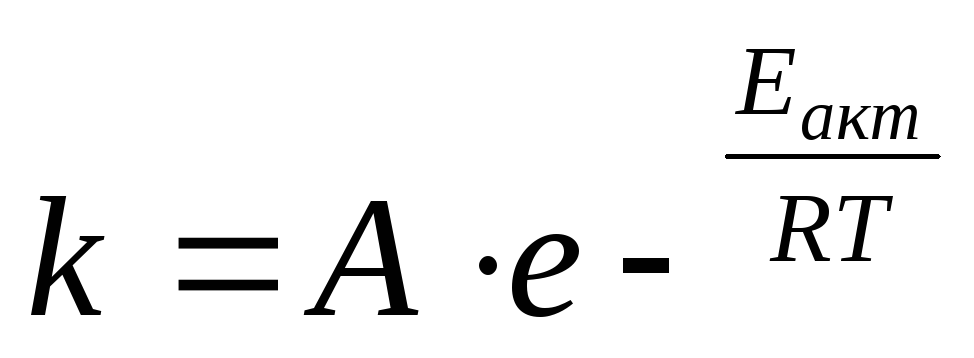 ,
,
Где Еакт– энергия активации, кДж;
А – предэкспоненциальный множитель;
R= 8,31 Дж/мольК – универсальная газовая постоянная;
Т, К – температура.
В логарифмическом виде уравнение Аррениуса имеет вид:
![]()
Зная
![]() и
и![]() ,
можно рассчитать энергию активации:
,
можно рассчитать энергию активации:

Гетерогенные реакции идут на поверхности раздела фаз, которая и служит реакционным пространством. Поэтому первой особенностью кинетики этих реакций является влияние площади реакционной поверхности на скорость реакции
![]()
Где с – концентрация реагента (газообразного или жидкого).
Если в реакции непосредственно участвует твердое вещество, то в кинетическое уравнение не входит его концентрация
Например, для реакции CaO(т) +CO2(г)CaCO3(т) по закону
действующих масс![]() .
.
