
- •Методические указания
- •1. Химическая термодинамика
- •Примеры решения задач
- •Контрольные задания
- •2 Фазовые равновесия
- •Контрольные задания
- •3. Химическая кинетика
- •Примеры решения задач
- •Контрольные задания
- •4. Электрохимия
- •4.1. Электропроводность растворов
- •4.2. Гальванические элементы
- •Примеры решения задач
- •Контрольные задания
- •Коллоидная химия
- •5. Адсорбция
- •Контрольные задания
- •6. Специфические особенности дисперсных систем
- •6.1. Дисперсное состояние вещества.
- •Контрольные задания
- •6.2. Состав и строение коллоидных систем
- •Контрольные задания
- •6.2. Свойства коллоидных систем
- •Контрольные задания
- •7. Устойчивость дисперсных систем
- •Контрольные задания
- •8. Микрогетерогенные системы
- •8.1 Суспензии
- •8.2 Эмульсии
- •8.3 Пены
- •8.4 Аэрозоли
- •8.5 Порошки
- •Литература
3. Химическая кинетика
Химическая кинетика – это учение о химическом процессе, его механизме и закономерностях протекания во времени.
Законы химической кинетики позволяют:
- рассчитать значение константы скорости химической реакции;
- определить механизм реакции по кинетическим кривым;
- прогнозировать влияние на скорость реакции температуры, концентрации реагентов, катализаторов, рН среды;
- количественно охарактеризовать ферментативные реакции.
Для успешного выполнения задания по химической кинетике следует проработать лекционный материал соответствующего раздела. По учебнику [1] изучить теоретический материал и разобрать решения типовых задач по задачнику [2].
В таблице 3.1 приведены основные соотношения для определения констант и времени полупревращения в реакциях различного порядка.
Таблица 3.1 Соотношения для определения констант и времени полупревращения в реакциях различного порядка
|
Порядок реакции |
Дифференциальное уравнение |
Константа скорости, k |
Время
полупревращения, |
Размерность константы скорости, k |
|
0 |
|
|
|
|
|
1 |
|
|
|
|
|
2 (Тип I)
|
|
|
|
|
|
2 (Тип II) |
|
|
|
|
|
3 (Тип I) |
|
|
|
|
Для определения порядка реакции используют дифференциальный и интегральный методы. Дифференциальный метод основан на применении дифференциального уравнения реакции. Например, для реакции
![]() (3.1)
(3.1)
дифференциальное уравнение имеет следующий вид:
![]() (3.2)
(3.2)
1. Метод измерения скоростей при различной глубине превращения.
Сначала проводят опыт при условии
![]() >>
>>![]() .
Получают кинетическую кривую
.
Получают кинетическую кривую![]() .
По тангенсу углов касательных к
кинетической кривой в разных точках
находят значения скорости
.
По тангенсу углов касательных к
кинетической кривой в разных точках
находят значения скорости![]() при разных
при разных![]() .
.

Рисунок 3.1. Определение скорости реакции при различных глубинах превращения
При этом можно считать, что изменяется
концентрация только компонента
![]() ,
а концентрация компонента
,
а концентрация компонента![]() сохраняется
практически постоянной («метод избыточных
концентраций»). Тогда
сохраняется
практически постоянной («метод избыточных
концентраций»). Тогда![]() ,
где
,
где![]() .
После логарифмирования уравнение для
скорости реакции будет
.
После логарифмирования уравнение для
скорости реакции будет
![]() (3.3)
(3.3)
Строят зависимость
![]() и по тангенсу угла наклона полученной
прямой находят значение
и по тангенсу угла наклона полученной
прямой находят значение![]() .
.
Затем проводят второй опыт при условии
![]() >>
>>![]() и аналогичным образом находят порядок
реакции
и аналогичным образом находят порядок
реакции![]() по
веществу
по
веществу![]() .
.
Общий порядок реакции определяется как
![]() .
.
Достоинство метода – простота и
возможность определения дробных
значенийпорядка реакций. Недостаток
– большая погрешность в определении
значений![]() в разных точках кинетической кривой.
в разных точках кинетической кривой.
2. Метод начальных скоростей.
В этом случае также используют «метод избыточных концентраций».
С начала
соблюдая условие
начала
соблюдая условие![]() >>
>>![]() проводят ряд опытов при разных значениях
проводят ряд опытов при разных значениях![]() (начальная концентрация
(начальная концентрация![]() во всех опытах одинакова). Определяют
начальные скорости
во всех опытах одинакова). Определяют
начальные скорости![]() в этих опытах.
в этих опытах.
Рисунок 3.2. Определение начальных скоростей реакции при различных начальных концентрациях превращения.
Логарифмическая зависимость начальной
скорости от начальной концентрации
![]() имеет
следующий вид:
имеет
следующий вид:
![]() (3.4)
(3.4)
Строят зависимость
![]() и
по тангенсу угла наклона находят порядок
реакции
и
по тангенсу угла наклона находят порядок
реакции![]() по
компоненту
по
компоненту![]() .
.
Повторяют опыты в избытке компонента
![]() (
(![]() >>
>>![]() )
при различных начальных концентрациях
)
при различных начальных концентрациях![]() .
Таким же образом из зависимости
.
Таким же образом из зависимости
![]()
![]() (3.5)
(3.5)
находят порядок реакции
![]() по
компоненту
по
компоненту![]() .
.
Интегральный метод базируется на использовании интегральных уравнений, описывающих кинетику реакций нулевого, первого, второго и третьего порядков. Существует несколько интегральных методов.
1. Метод подстановки.
По опытным данным рассчитывают константы
скорости реакции по уравнениям нулевого,
1-го, 2-го и 3-го порядков (таблица 3.1). Можно
считать, что уравнение характеризует
процесс, если полученные значения
![]() колеблются около какой-то средней
величины в пределах ошибки измерения.
колеблются около какой-то средней
величины в пределах ошибки измерения.
2. Графический метод.
По опытным данным строят графики в соответствующих координатах:
- нулевого порядка
![]() ;
;
- первого порядка
![]() ;
;
- второго порядка (тип 1)
![]() ;
;
- второго порядка (тип 2)
![]() .
.

Рисунок 3.3. Зависимость
![]() от времени для реакций нулевого (1),
первого (2) и второго (3) порядка.
от времени для реакций нулевого (1),
первого (2) и второго (3) порядка.
В зависимости от порядка реакции по данному веществу график зависимости, построенный по экспериментальным данным в координатах соответствующих интегральных уравнений, будет выражаться прямой линией.
3. Определение порядка реакции по периоду полупревращения.
Значение
![]() можно определить расчетным путем по
результатам двух измерений
можно определить расчетным путем по
результатам двух измерений![]() при двух значениях
при двух значениях![]() :
:
 (3.6)
(3.6)
или графическим путем исходя из зависимости
![]() (3.7)
(3.7)
Строят
график зависимости
![]() ,
для которой
,
для которой![]() .
.
Температурная зависимость константы скорости определяется уравнением Аррениуса:
![]() , (3.8)
, (3.8)
где
![]() - константа скорости реакции при
температуре
- константа скорости реакции при
температуре![]() ;
;![]() - универсальная газовая постоянная;
- универсальная газовая постоянная;![]() - предэкспоненциальный множитель;
- предэкспоненциальный множитель;![]() -
энергия активации реакции.
-
энергия активации реакции.
Если известны константы скорости
![]() и
и![]() для данной реакции при двух разных
температурах
для данной реакции при двух разных
температурах![]() и
и![]() ,
то энергию активации реакции определяют
по формуле:
,
то энергию активации реакции определяют
по формуле:
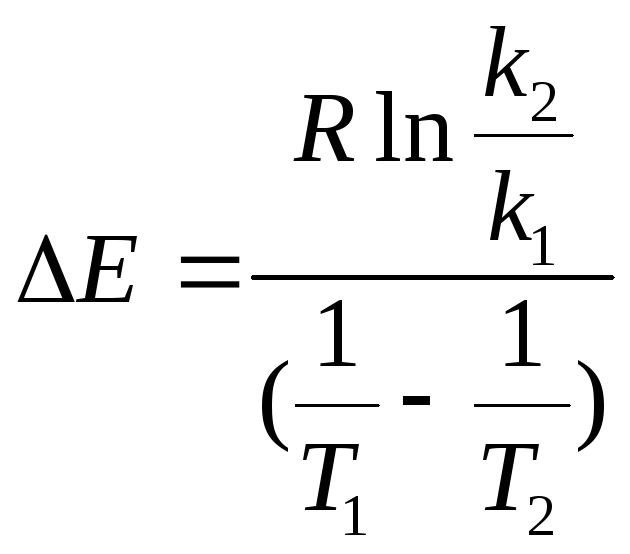 . (3.9)
. (3.9)
Обратите внимание на то, что единицы измерения константы скорости зависят от порядка кинетического уравнения реакции. Для реакции первого порядка молярные концентрации могут быть заменены любым другим способом выражения состава системы (массовая доля, массовая концентрация и др.), но обязательно одинаковыми для С0 и Сt.
Кинетика ферментативных реакций описывается уравнением Михаэлиса-Ментен:
v0=![]() , (3.10)
, (3.10)
где Km иVmax– кинетические параметры, отражающие механизм действия фермента, [S] – концентрация субстрата.
Для определения параметров этого уравнения удобнее использовать уравнение Лайнуивера – Берка:
![]() =
=![]() +
+![]() . (3.11)
. (3.11)
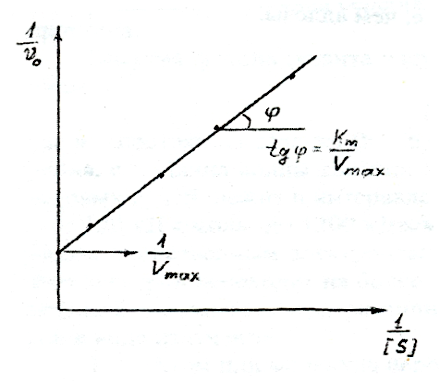
Рисунок 2.8. Определение параметров KmиVmaxуравнения Лайнуивера-Берка.
Vmax выражает эффективность действия фермента, так какмолярная активность фермента(аЕ) определяется соотношением:
аЕ =![]() ,
(3.12)
,
(3.12)
которая показывает количество молекул субстрата, превращаемого одной молекулой фермента за единицу времени.
Параметр Kmимеет смысл количества субстрата, необходимого для связывания половины имеющегося фермента и достижения половины максимальной скорости. ПоэтомуKmможно использовать для оценки специфичности действия определенного фермента по отношению к данному субстрату.


