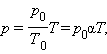физика 43
.docxАгрегатные состояния вещества
Все вещества могут существовать в трех агрегатных состояниях - твердом, жидкоми газообразном. Четвертым агрегатным состоянием вещества часто считают плазму. Переходы между ними сопровождаются скачкообразным изменением ряда физических свойств (плотности, теплопроводности и др.).
Агрегатное состояние зависит от физических условий, в которых находится вещество. Существование у вещества нескольких агрегатных состояний обусловлено различиями в тепловом движении его молекул (атомов) и в их взаимодействии при разных условиях.
Газ - агрегатное состояние вещества, в котором частицы не связаны или весьма слабо связаны силами взаимодействия; кинетическая энергия теплового движения его частиц (молекул, атомов) значительно превосходит потенциальную энергию взаимодействий между ними, поэтому частицы движутся почти свободно, целиком заполняя сосуд, в котором находятся, и принимают его форму. Любое вещество можно перевести в газообразное, изменяя давление и температуру.
Жидкость - агрегатное состояние вещества, промежуточное между твердым и газообразным. Для нее характерна большая подвижность частиц и малое свободное пространство между ними. Это приводит к тому, что жидкости сохраняют свой объем и принимают форму сосуда. В то же время жидкость обладает рядом только ей присущих свойств, одно из которых - текучесть.
В жидкости молекулы размещаются очень близко друг к другу. Поэтому плотность жидкости гораздо больше плотности газов (при нормальном давлении). Свойства жидкости по всем направлениям одинаковы (изотропны) за исключением жидких кристаллов.
При нагревании или уменьшении плотности свойства жидкости, теплопроводность, вязкость меняются, как правило, в сторону сближения со свойствами газов.
Тепловое движение молекул жидкости состоит из сочетания коллективных колебательных движений и происходящих время от времени скачков молекул из одних положений равновесия в другие. При наличии внешней силы, сохраняющей свое направление более длительное время, чем интервалы между скачками, молекулы перемещаются в направлении этой силы, что и приводит к текучести жидкости.
Твердые тела - агрегатное состояние вещества, характеризующееся стабильностью формы и характером теплового движения атомов. Это движение вызывает колебания атомов (или ионов), из которых состоит твердое тело. Амплитуда колебаний обычно мала по сравнению с межатомными расстояниями.
Структура твердых тел многообразна, но, тем не менее, их можно разделять на кристаллы и аморфные тела.
В кристаллах атомы (или ионы) расположены в пространстве в узлах кристаллической решётки и колеблются около них. Строгая периодичность в расположении атомов приводит к сохранению порядка на больших расстояниях.
В аморфных телах атомы колеблются около хаотически расположенных точек. Свойства аморфных тел: они изотропны, не имеют постоянной температуры плавления, обладают текучестью.
По типам химической связи твердые тела делят на три класса, каждый из которых характеризуется определенным пространственным распределением электронов: 1) ионные кристаллы (NaCl, KaCl); 2) ковалентные (алмаз, Ge, Si); 3) металлические.
Кристаллическая структура твердых тел зависит от сил, действующих между атомами и частицами. Одни и те же атомы могут образовывать различные структуры - серое и белое олово, графит и алмаз.
Полиморфизм - способность некоторых веществ существовать в состояниях с различной атомно-кристаллической структурой (сера, кремнезем имеют более чем две полиморфные модификации).
Одиночные кристаллы называют монокристаллами. У монокристаллов некоторые свойства анизотропны, т. е. зависят от направления (механические, оптические и электрические). Естественная анизотропия - характерная особенность кристаллов; например, пластинка слюды легко расщепляется на тонкие листочки вдоль определенной плоскости (параллельно этой плоскости силы сцепления между частицами слюды наименьшие).
Твердое тело, состоящее из большого числа маленьких кристаллов, называют поликристаллическим. Поликристаллические материалы изотропны.
Плазма - частично или полностью ионизированный газ, в котором плотности отрицательных и положительных зарядов одинаковы. При сильном нагревании любое вещество испаряется, превращается в газ. Если увеличивать температуру и далее, резко усиливается процесс термической ионизации. Молекулы газа начнут распадаться на составляющие их атомы, которые затем превращаются в ионы. В состоянии плазмы находится подавляющая часть вещества Вселенной: звезды, галактические туманности и межзвездная среда. Около Земли плазма существует в виде солнечного ветра и ионосферы. На поверхности Земли в естественных условиях плазма - редкий гость, появляющийся лишь при вспышках молний. В лабораторных условиях плазма впервые появилась в виде газового разряда. Она заполняет лампы дневного света, стеклянные трубки неоновой рекламы и т. д. За последние годы применение плазмы существенно расширилось. Высокотемпературная плазма (Т ~ 106-108К) из смеси дейтерия с тритием используется для осуществления управляемого термоядерного синтеза; низкотемпературная плазма (Т =< 105 К) - в различных газоразрядных приборах: газовых лазерах, ионных приборах, МГД-генера-торах и так далее.
Параметры состояния.
Распределение массы жидкости в объеме характеризуется средней плотностью ρ – массой жидкости, приходящейся на единицу объема
![]()
Состояние газа в любой точке определяется тремя параметрами состояния – давлением p, плотностью и температурой T, которые в случае совершенного газа связаны между собой уравнением состояния Клапейрона – Менделеева:
![]() .
Здесь R – газовая постоянная.
.
Здесь R – газовая постоянная.
При больших плотностях на динамическое поведение молекул влияют расположенные поблизости другие молекулы, уравнение состояния для совершенного газа нуждается в уточнении. Уточненное уравнение состояния называется уравнением Ван-дер-Ваальса
![]()
где
опытные значения коэффициентов для
воздуха приблизительно равны
![]() ,
причем значения берутся при стандартных
условиях. Это уравнение непригодно для
газов вблизи точки конденсации.
,
причем значения берутся при стандартных
условиях. Это уравнение непригодно для
газов вблизи точки конденсации.
Сжимаемость
жидкости – это свойство жидкости
изменять свой объем при изменении
давления количественно характеризуется
коэффициентом объемного сжатия bv:
![]() .
.
Уравнение состояния — уравнение, связывающее между собой термодинамические (макроскопические) параметры системы, такие, как температура, давление, объём, химический потенциал и др. Уравнение состояния можно написать всегда, когда можно применять термодинамическое описание явлений. При этом реальные уравнения состояний реальных веществ могут быть крайне сложными.
Термическое уравнение состояния связывает макроскопические параметры системы. Для системы с постоянным числом частиц его общий вид можно записать так:
-
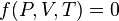 .
.
Калорическое уравнение состояния показывает, как внутренняя энергия выражается через давление, объем и температуру. Для системы с постоянным числом частиц оно выглядит так:
-
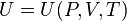 ,
,
или, учитывая, что давление можно выразить из термического уравнения,
-
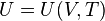 .
.
Каноническое уравнение представляет собой выражение для одного из термодинамических потенциалов (внутренней энергии, энтальпии, свободной энергии или потенциала Гиббса) через независимые переменные, относительно которых записывается его полный дифференциал.
-
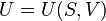 (для
внутренней энергии),
(для
внутренней энергии),
-
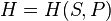 (для
энтальпии),
(для
энтальпии),
-
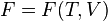 (для
свободной энергии),
(для
свободной энергии),
-
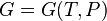 (для
потенциала Гиббса).
(для
потенциала Гиббса).
Каноническое уравнение, независимо от того, в каком из этих четырех видов оно представлено, содержит полную информацию о термических и калорических свойствах термодинамической системы.
Основное уравнение молекулярно-кинетической теории идеального газа
Это
уравнение связывает макропараметры
системы – давление P
и концентрацию молекул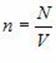 С
ее микропараметрами – массой молекул,
их средним квадратом скорости или
средней кинетической энергией:
С
ее микропараметрами – массой молекул,
их средним квадратом скорости или
средней кинетической энергией:
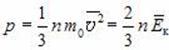
Учитывая связь между концентрацией молекул в газе и его плотностью, можно получить еще одну форму основного уравнения МКТ идеального газа:
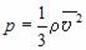
2. Средняя кинетическая энергия молекул поступательного движения
Сравним два уравнения:
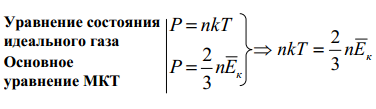
Из равенства
следует
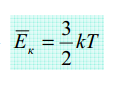 .средняя
кинетическая энергия молекул
пропорциональна абсолютной температуре
.средняя
кинетическая энергия молекул
пропорциональна абсолютной температуре
Из формулы вытекает молекулярно-кинетический смысл температуры: температура – это мера энергии теплового движения молекул, из которых состоит тело
Средняя
квадратичная скорость молекул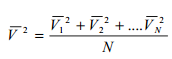

Изотермический процесс (T = const)
Изотермическим процессом называют квазистатический процесс, протекающий при постоянной температуре T. Из уравнения (*) состояния идеального газа следует, что при постоянной температуре T и неизменном количестве вещества ν в сосуде произведение давления p газа на его объем V должно оставаться постоянным:
|
На плоскости (p, V) изотермические процессы изображаются при различных значениях температуры T семейством гипербол p ~ 1 / V, которые называются изотермами. Так как коэффициент пропорциональности в этом соотношении увеличивается с ростом температуры, изотермы, соответствующие более высоким значениям температуры, располагаются на графике выше изотерм, соответствующих меньшим значениям температуры (рис. 3.3.1). Уравнение изотермического процесса было получено из эксперимента английским физиком Р. Бойлем (1662 г.) и независимо французским физиком Э. Мариоттом (1676 г.). Поэтому это уравнение называют законом Бойля–Мариотта.
|
|
|
Рисунок 3.3.1. Семейство изотерм на плоскости (p, V). T3 > T2 > T1 |
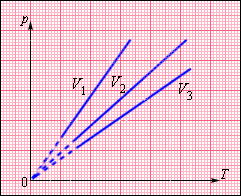
Изохорный процесс (V = const)
Изохорный процесс – это процесс квазистатического нагревания или охлаждения газа при постоянном объеме V и при условии, что количество вещества ν в сосуде остается неизменным.
Как следует из уравнения (*) состояния идеального газа, при этих условиях давление газа p изменяется прямо пропорционально его абсолютной температуре: p ~ T или
|
На плоскости (p, T) изохорные процессы для заданного количества вещества ν при различных значениях объема V изображаются семейством прямых линий, которые называются изохорами. Большим значениям объема соответствуют изохоры с меньшим наклоном по отношению к оси температур (рис. 3.3.2).
|
|
|
Рисунок 3.3.2. Семейство изохор на плоскости (p, T). V3 > V2 > V1 |
Экспериментально зависимость давления газа от температуры исследовал французский физик Ж. Шарль (1787 г.). Поэтому уравнение изохорного процесса называется законом Шарля.
Уравнение изохорного процесса может быть записано в виде:
|
где p0 – давление газа при T = T0 = 273,15 К (т. е. при температуре 0 °С). Коэффициент α, равный (1/273,15) К–1, называют температурным коэффициентом давления.
Изобарный процесс (p = const)
Изобарным процессом называют квазистатический процесс, протекающий при неизменным давлении p.
Уравнение изобарного процесса для некоторого неизменного количества вещества ν имеет вид:
|
где V0 – объем газа при температуре 0 °С. Коэффициент α равен (1/273,15) К–1. Его называют температурным коэффициентом объемного расширения газов.
На плоскости (V, T) изобарные процессы при разных значениях давления p изображаются семейством прямых линий (рис. 3.3.3), которые называются изобарами.
|
|
|
Рисунок 3.3.3. Семейство изобар на плоскости (V, T). p3 > p2 > p1 |
Зависимость объема газа от температуры при неизменном давлении была экспериментально исследована французским физиком Ж. Гей-Люссаком (1862 г.). Поэтому уравнение изобарного процесса называют законом Гей-Люссака.
Экспериментально установленные законы Бойля–Мариотта, Шарля и Гей-Люссака находят объяснение в молекулярно-кинетической теории газов. Они являются следствием уравнения состояния идеального газа.