
- •1.Структурная организация ферментов
- •2. Специфичность ферментов
- •3. Общая характеристика ферментов - мультимеров
- •4. Механизм действия ферментов
- •Основные этапы ферментативного катализа
- •Кинетика ферментативных реакций
- •Свойства ферментов
- •Ингибиторы ферментов
- •3. Регуляция активности ферментов
- •Номенклатура и классификация ферментов
- •4. Локализация ферментов в клетке
Ферменты
Фермент взаимодействует с субстратом и катализирует его превращение
Обмен веществ в организме можно определить как совокупность всех химических превращений, которым подвергаются соединения, поступающие извне. Эти превращения включают все известные виды химических реакций: межмолекулярный перенос функциональных групп, гидролитическое и негидролитическое расщепления химических связей, внутримолекулярная перестройка, новообразование химических связей и окислительно - восстановительные реакции. Такие реакции протекают в организме с чрезвычайно большой скоростью только в присутствии катализаторов.
Общее число видов ферментов, вероятно, приближается к 10 000. В это число входят не только ферменты, катализирующие 2000—3000 реакций обмена, но также и ферменты, вовлеченные в передачу сигнала, процесс дыхания, мышечное сокращение, свертываемость крови, транспорт веществ, обезвреживание токсичных и чужеродных соединений, нейротрансмиссию.
Ферменты имеют белковую природу, однако обнаружена способность некоторых молекул РНК осуществлять катализ. Такие РНК получили название «рибозимы».
Биосинтез ферментов находится под контролем генов. Различают конститутивные ферменты, постоянно присутствующие в клетках, и индуцируемые ферменты, биосинтез которых активируется под влиянием соответствующих субстратов.
Ферменты катализируют превращение веществ, которые называются субстратами (S), в продукты (Р).
Как и другие химические катализаторы, ферменты:
увеличивают скорость реакции, но не расходуются в ходе процесса и не претерпевают необратимых изменений;
не изменяют состояние равновесия химической реакции, ускоряя как прямую, так и обратную реакцию в равной степени;
повышают скорость реакции, понижая энергию активации, тот энергетический барьер, который отделяет одно состояние системы от другого.
при ферментативном катализе образованию продуктов предшествует образование фермент-субстратного комплекса (ES-комплекс), который через переходное состояние превращается в комплекс фермент-продукты (ЕР-комплекс), после чего происходит высвобождение продуктов. В общем виде уравнение ферментативного катализа записывается следующим образом: Е + S Е S ЕР Е+Р
Ферменты отличаются от небиологических катализаторов следующими свойствами:
высокой эффективностью действия - скорость ферментативных реакций обычно в 106 1012 раз выше, чем соответствующих неферментативных реакций;
высокой субстратной специфичностью — способностью взаимодействовать с определенным субстратом или группой субстратов;
высокой специфичностью действия – способностью катализировать специфическую реакцию;
мягкими условиями протекания ферментативных реакций: температура 37 °С, нормальное атмосферное давление, рН, близкое к нейтральному. В противоположность этому для эффективного химического катализа часто требуются высокие температура и давление, а также экстремальные значения рН;
способностью к регуляции. Каталитическая активность многих ферментов может изменяться в зависимости от концентрации веществ-регуляторов больше, чем в зависимости от концентрации их субстратов. Возможность регулирования активности ферментов делает их своеобразными организаторами обменных процессов в клетке.
1.Структурная организация ферментов
Ферменты – это глобулярные белки, состоящие из одной или нескольких полипептидных цепей, организованных в 3-х мерную структуру.
По химическому строению различают простые (однокомпонентные) ферменты (состоят только из аминокислот) и сложные двукомпонентные ферменты (имеющие небелковую часть - кофактор).
Кофакторы – это вещества, способствующие действию ферментов, или необходимые для его осуществления. Роль кофактора в основном сводится к следующему:
изменение третичной структуры белка и создание комплементарности между ферментом и субстратом, стабилизация молекулы фермента в пространстве;
непосредственное участие в реакции в качестве еще одного субстрата.
Кофакторы делят, хотя и достаточно условно, на коферменты и простетические группы.
Добавочную группу, прочно связанную, не отделяемую от белковой части, называют простетической группой; в отличие от этого добавочную группу, легко отделяющуюся от апофермента и способную к самостоятельному существованию, обычно именуют коферментом.
Химическая природа важнейших коферментов была выяснена в 30-е годы нашего столетия благодаря трудам О. Варбурга, Р. Куна, П. Каррера и др. Оказалось, что роль коферментов в двухкомпонентных ферментах играют большинство витаминов (Е, К, Q, В1, В2, В6 В12, Н и др.) или соединений, построенных с участием витаминов (коэнзим А, НАД+ и т. п.). Кроме того, функцию коферментов выполняют такие соединения, как НS-глутатион, многочисленная группа нуклеотидов и их производных, производные некоторых моносахаридов, ряд других веществ.
Характерной особенностью двухкомпонентных ферментов является то, что ни белковая часть, ни добавочная группа в отдельности не обладают заметной каталитической активностью. Только их комплекс проявляет ферментативные свойства. При этом белок резко повышает каталитическую активность добавочной группы, присущую ей в свободном состоянии в очень малой степени; добавочная же группа стабилизирует белковую часть и делает ее менее уязвимой к денатурирующим агентам.
В апоферменте есть участок, характеризующийся специфической структурой, избирательно связывающий кофермент. Это так называемый кофермент связывающий домен; его структура у различных апоферментов, соединяющихся с одним и тем же коферментом, очень сходна.
Каждый кофермент имеет определенную структуру, что делает его специфичным для определенного типа реакций (табл.1).
В процессе катализа реакции в контакт с субстратом вступает не вся молекула фермента, а определенный ее участок, который называется активным центром. Эта зона молекулы не состоит из последовательности аминокислот, а формируется при формировании третичной структуры белковой молекулы.
Активный центр — это относительно небольшой участок, расположенный в узком гидрофобном углублении (щели) поверхности молекулы фермента, непосредственно участвующий в связывании, удержании субстрата и катализе.
В активном центре различают две зоны: центр связывания (или субстратсвязывающий участок), ответственный за присоединение и удержание субстрата, и каталитический центр, отвечающий за химическое превращение субстрата (рис. 1). Необходимо понимать, что в реальных ферментах субстратный центр может совпадать (или перекрываться) с каталитическим центром. Более того, каталитический центр может окончательно формироваться в момент присоединения субстрата. Поэтому часто говорят об активном центре фермента, представляющем сочетание первого и второго.
Аллостерический (регуляторный) центр отвечает за активность фермента
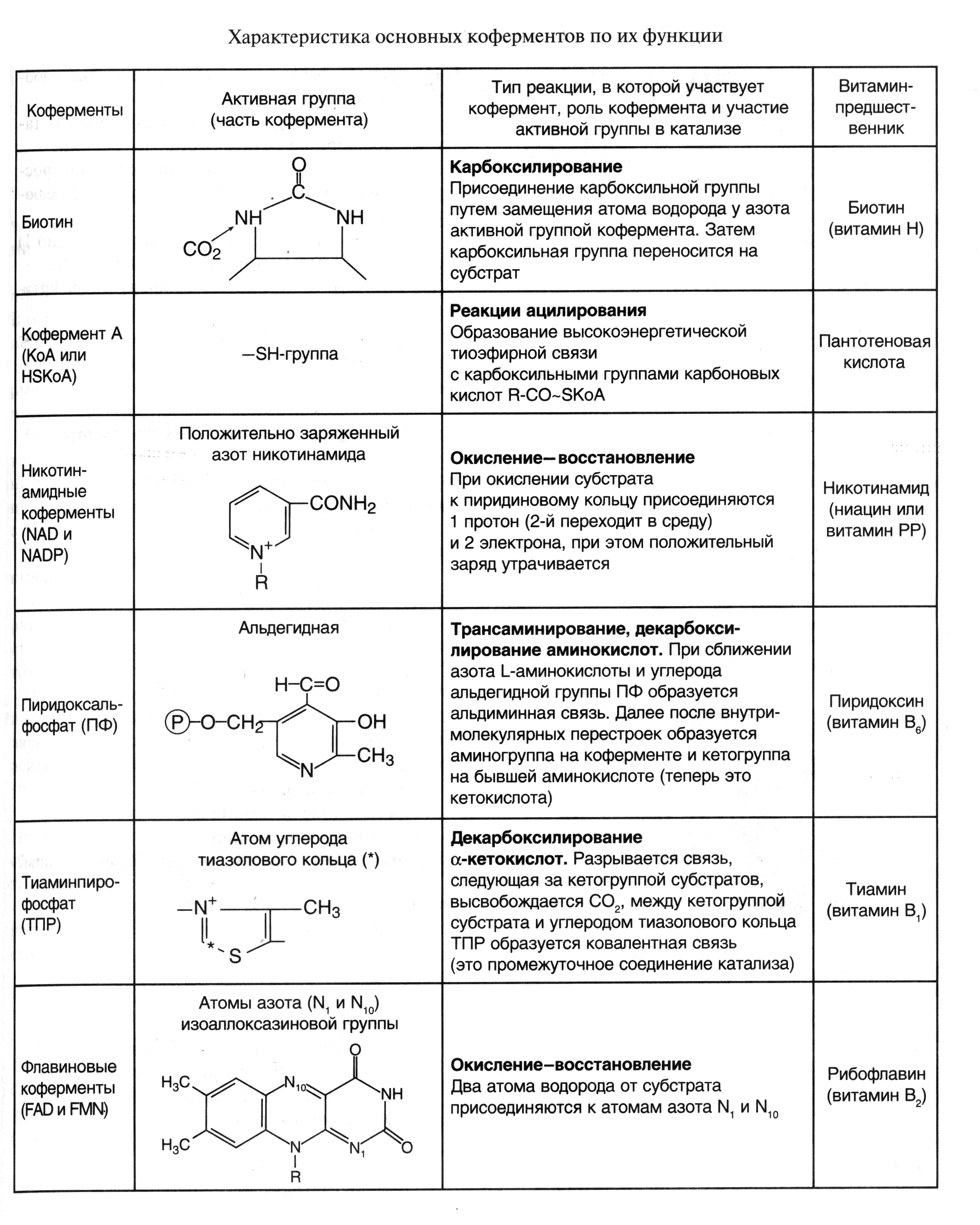
Таблица 1
Как уже указывалось, сложные ферменты в каталитическом центре имеют участок или домен для связывания кофактора.
Помимо активного центра ряд ферментов снабжен регуляторным центром. С этой зоной фермента взаимодействуют эффекторы, влияющие на его каталитическую активность.
Ферментативные эффекторы - вещества, изменяющие скорость ферментативного катализа. Среди них различают ингибиторы - замедляющие скорость реакции и активаторы - ускоряющие ферментативную реакцию.
