
Практика_Общая генетика
.pdf1.ГЕНЫ: СТРУКТУРА, ЭКСПРЕССИЯ. ГЕНЕТИЧЕСКИЙ КОД.
НЕ КОДИРУЮЩАЯ ДНК. ЦЕНТРАЛЬНАЯ ДОГМА МОЛЕКУЛЯРНОЙ БИОЛОГИИ. ТРАНСКРИПЦИЯ, ТРАНСЛЯЦИЯ, СИНТЕЗ БЕЛКА
Цель занятия:
Получить представление о генетическом коде, строении и экспрессии гена. Овладеть основным понятийным аппаратом молекулярной генетики. Разобрать особенности строения генов. Научиться описывать и объяснять процессы транскрипции и трансляции у прокариот и эукариот. Ознакомиться с примерами применения полученных знаний для научных и практических целей.
Задачи занятия:
1.Разобрать теоретический материал.
2.Зарисовать по таблицам и атласу схемы строения генов про- и эукариот, процессы транскрипции и трансляции.
3.Решить ситуационные задачи.
Формируемые компетенции:
ОК-1, ПК-9, ПК-31, ПК-32
Студент должен знать:
1. Основные понятия молекулярной генетики.
1
2.Развитие представлений о генах, классификация.
3.Сущность генетического кода и его свойства
4.Строение гена прокариот. Оперон.
5.Строение гена эукариот. Экзоны, интроны. Процессинг.
6.Центральная догма молекулярной биологии. Экспрессия гена.
7.Особенности процессов транскрипции и трансляции у про- и эукариот.
8.Регуляция транскрипции, трансляции и синтеза белка.
Студент должен уметь:
1.Пользоваться учебной, научной, научно-популярной литературой, сетью Интернет для получения знаний по данной теме.
2.Работать с обучающей компьютерной программой при изучении темы.
3.Идентифицировать процессы транскрипции и трансляции, опероны, гены эукариот и прочие молекулярные генетические понятия по микрофотографиям, рисункам и схемам.
4.Решать ситуационные задачи.
Студент должен владеть:
1.Основными понятиями молекулярной генетики.
2.Навыками устного и письменного описания изучаемого материала.
Оснащение занятия:
1.Таблицы
1.Генетический код.
2.Схема лактозного оперона.
3.Схема строения гена эукариот.
4.Транскрипция.
5.Трансляция.
6.Регуляция экспрессии гена.
2.Технические средства
1.Ноутбук.
2.Проектор.
3.Микроскоп световой.
2
3.Микропрепараты:
1.Иммуногистохимическое выявление холинацетилтрансферазы в двигательный нейронах спинного мозга.
2.Иммуногистохимическое выявление быстрого миозина в мышечных волокнах быстрой и медленной скелетной мышцы.
Хронологическая карта занятия:
1.Организационная часть.
2.Письменный тестовый контроль.
3.Разбор теоретического материала.
4.Самостоятельная работа студентов и текущий контроль за выполнением заданий.
5.Проверка выполненных работ в тетрадях.
6.Установка задания для подготовки к следующей теме.
Теоретический обзор
Изучите материал, используя следующую литературу:
Основная:
1. «Биология», учебник в 2 т/ под ре д. В.Н. Ярыгина. - М.: ГЭОТАР-Медиа, 2011.
2.«Биология», учебник в 2 т/ под ред. В.Н. Ярыгина, М.: Медицина, 2006 г
3.Биология/ А.А. Слюсарев, С.В. Жукова, - К: Высшая школа,
1987.
4.Электронная версия учебно-методического пособия (каф. мед. биологии и генетики)
Дополнительная:
5.Гены./ Льюин Б. – М.: Мир. 1987.
6.Молекулярная биология клетки, В 3-х томах/ Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К., Уотсон Дж.. – М.: Мир.
1994.
3
Практическая часть
Микропрепараты. Экспрессия тканеспецифичных генов
1. Иммуногистохимическое выявление холинацетилтрансферазы в двигательный нейронах спинного мозга
Мотонейроны спинного мозга принадлежат к популяции холинэргических нервных клеток. Синтез АХ происходит в нервной терминали из холина и ацетил-КоА при помощи фермента холинацетилтрансферазы (ХАТ). Снижение экспрессии ХАТ в мотонейронах спинного мозга показано при нейродегенеративных заболеваниях (например, боковой амиотрофический склероз, хорея Хантингтона), одним из патогномоничных признаков которых является прогрессирующая мышечная слабость. Мутация гена CHAT, кодирующего ХАТ, обуславливает развитие миастенического синдрома, который также характеризуется внезапными эпизодическими кризами мышечной слабости.
Иммуногистохимическое окрашивание. На поперечных срезах поясничного отдела спинного мозга крысы выявляли ХАТ иммунопероксидазным методом. Антитела (АТ) к ХАТ (Chemicon International, Inc., Temecula, CA) применяли в разведении 1:500.
Для иммунной реакции с первичными АТ был применён стрептавидин-биотиновый комплекс (Elite ABC Kit; Vector Laboratories). Иммунопреципитат визуализировали при помощи диаминбензидина (DAB Substrate Kit for Peroxidase; Vector Laboratories). Иммуногистохимическое исследование сегментов спинного мозга на уровне L4–L5 выявило холинэргические нейроны в передних рогах спинного мозга крыс. Осадок иммуногистохимической реакции локализуется в перикарионе и отростках двигательных нейронов.
2. Иммуногистохимическое выявление быстрого миозина в мышечных волокнах быстрой и медленной скелетной мышцы
Скорость сокращения мышечного волокна определяется типом миозина. Изоформа миозина, обеспечивающая высокую скорость сокращения, — быстрый миозин, изоформа миозина с меньшей скоростью сокращения — медленный миозин. Общепринято, что
4
волокна, типируемые по быстрому миозину, имеют высокую активность АТФазы миозина и относятся к волокнам типа II. Мышечные волокна, экспрессирующие медленный миозин, классифицируются как волокна типа I с низкой активностью АТФазы миозина. Таким образом, иммуногистохимическое типирование волокон по качественному составу миозина и выявление активности АТФазы миозина отражают скоростные характеристики мышечных волокон.
Иммуногистохимическое типирование быстрой и медленной мышц морской свинки. Криостатные срезы готовили из свежезамороженной в жидком азоте ткани. Для окрашивания срезов применены антитела к тяжёлым цепям быстрого миозина (Sigma) в разведении 1:400. Для иммунной реакции с первичными АТ был применён стрептавидин-биотиновый комплекс (Elite ABC Kit; Vector Laboratories). Иммунопреципитат визуализировали при помощи диаминбензидина (DAB Substrate Kit for Peroxidase; Vector Laboratories).Срезы камбаловидной (медленной) мышцы морской свинки монтировали на одном предметном стекле вместе со срезами подошвенной (быстрой) мышцы. При окрашивании таких срезов с помощью АТ против быстрого миозина положительная иммуногистохимическая реакция выявлена в быстрых волокнах подошвенной мышце и отсутствует в гомогенно медленной камбаловидной мышце. Анализ иммуногистохимической реакции указывает, что в медленной мышце отсутствует экспрессия гена тяжёлых цепей быстрого миозина. В быстрой мышце ген быстрого миозина экспрессируется в быстрых мышечных волокнах и отсутствует в медленных. Таким образом, каждая мышца уникальна по спектру входящих в её состав типов мышечных волокон. Этот спектр генетически детерминирован (отсюда практика типирования мышечных волокон при отборе спортсменов-бегунов — спринтеров и стайеров). У бегуновстайеров преобладают медленные волокна, у бегунов-спринтеров, штангистов — быстрые.
5
Ситуационные задачи с ответами и пояснениями
Задачи 1-9
1. Молекулярный вес аминокислотных остатков, входящих в состав белка, равен в среднем 110 Да, а нуклеотидных остатков ДНК – около 330 Да. Чему равна молекулярная масса фрагмента двухцепочечной вирусной ДНК, кодирующего белок с общей молекулярной массой 330 кДа?
Решение: Общая молекулярная масса белков равна 330 кДа, что соответствует 330000 Да. Если одна аминокислота, в составе белка в среднем весит 110 Да, то 330000/ 110 = 3000 – это количество всех аминокислотных остатков.
Так как генетический код триплетен, то количество нуклеотидов в мРНК, шифрующей данный белок будет: 3000 х 3 = 9000 Так как в ДНК, с которой транскрибировалась мРНК две цепи, то количество нуклеотидов ДНК будет 9000 х 2 = 18000
Если молекулярная масса одного нуклеотида в ДНК около 330 Да, то общая молекулярная масса будет: 18000 х 330 = 5940000 Да
Ответ: молекулярная масса фрагмента двухцепочечной вирусной ДНК равна
5940000 Да
2. Фермент триптофансинтетаза синтезирует аминокислоту триптофан. Этот фермент состоит из двух пар субъединиц: 2α2β.
Молекулярная масса субъединицы α равна 29500, а β - 95000. Какова молекулярная масса всей триптофансинтетазы? Сколько приблизительно аминокислотных остатков входит в состав этого фермента, если известно, что молекулярная масса одного аминокислотного остатка составляет в среднем 110?
Ответ: (2 х 29500 + 2 х 95000) / 110 = 2490 аминокислот входит в состав фермента триптофансинтетазы.
3. Белок состоит из 100 аминокислот. Установите, во сколько раз молекулярная масса участка гена, кодирующего данный белок, превышает молекулярную массу белка, если средняя молекулярная масса аминокислотного остатка – 110 Да, а нуклеотида - 330 Да. Ответ поясните.
Ответ: 100 х 110 = 11000 – молекулярная масса белка;
6
100 х 3 = 300 х 2 = 600 х 330 = 198000 – молекулярная масса гена,
кодирующего данный белок;
198000/11000 в 18 раз ген тяжелее кодируемого им белка
4. Какова молекулярная масса белка, содержащего 99 пептидных связей при условии, что молекулярная масса одного аминокислотного остатка составляет в среднем 110 Да?
Ответ: 99 пептидных связей в белке образуется между 100 аминокислотами. Тогда молекулярная масса белка будет равна - 100 х 110 = 11000 Да
5. Небольшой пептид состоит из 40 аминокислотных остатков. Сколько пар нуклеотидных остатков входит в состав фрагмента двухцепочечной молекулы ДНК, несущего информацию о первичной структуре этого белка?
Ответ: 40 х 3 = 120 х 2 = 240 нуклеотидных остатков двухцепочечной молекулы ДНК
6. Сколько разных пептидов, состоящих из 5 аминокислотных остатков, может быть синтезировано из аминокислот 20-и видов, при условии, что каждая из них встречается в синтезируемом белке только один раз?
Ответ: Так встречается аминокислота в пептиде из 5 аминокислотных остатков всего один раз, а общее число видов их в клетке 20, то - 20 х 19 х 18 х 17 х 16 = 1860480 пептидов.
7. В трансляции участвовало 30 молекул тРНК. Определите число аминокислотных остатков, входящих в состав синтезируемого белка, а также число триплетов и нуклеотидов в участке гена, который кодирует этот белок.
Ответ: Одна тРНК переносит одну аминокислоту, поэтому количество аминокислотных остатков, входящих в состав синтезируемого белка равно 30. Число триплетов мРНК, с которыми взаимодействуют антикодоны тРНК, также равно количеству тРНК – 30. Нуклеотидов в мРНК будет 30 х 3 = 90, т.к. генетический код триплетен. Двухцепочечная ДНК содержит 90 х 2 = 180 нуклеотидов в участке гена, который кодирует этот белок.
7
8. Сколько нуклеотидов содержит ген (обе цепи ДНК), в котором запрограммирован белок из 500 аминокислот? Какую он имеет длину (расстояние между нуклеотидами в ДНК составляет 0,34 нм)? Какое время понадобится для синтеза этого белка, если скорость передвижения рибосомы по мРНК составляет 6 триплетов в секунду?
Ответ: 500 х 3 = 1500 х 2 = 3000 нуклеотидов содержит ген (обе цепи ДНК), в котором запрограммирован данный белок. Его длина 1500 х 0,34 = 540 нм. На мРНК содержится 500 триплетов, значит время, которое понадобиться для трансляции данной мРНК примерно равно 500/ 6 = 83 сек или 1 мин и 23 сек
9. Участок одной из двух цепей молекулы ДНК содержит 300 нуклеотидов с А, 100 с Т, 150 с Г и 200 с Ц. Какое число нуклеотидов с А, Т, Г, Ц содержится в двух цепях молекулы ДНК. Сколько аминокислот должен содержать белок, кодируемый этим участком молекулы ДНК. Ответ поясните.
Ответ: По правилу комплементарности А – Т, значит во второй цепи будет содержаться 100 нуклеотидов с А. Общее количество А в двух цепях будет –
300 + 100 = 400.
Общее количество Т - 100 + 300 = 400. Общее количество Ц – 200 + 150 = 350. Общее количество Г – 150 + 200 = 350.
Белок будет содержать – 300 + 100 + 150 + 200 = 750/ 3 (т.к. ген. код триплетен) = 250
8
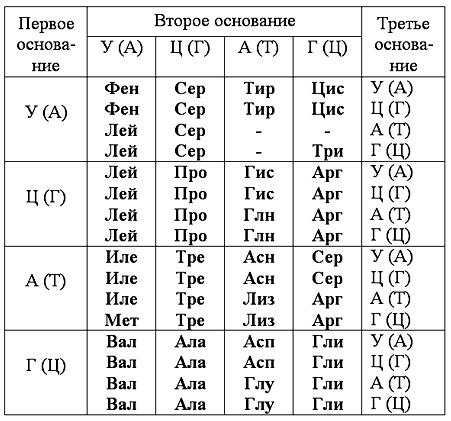
Задачи 10-19.
Для решения следующих задач воспользуйтесь таблицей 1 и таблицей 2
Таблица 1. Генетический код
В таблице представлены первое, второе и третье основание кодона. Названия оснований даются в двух вариантах. Без скобок указаны нуклеотиды РНК, в скобках указаны нуклеотиды ДНК.
9
Таблица 2. Аминокислоты, соответствующие им сокращенные названия и кодоны
|
Сокращенное |
Аминокислоты |
Сокращенное |
Кодоны |
|
латинское |
|
русское |
|
|
название |
|
название |
|
A |
Ala |
Аланин |
Ала |
GCA GCC GCG GCU |
C |
Cys |
Цистеин |
Цис |
UGC UGU |
D |
Asp |
Аспарагиновая кислота |
Асп |
GAC GAU |
E |
Glu |
Глутаминовая кислота |
Глу |
GAA GAG |
F |
Phe |
Фенилаланин |
Фен |
UUC UUU |
G |
Gly |
Глицин |
Гли |
GGA GGC GGG GGU |
H |
His |
Гистидин |
Гис |
CAC CAU |
I |
Ile |
Изолейцин |
Иле |
AUA AUC AUU |
K |
Lys |
Лизин |
Лиз |
AAA AAG |
L |
Leu |
Лейцин |
Лей |
UUA UUG CUA CUC CUG CUU |
M |
Met |
Метионин |
Мет |
AUG |
N |
Asn |
Аспарагин |
Асн |
AAC AAU |
P |
Pro |
Пролин |
Про |
CCA CCC CCG CCU |
Q |
Gln |
Глутамин |
Глн |
CAA CAG |
R |
Arg |
Аргинин |
Арг |
AGA AGG CGA CGC CGG CGU |
S |
Ser |
Серин |
Сер |
AGC AGU UCA UCC UCG UCU |
T |
Thr |
Треонин |
Тре |
ACA ACC ACG ACU |
V |
Val |
Валин |
Вал |
GUA GUC GUG GUU |
W |
Trp |
Триптофан |
Три |
UGG |
Y |
Tyr |
Тирозин |
Тир |
UAC UAU |
10
