
- •280100 Природообустройство и водопользование,
- •Рецензент:
- •Содержание
- •Введение
- •1 Лабораторная работа №1
- •Техника безопасности при работе в лаборатории общей химии
- •2 Лабораторная работа №2
- •3 Лабораторная работа №3
- •3.2 Методика проведения опытов
- •4 Лабораторная работа №4
- •4.2 Методика проведения опытов
- •5 Лабораторная работа №5
- •Пример 3
- •Решение
- •6 Лабораторная работа №6
- •Пример 1 Как повлияет на равновесие реакции
- •Решение
- •Пример 2 Вычислить константу равновесия реакции
- •Решение
- •Пример 3
- •7 Лабораторная работа №7 Приготовление растворов заданной концентрации
- •7.2.1 Опыт №1. Приготовление раствора с заданной массовой долей соли
- •Пример 1
- •Решение
- •Пример 2
- •Решение
- •Числа 2 и 6 показывают, что для приготовления 110 мл 2% раствора необходимо взять 2 весовые части 8% раствора и 6 весовых частей воды.
- •8 Лабораторная работа №8
- •10 Лабораторная работа №10
- •11 Лабораторная работа №11
- •12 Лабораторная работа №12
- •13 Лабораторная работа №13 Электрохимический ряд напряжений металлов. Коррозия металлов
- •14 Лабораторная работа №16
- •15 Лабораторная работа №15.
- •Заключение
- •Использованная литература
2 Лабораторная работа №2
Определение молярной массы химического эквивалента металла
Цель работы: познакомиться с понятием химического эквивалента, определить молярную массу химического эквивалента цинка методом вытеснения водорода.
Оборудование и реактивы: прибор для определения молярной массы эквивалента металла, термометр, барометр, 25%-ный раствор соляной кислоты, металлический цинк.
2.1 Теоретические пояснения
Химическим эквивалентом называется реальная или условная частица вещества, которая может замещать, присоединять, высвобождать или быть каким-либо другим способом эквивалентна (равноценна) одному иону водорода в кислотно-основных и ионообменных реакциях, либо одному электрону в окислительно-восстановительных реакциях.
Реальные частицы – это атомы, ионы, молекулы и другие частицы. Условные частицы в действительности не существуют, но используются при расчетах. Это, например, 1/2 Н2SO4, 1/4 C, 1/3 Fe3+.
В общем случае эквивалент любого вещества X может быть записан в виде 1/z(X), где z – число эквивалентности, или эквивалентное число, которое всегда больше или равно единице. Оно показывает, сколько эквивалентов содержится в одной формульной единице вещества. Дробное число 1/z называется фактором эквивалентности.
Для данного вещества z находится по конкретной реакции. В окислительно-восстановительных процессах z определяется числом электронов, принятых или отданных одной формульной единицей вещества. Рассмотрим окислительно-восстановительную реакцию
S + O2 = SO2
S0 - 4e- = S+4
O2 + 4e- = 2O -2.
Формульная единица серы отдает 4 электрона, а одна формульная единица молекулярного кислорода принимает 4 электрона. Следовательно, эквивалентное число z для серы и для кислорода равно четырем. Поэтому эквивалент серы в приведенной реакции – это условная частица ¼ S, а эквивалент кислорода – условная частица ¼ О2.
В кислотно-основных и ионообменных процессах эквивалентное число определяется стехиометрией реакции, причем для одного и того же вещества, в зависимости от реакции, эквивалентное число может иметь различные значения.
В качестве примера рассмотрим две реакции:
H2SO4 + NaOH = NaHSO4 + H2O;
H2SO4 + 2NaOH = Na2SO4 + 2H2O.
Определим эквивалент серной кислоты в этих реакциях. Для этого нужно знать эквивалент какого-либо другого компонента реакции, например гидроксида натрия. На основании определения эквивалента, для гидроксида натрия эквивалентом является реальная частица NaOH, для нее z = 1. В дальнейших рассуждениях нужно опираться на стехиометрию реакции. В соответствии с уравнением первой реакции, один эквивалент NaOH взаимодействует с одной частицей H2SO4. Поэтому число эквивалентности для серной кислоты в этой реакции равно 1, а эквивалентом будет являться реальная частица H2SO4.
По второй реакции два эквивалента гидроксида натрия реагируют с одной частицей серной кислоты, тогда один эквивалент NaOH взаимодействует с условной частицей 1/2H2SO4, которая и будет являться эквивалентом серной кислоты во второй реакции. Таких частиц в формульной единице H2SO4 две, поэтому для серной кислоты в данной реакции z = 2.
Когда речь не идет о конкретной реакции, при определении z для сложных веществ можно воспользоваться следующими правилами:
для оксидов z равно числу атомов элемента, умноженному на степень окисления элемента;
для кислот z равно основности кислоты;
для оснований z равно кислотности основания;
для солей z равно числу катионов металла, умноженному на заряд катиона.
Количество вещества эквивалента обозначается (1/z(X)). Единица измерения – моль. Один моль эквивалента вещества содержит 6,0221023 эквивалентов.
Молярная масса эквивалента М(1/z(X)) – это масса 1 моль эквивалента вещества 1/z(X), измеряется в г/моль.
Связь между молярной массой эквивалента, количеством вещества эквивалента, массой и молярной массой вещества выражается соотношениями:
![]() (2.1)
(2.1)
Экспериментальное определение молярной массы химического эквивалента цинка в данной работе основано на законе эквивалентов: эквивалентные количества всех веществ, участвующих в реакции, одинаковы.
Таким образом, для любой пары компонентов реакции справедливо равенство (2.2).
(1/z1(X1)) = (1/z2(X2)) (2.2)
Учитывая соотношение (2.1), данное равенство можно преобразовать к виду
![]() (2.3)
(2.3)
Итак, массы реагирующих друг с другом веществ, а также массы продуктов реакции относятся друг к другу как молярные массы их эквивалентов.
Если один из компонентов реакции, допустим Х1, находится в газообразном состоянии, то для него справедливы соотношения (2.4) и (2.5).
![]() (2.4)
(2.4)
![]() , (2.5)
, (2.5)
где V(X1) – объем газообразного вещества X1 в данных условиях;
VM(1/z(X1)) – объем, занимаемый одним моль эквивалента вещества Х1 в тех же условиях;
VM(X1) – молярный объем вещества Х1.
С учетом формулы (2.4) для газообразного компонента реакции, можно получить еще одно следствие из закона эквивалентов:
![]() (2.6)
(2.6)
2.2 Методика проведения опыта
Устройство прибора для определения молярной массы эквивалента металла представлено на рисунке 2.1. Бюретка (1) емкостью 50 мл соединена резиновыми трубками с воронкой (2) и пробиркой (3). В бюретку наливают воду, которая должна также заполнять часть воронки.
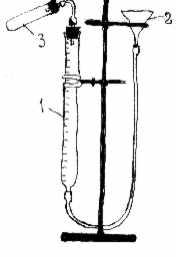
Рисунок 2.1 – Прибор для определения молярной массы эквивалента металла
2.2.1 Перед началом опыта необходимо убедиться в герметичности прибора. Для этого пустую пробирку соединяют с бюреткой, и поднимают воронку так, чтобы уровень воды в ней был выше, чем в бюретке. При этом в приборе создается давление, превышающее атмосферное. Если уровень воды в бюретке не изменяется после незначительного первоначального повышения, то прибор герметичен и готов к работе. В противном случае следует исправить дефекты, допущенные при сборке прибора.
2.2.2 Влить в пробирку на 1/5 ее объема через воронку соляную кислоту. Стенки пробирки при этом должны остаться сухими.
2.2.3 Держа пробирку в наклонном положении, положить на ее стенку кусочек цинка, взвешенный в лабораторной работе №1 так, чтобы он не соприкасался с кислотой.
2.2.4 Присоединить пробирку к прибору, плотно закрыв ее пробкой. Убедиться, что герметичность прибора не нарушена.
2.2.5 Передвижением воронки привести воду в ней и бюретке к одному уровню. Отметить и записать уровень воды в бюретке V1, произведя отсчет по нижнему краю мениска (утолщенная поверхностная пленка воды в бюретке). Мениск должен находиться на уровне глаз.
2.2.6 Стряхнуть цинк в кислоту. По окончании реакции дать пробирке остыть до комнатной температуры, после чего снова привести воду в бюретке и воронке к одному уровню. Отметить и записать уровень воды в бюретке V2. Разность V2 – V1 равна объему выделившегося водорода в реакции
Zn + 2 HCl = ZnCl2 + H2
2.2.7 Отметить показания термометра и барометра.
2.2.8 Результаты опыта занести в таблицу 2.1.
Таблица 2.1 – Результаты опыта
|
Масса цинка m(Zn), г |
Условия опыта |
Уровень воды, мл |
Объем водорода V(H2), мл | |||
|
Атмосферное давление Р, мм рт. ст. |
Давление водяного пара h, мм рт. ст. |
Темпера-тура Т, К |
до опыта V1 |
после опыта V2 | ||
|
|
|
|
|
|
|
|
2.3 Обработка результатов опыта
2.3.1 По разности уровней воды в бюретке до и после протекания реакции вычислить объем выделившегося водорода при температуре и давлении опыта.
2.3.2 Так как водород собирается над водой, то он насыщен водяным паром. Общее давление в приборе равно атмосферному и складывается из парциальных давлений водяного пара и водорода. Чтобы вычислить парциальное давление водорода, нужно из атмосферного давления Р вычесть величину давления h насыщенного при температуре опыта водяного пара.
P(H2)=P-h (2.7)
Для нахождения h следует воспользоваться данными таблицы 2.2.
Таблица 2.2 – Давление насыщенного водяного пара при различных температурах
|
Темпе-ратура t, 0C |
Давление насыщен-ного пара h, мм рт.ст. |
Темпе-ратура t, 0C |
Давление насыщен-ного пара h, мм рт.ст. |
Темпе-ратура t, 0C |
Давление насыщен-ного пара h, мм рт.ст. |
Темпе-ратура t, 0C |
Давление насыщен-ного пара h, мм рт.ст. |
|
10 |
9,2 |
15 |
12.8 |
20 |
17,5 |
25 |
23.8 |
|
11 |
9,6 |
16 |
13.6 |
21 |
18.6 |
26 |
25,5 |
|
12 |
10,5 |
17 |
14.5 |
22 |
19.8 |
27 |
26,7 |
|
13 |
11,2 |
18 |
15,5 |
23 |
21,1 |
28 |
28,3 |
|
14 |
12,0 |
19 |
16,5 |
24 |
22.4 |
29 |
30.0 |
2.3.3 Привести объем выделившегося водорода к нормальным условиям (Р0 = 760 мм рт.ст., Т0 = 273 К), используя объединенное уравнение газового состояния.
![]() (2.8)
(2.8)
![]() (2.9)
(2.9)
2.3.4 Рассчитать экспериментальное значение молярной массы эквивалента цинка в г/моль по закону эквивалентов в соответствии с формулой (2.6):
![]() , (2.10)
, (2.10)
где VM(1/2 H2) – объем, занимаемый одним моль эквивалента газообразного водорода, равный половине молярного объема водорода, т.е. 11,2 л/моль.
2.3.5 Рассчитать теоретическое значение молярной массы эквивалента цинка, зная молярную массу цинка и эквивалентное число z, численно равное числу электронов, отданных цинком в ходе окислительно-восстановительной реакции с соляной кислотой.
MТЕОР.(1/2 Zn) = M(Zn):2 (2.11)
Вычислить относительную ошибку опыта по формуле
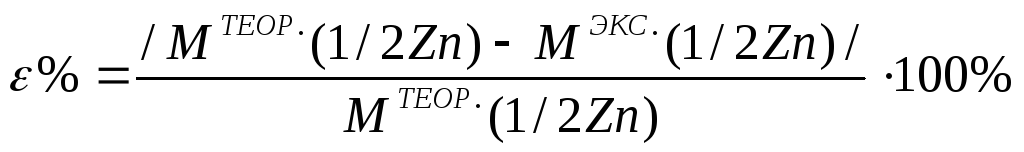 (2.12)
(2.12)
2.4 Примеры решения задач
Пример 1
Определить молярную массу эквивалента Fe2(SO4)3 в реакции
Fe2(SO4)3 + 6 NaOH = 2 Fe(OH)3 + 3 Na2SO4.
Решение
Одна формульная единица гидроксида натрия взаимодействует с одним ионом водорода, поэтому эквивалент щелочи есть реальная частица NaOH. По стехиометрии реакции на одну частицу NaOH (эквивалент) приходится 1/6частицы Fe2(SO4)3, поэтому эквивалентом сульфата железа (III) в данной реакции будет условная частица 1/6 Fe2(SO4)3.
Молярная масса эквивалента сульфата железа (III) в данной реакции может быть вычислена по формуле
M(1/6 Fe2(SO4)3) = M(Fe2(SO4)3) / 6 = 400 / 6 = 66,7 (г/моль).
Пример 2
Хлорид никеля массой 2,918 г взаимодействует с 1,8 г гидроксида натрия, молярная масса эквивалента которого равна 40 г/моль. Вычислить молярную массу эквивалента хлорида никеля.
Решение
В соответствии с законом эквивалентов
m(хлорида) / m(NaOH) = M(1/z хлорида) / M(1/1 NaOH).
Отсюда
M(1/z хлорида) = 2,918 40 : 1,8 = 64,8 (г/моль)
Пример 3
При сжигании 2,96 г металла было получено 4,91 г его оксида. Определить молярную массу эквивалента металла.
Решение
Найдем массу кислорода, израсходованного при горении металла. В соответствии с законом сохранения массы веществ
m(O2) = m(оксида) – m(металла) = 4,91 – 2,96 = 1,95 (г).
При окислении металлов до оксидов газообразным кислородом происходит процесс: О20+4е-=2О–2. Молекула кислорода принимает 4 электрона, следовательно, z = 4. На один электрон приходится 1/4 О2, поэтому эквивалент молекулярного кислорода – это 1/4 O2, а молярная масса эквивалента равна 8 г/моль.
По закону эквивалентов m(O2) / m(Me) = M(1/4 O2) / M(1/z Me);
Отсюда выразим M(1/z Me) и подставим численные значения величин:
M(1/z Me) = 2,96 8 / 1,95 = 12,1 (г/моль).
2.5 Требования к уровню подготовки студентов
Знать понятия: эквивалент, число эквивалентности, количество вещества эквивалента, молярная масса эквивалента.
Уметь выражать связь между молярной массой эквивалента, количеством вещества эквивалента, массой и молярной массой вещества.
Знать закон эквивалентов, уметь применять его для нахождения масс и молярных масс веществ, участвующих или образующихся в реакции.
Уметь определять молярную массу эквивалента элемента, эквивалент и молярную массу эквивалента вещества в реакции.
2.6 Задания для самоконтроля
2.6.1 Определить молярную массу эквивалента SO2 в реакции
SO2+2H2S=3S+2H2O
2.6.2 Для каких веществ максимальное значение эквивалентного числа в ионообменных реакциях одинаково: а) H3PO4; б) Na2CO3; в) Al(OH)3; г) HNO3?
2.6.3 Определить эквивалент оксида лития в реакции
Li2O+H2O=2LiOH
2.6.4 Чему равна масса 2 моль эквивалентов Ca(OH)2?
2.6.5 Молярная масса эквивалента алюминия 8,99 г/моль. Сколько граммов этого металла потребуется для восстановления меди из 30,0 г оксида меди(II)?
2.6.6 Когда количество вещества эквивалента равно количеству вещества?
2.6.7 Определить молярную массу эквивалента Fe(OH)2Cl в реакциях:
а) Fe(OH)2Cl + NaOH = Fe(OH)3 + NaCl;
б) Fe(OH)2Cl + 2 HCl = FeCl3 + 2 H2O.
2.6.8 Почему молярная масса элемента постоянна, а молярная масса его эквивалента может изменяться?
2.6.9 Может ли молярная масса эквивалента элемента или вещества быть больше его молярной массы и почему?
2.6.10 Определить молярную массу эквивалента металла в соединениях: CuSO4 5 H2O; KCl; CaSO4; Fe2O3.
2.6.11 Найти массу алюминия, если при его полном растворении в кислоте выделяется такое же количество водорода, что и при растворении 1,752 г цинка. Молярная масса эквивалента цинка равна 32,69 г/моль, молярная масса эквивалента алюминия – 8,99 г/моль.
2.6.12 Для нейтрализации кислоты гидроксидом калия на ее 1,866 г потребовалось 15 г гидроксида калия, молярная масса эквивалента которого равна 56 г/моль. Вычислите молярную массу эквивалента кислоты.
2.7 Список рекомендуемой литературы
2.7.1 Коровин Н.В. Общая химия: Учебник для технических направ. и спец. вузов. – М.: Высш. шк., 2009. – 557 с.
2.7.2 Романцева Л.М. Сборник задач и упражнений по общей химии/ Л.М.Романцева, З.Л.Лещинская, В.А.Суханова. – М.: Высш. шк., 1991. – С.44 – 47.
