ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
«БАШКИРСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕ
МИНИСТЕРСТВА ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
Кафедра фармацевтической химии
с курсами аналитической и токсикологической химии
Тема: «Обзор статей журнала «Фармация»
по фармацевтическому анализу за 2002 год»
Курсовая работа
студентки фармацевтического факультета заочного отделения группы 503 А
Шайбаковой (Минликаевой) Юлии Леонидовны
Руководитель: зав. кафедрой, профессор Халиуллин Ф.А.
Уфа - 2015
Содержание
Введение.
Изучение компонентного состава аминокислот в гомеопатических настойках арники горной.
Определение компонентов препарата "БИЦИЛЛИН-3" методом ВЭЖХ.
ВЭЖХ в анализе препаратов, содержащих пропифеназон.
Сравнительный анализ растворимых шипучих таблеток ацетилсалициловой кислоты «Таспир» и «Upsarin upsa».
Оптимизация условий анализа таблеток сложного состава анальгезирующего и спазмолитического действия.
Заключение.
Список использованной литературы.
Введение
Цель курсовой работы - изучение применения методов в фармацевтическом анализе лекарственных препаратов.
Задачи курсовой работы:
1.Провести литературный обзор статей из журнала «Фармация» за 2002 год по фармацевтическому анализу;
2. Описать методики определения различных веществ
Изучение компонентного состава аминокислот в гомеопатических настойках арники горной
Арника горная — Arnica montana L., сем. Asteraceae (сложно-цветные) — относится к так называемым полихрестам, т.е. является растением, издавна применяемым как в аллопатии (официальной медицине), так и гомеопатии.
Действие гомеопатических препаратов арники обусловлено комплексом биологически активных веществ: сесквитерпеновыми лактонами, фенолкарбоновыми кислотами, дубильными веществами, углеводами, аминокислотами и т.д.
Известно, что некоторые свободные аминокислоты оказывают положительное влияние на сердечно-сосудистую систему, участвуют в процессах нервной регуляции различных функций организма, а также влияют на сосудистый тонус.
В гомеопатии в качестве лекарственного растительного сырья используют высушенные цветки, цветущую надземную часть, корневища с корнями и целое цветущее растение арники горной в свежем виде.
При изучении компонентного состава биологически активных веществ сухих цветков арники горной методом хроматографии на бумаге выявлены цистеин, лейцин, аспарагиновая кислота, гистидин, метионин, триптофан, причем гистидин и аспарагиновая кислота — в значительных количествах, а цистеин, лейцин, метионин и триптофан — в следовых.
В подземной части арники горной обнаружена пипеколиновая кислота Цель настоящего исследования — изучение компонентного состава аминокислот в гомеопатических матричных настойках арники горной, полученных из целого цветущего свежего растения, а также из высушенных корневищ с корнями.
Экспериментальная часть
Объектами исследования служили гомеопатические матричные настойки арники горной, полученные из целого цветущего свежего растения по методу 3 "Настойки гомеопатические матричные" Временная фармакопейная статья (ВФС) 42-2799—96 в соотношении сырье—этанол 50% (по объему) 1:3; из высушенных корневищ с корнями по методу 4 "Настойки гомеопатические матричные" ВФС 42-2799—96 в соотношении сырье—этанол 90% (по объему) 1:10.
Настойки арники горной представляют собой прозрачные жидкости зеленовато-желтого (из целого цветущего свежего растения) и желто-оранжевого (из высушенных корневищ с корнями) цвета с характерным ароматным запахом.
Компонентный состав аминокислот гомеопатических матричных настоек арники горной изучали методом тонкослойной хроматографии (ТСХ), а также с помощью аминокислотного анализатора.
В качестве неподвижной фазы использовали пластинки "Сорбфил" (Россия). В качестве подвижных фаз изучали:
1) н-пропанол—вода (70:30);
2) хлороформ—метанол—10% аммиак (40:40:20);
3) н-бутанол—ледяная уксусная кислота—вода (40:10:5);
4) н-бутанол—ледяная уксусная кислота—вода (40:10:10);
5) н-бутанол—ледяная уксусная кислота—вода (40:10:20);
6) н-бутанол—диэтиловый эфир—ледяная уксусная кислота—вода (9:6:3:1).
Данные подвижные фазы оценивали по эффективности разделения аминокислот исследуемых настоек. Коэффициент разделения рассчитывали по формуле:
![]()

При расчетах мы использовали величины Rf зон, которые можно соотнести с величинами Rf и окраской стандартных образцов веществ сравнения валина и фенилаланина, полученные при хроматографии в указанных подвижных фазах. Используя коэффициент разделения, мы проанализировали все изучаемые подвижные фазы. Коэффициенты разделения для каждой подвижной фазы представлены в табл. 1.

Зоны веществ на хроматограмме обнаруживали 0,5% раствором нингидрина (ГФ XI, вып.2, ст. 124) в ацетоне. Для сравнения использовали 0,1% растворы стандартов аргинина, пролина, аспарагиновой кислоты, серина, аланина, глутами новой кислоты, валина и фенилаланина в 10% водном растворе н-пропанола.
Как видно из табл. 1, наиболее оптимальные условия разделения зон адсорбции настоек достигаются при использовании подвижной фазы 4: н-бутанол—ледяная уксусная кислота—вода (40:10:5).

Методика. На стартовую линию хроматографической пластинки наносят по 10 мкл растворов настоек и по 2 мкл растворов свидетелей и хроматографируют восходящим способом на высоту 10 см. Затем хромматограмму высушивают на воздухе при комнатной температуре до удаления запаха растворителей, обрабатывают раствором нингидрина и высушивают в сушильном шкафу при 100—105°С в течение 5—10 мин.
Результаты анализа представлены на рисунке и в табл. 2. Как видно из табл. 2, в настойках арники горной обнаружены свободные аминокислоты; в настойке из целого свежего цветущего растения арники горной идентифицированы аргинин, аспарагиновая кислота, серин, аланин, глутаминовая кислота, валин и фенилаланин, в настойке; из высушенных корневищ с корнями арники горной- аргинин, пролин, аспарагиновая кислота, серин, валин, фенилаланин.
Идентифицировать все зоны на хроматограммах методом ТСХ затруднительно, так как зоны некоторых аминокислот имеют близкие значения Rf. В связи с этим, чтобы подтвердить данные, полученные методом ТСХ2, и иметь более полные сведения о компонентном составе аминокислот в гомеопатических матричных настойках арники горной из свежесобранного и высушенного сырья, мы применяли аминокислотный анализ.
Анализ проводили на анализаторе фирмы "Hitachi" (Япония) модель 835 на стальной колонке (0,4x15 см), заполненной катионообменной смолой марки 2619 (Hitachi Custom Jon—Exchange Resin), в стандартных условиях, обычно используемых для разделения белковых гидролизатов.
Разделение аминокислот проводили в 3-буферной системе натрий-цитратных буферных растворов: 0,18 н. — рН 3,25; 0,3 н. — рН 3,9 и 1,6 н. — рН 4,75. Нингидриновый реактив готовили с использование метилового эфира этиленгликоля.
Цитратные буферные растворы подавали в колонку по стандартной программе со скоростью 32 мл/ч, нингидриновый реактив — со скоростью 20 мл/ч. После выхода из аналитической колонки разделенные аминокислоты смешивали с нингидриновым реактивом в смесительном блоке в соотношении 2:1 (по объему). Реакция аминокислот с нингидрином проходила за 4 мин при 100°С в реакционной бане. Колориметрическое измерение окрашенных комплексов, образующихся в результате реакции с нингидрином, проводили непрерывно и одновременно при 2 длинах волн. Первичные амины образовывали пурпурное окрашивание, измерение проводили при длине волны 570 нм. Вторичные амины (например, пролин) образовывали желтое окрашивание, измерение проводили при длине волны 440 нм. Оптическая плотность элюата автоматически регистрировалась on-line системой МультиХром для Windows 97 (фирма "Амперсенд", Россия). Площади пиков идентифицированных аминокислот определяли автоматически, а для неидентифицированных соединений регистрировали время выхода и площади пиков. Количество каждой идентифицированной аминокислоты определяли в наномолях и микрограммах в аликвоте, непосредственно использованной для анализа. Затем вычисляли количественное содержание обнаруженных аминокислот в настойках (в мкг/мл), а также процент выхода от общей суммы.
Поскольку изучаемые настойки были получены из разных видов сырья (высушенных корневищ с корнями и целого свежего цветущего растения) и при их изготовлении использовали разное соотношение сырья и спирта этилового разной концентрации, пробоподготовка настоек была различной.
1. Настойка из целого свежего цветущего растения. 1 мл настойки выпаривают досуха под вакуумом на роторном испарителе. Сухой остаток растворяют в 300 мкл смеси для гидролиза, состоящей из 12 н. хлористоводородной кислоты и трифторуксусной кислоты в пропорции 2:1 (по объему) с добавлением 0,001% β-меркаптоэтанола. Гидролиз проводят в запаянных стеклянных ампулах при 155°С в течение 1 ч. Затем гидролизат разбавляют водой в 2 раза, выпаривают досуха на роторном испарителе и растворяют в 500 мкл 0,1 н. хлористоводородной кислоты. 75 мкл полученного раствора разводят 0,1 н. хлористоводородной кислотой до 250 мкл. Для анализа используют 145 мкл полученного раствора.
2. Настойка их высушенных корневищ с корнями. 3 мл настойки выпаривают досуха под вакуумом на роторном испарителе. Сухой остаток растворяют в 300 мкл смеси для гидролиза, состоящей из 12 н. хлористоводородной кислоты и трифторуксусной кислоты в пропорции (2:1) (по объему) с добавлением 0,001% β-меркаптоэтанола. Гидролиз проводят в запаянных стеклянных ампулах при 155°С в течение 1 ч. Затем гидролизат разбавляют водой в 2 раза, выпаривают досуха на роторном испарителе и растворяют в 480 мкл 0,1 н. хлористоводородной кислоты. Для анализа используют 145 мкл полученного раствора.
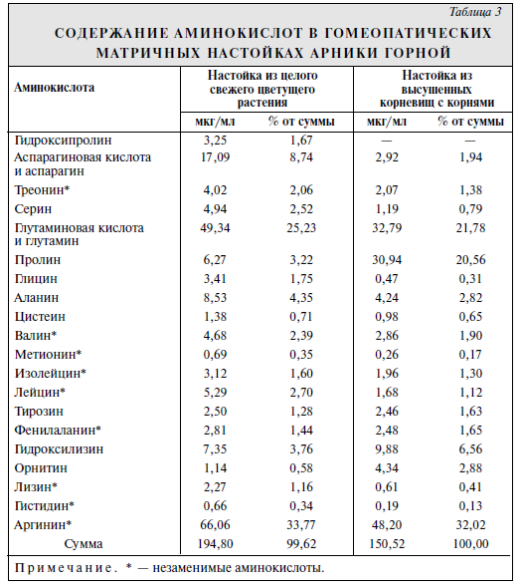
Данные о качественном и количественном составе аминокислот в гомеопатических матричных настойках арники горной после гидролиза приведены в табл. 3. Значения даны для α-аминокислот, так как β-аминокислоты не изучали из-за меньших адсорбционных характеристик и, следовательно, затрудений при их регистрировании.
Как видно из табл. 3, при определении качественного состава и количественного содержания аминокислот в гомеопатических матричных настойках из целого свежего цветущего растения и высушенных корневищ с корнями арники горной выявлено 20 аминокислот, в том числе 9 незаменимых: треонин, валин, метионин, изолейцин, лейцин, фенилаланин, лизин, гистидин и аргинин. В настойке из целого цветущего свежего растения содержится значительное количество аргинина (33,77%), большое количество глутамина и глутаминовой кислоты (25,23%), а также аспарагина и аспарагиновой кислоты (8,74%), аланина (4,35%), гидроксилизина (3,76%). В настойке из высушенных корневищ с корнями обнаружено большое количество аргинина (32,02%), глутамина и глутаминовой кислоты (21,78%), пролина (20,56%) и гидроксилизина (9,88%).

Выводы
1. Впервые изучен компонентный состав свободных аминокислот гомеопатических матричных настоек арники горной, полученных из высушенных корневищ с корнями и целого свежего цветущего растения арники горной, с помощью метода ТСХ, а также компонентный состав аминокислот после гидролиза с помощью аминокислотного анализатора.
2. В настойках обнаружено 20 аминокислот, в том числе 9 незаменимых.
3. В настойке из целого свежего цветущего растения арники горной методом ТСХ идентифицированы аргинин, аспарагиновая кислота, серин, аланин, глутаминовая кислота, валин, фенилаланин, а в настойке из высушенных корневищ с корнями арники горной аргинин, пролин, аспарагиновая кислота, серин, валин и фенилаланин.
4. С помощью аминокислотного анализатора после кислотного гидролиза в гомеопатических матричных настойках были выявлены дополнительно другие аминокислоты. Настойка из целого цветущего свежего растения содержит в значительном количестве аргинин, глутамин и глутаминовую кислоту, аспарагин и аспарагиновую кислоту, аланин, гидроксилизин. Настойка из высушенных корневищ с корнями содержит большое количество аргинина, глутамина и глутаминовой кислоты, пролина и гидроксилизина.