
- •Предмет электрохимии.
- •Проводники первого и второго рода.
- •Электрохимические реакции.
- •Законы электролиза (законы фарадея).
- •Причины электролитической диссоциации.
- •Подвижность ионов.
- •Подвижность ионов гидроксония и гидроксила.
- •Числа переноса ионов.
- •Недостатки теории аррениуса.
- •Теория электролитов дебая и гюккеля.
- •Диссоциация воды. РН растворов.
- •Диссоциация слабых электролитов.
- •Гидролиз солей.
- •Буферные растворы.
- •Произведение растворимости.
- •Гальванические элементы. Эдс.
- •Термодинамика гальванического элемента.
- •Измерение эдс.
- •Строение границы электродраствор. Двойной электрический слой.
- •Электродный потенциал.
- •Классификация электродов.
- •Электроды первого рода.
- •Электроды второго рода.
- •Газовые электроды.
- •Амальгамные электроды.
- •Физические цепи.
- •Концентрационные цепи.
- •Химические цепи.
- •Аккумуляторы.
- •Кинетика электрохимических процессов.
- •Концентрационная поляризация.
- •Электрохимическое перенапряжение.
- •Напряжение разложения.
- •Закономерности перенапряжения выделения водорода.
- •1. Влияние плотности тока
- •2. Влияние природы металла
- •3. Влияние природы и состава раствора
- •4. Влияние температуры и некоторых других факторов
- •Теории водородного перенапряжения.
- •Теория замедленной рекомбинации
- •Теория замедленного разряда
- •Электроосаждение металлов.
- •Анодное растворение и пассивность металлов.
- •Коррозия металлов. Борьба с коррозией.
Аккумуляторы.
Любая электрохимическая цепь в принципе может служить источником электрического тока. По разным причинам (малая электрическая емкость, малая скорость и необратимость химических реакций, физические изменения электродов при эксплуатации и т.д.) большая часть цепей не может быть практически использована для получения электрического тока, и лишь немногие имеют прикладное значение в качестве химических источников тока.
Химические источники тока делятся на источники тока одноразового действия (гальванические элементы) и многоразового действия (аккумуляторы). В аккумуляторах при пропускании через них тока от внешней цепи (заряжение) происходят химические изменения в электродах и растворах, близких к обратимым, и работа электрического тока аккумулируется (запасается) в форме свободной энергии продуктов реакции. Заряженный аккумулятор дает ток при разряжении, после чего вновь может быть заряжен.
Наиболее широко используют кислотный свинцовый, щелочной кадмиево-никелевый и щелочной серебряно-цинковый аккумуляторы.
СВИНЦОВЫЙ АККУМУЛЯТОР в заряженном состоянии представляет собой элемент :
() Pb PbSO4 H2SO4 (32-34 %) PbO2 Pb (+)
Здесь имеется два электрода второго рода : свинцово-сульфатный, обратимый по отношению к сульфат-ионам, и свинцово-диоксидный, обратимый по отношению к гидроксильным ионам, а следовательно, и к ионам водорода (как всякий металлоксидный электрод).
При работе аккумулятора протекают следующие электродные реакции:
на левом электроде (свинцово-сульфатном)
Pb
+ SO42-
![]() PbSO4
(т)
+ 2е
PbSO4
(т)
+ 2е
![]()
на правом электроде (свинцово-диоксидном)
PbO2
(т)
+ 4H+
+ SO42-
+ 2e
![]() PbSO4
(т)
+ 2H2O
PbSO4
(т)
+ 2H2O
![]()
Суммарная реакция в цепи :
Pb
+ PbO2
(т)
+ 4H+
+ SO42-
![]() 2 PbSO4
(т)
+ 2H2O
2 PbSO4
(т)
+ 2H2O
![]()
Откуда ЭДС цепи равна :
Е
= Ео
+
![]() ln
ln
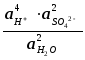 = Ео
+
= Ео
+
![]() ln
ln
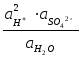 = Ео
+
= Ео
+
![]() ln
ln
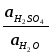
(поскольку
![]()
общей активности серной кислоты)
общей активности серной кислоты)
При
25оС
Е = 2,04 + 0,059 lg
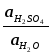
В свинцовых аккумуляторах применяются концентрированные растворы серной кислоты, поэтому активность воды здесь не будет постоянной и ее нельзя включать в величину Ео.
Токообразующие процессы отвечают теории двойной сульфатации Гладстона и Трайба. По этой теории оба электрода при разряде переходят в сульфат свинца. Когда они становятся одинаковыми по своему химическому составу, т.е. превращаются в электроды второго рода SO42- PbSO4 Pb , ЭДС цепи падает до 0. Продукт электродных реакций твердый сульфат свинца обладает способностью удерживаться на поверхности электродов. Поэтому при прохождении тока в обратном направлении (при подключении внешнего источника тока) реакции идут справа налево, в сторону регенерации исходных веществ металлического свинца и диоксида свинца. После регенерации электрохимическая цепь снова может стать источником электрической энергии. Такие циклы разряда и заряда могут повторяться много раз, и после каждого нового заряда восстанавливается исходное состояние системы.
Рассмотренная цепь была первым аккумулятором; идея его создания была высказана Якоби и осуществлена в 1859 г. Планте. В ХХ веке были предложены щелочные аккумуляторы : железо-никелевый (Эдиссон), кадмий-никелевый (Юнгер) и цинк-серебряный (Андре).
КАДМИЕВО-НИКЕЛЕВЫЙ АККУМУЛЯТОР в заряженном состоянии представляет собой электрохимический элемент
() Cd Cd(OH)2, KOH (20%) KOH (20%), Ni(OH)2, Ni(OH)3 Ni (+)
Суммарная реакция в этом элементе
Cd
+ 2Ni(OH)3
![]() Cd(OH)2
+ 2Ni(OH)2
Cd(OH)2
+ 2Ni(OH)2
![]()
Значение G для этой реакции не должно зависеть от концентрации щелочи, т.к. в суммарной реакции участвуют только твердые вещества. Однако реакции на электродах сопровождаются изменением концентрации щелочи и образованием разности концентраций у двух электродов :
Cd
+ 2OH-
![]() Cd(OH)2
+ 2e
Cd(OH)2
+ 2e
2Ni(OH)3
+ 2e
![]() 2Ni(OH)2
+ 2OH-
2Ni(OH)2
+ 2OH-
Тем не менее, в результате естественного перемешивания в условиях близости электродов эта разность концентраций практически не возникает. ЭДС кадмиево-никелевого аккумулятора равна приблизительно 1,36 В.
ЖЕЛЕЗО-НИКЕЛЕВЫЙ АККУМУЛЯТОР. В этом щелочном аккумуляторе кадмий и окись кадмия заменены железом и закисью железа.
СЕРЕБРЯНО-ЦИНКОВЫЙ АККУМУЛЯТОР. Анодом является пористая цинковая пластинка, катодом окислы серебра Ag2O и AgO. Электролит концентрированный раствор КОН, насыщенный цинкатом калия Zn(OK)2. Заряженный аккумулятор может быть представлен в виде :
() Zn Zn(OK)2, KOH (40%) AgO или Ag2O Ag (+)
Суммарная реакция в этом элементе
AgO
+ Zn
![]() ZnO + Ag
ZnO + Ag
Процесс идет в две стадии : AgO восстанавливается сначала до Ag2O, затем до металлического серебра. ЭДС элементов с катодом AgO равна 1,86 В, с катодом Ag2O 1,58-1,60 В (при 25оС). После разряда аккумулятора имеем
() Zn ZnO Zn(OK)2, KOH (40%) Ag (+)
В этих аккумуляторах в отличие от свинцовых и щелочных электролит в реакциях заряда и разряда не участвует, поэтому его можно брать очень мало. Это позволило создать аккумуляторы, имеющие очень эффективную конструкцию : электроды помещены вплотную друг к другу и разделены только тонким слоем целлофана. Весь электролит находится в порах электродов. Серебряно-цинковые аккумуляторы имеют большую емкость, высокую энергию и высокую мощность на единицу массы и объема. Они широко применяются там, где необходимы аккумуляторы небольшого размера.
Лекция 48
Электролиз. Токи обмена. Поляризация электрода, перенапряжение. Концентрационная и электрохимическая поляризация. Напряжение разложения.
