
Химическое равновесие
Реакции, которые могут идти в двух взаимнопротивоположных направлениях, называются обратимыми.
Пример:
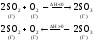
пр
= kпр
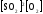
кинетическое выражение для скорости
прямой реакции,
кинетическое выражение для скорости
прямой реакции,
обр
= kобр

кинетическое выражение для скорости
обратной реакции.
кинетическое выражение для скорости
обратной реакции.
Химическое равновесие характеризуется равенством скоростей прямой и обратной реакций и постоянством концентраций всех веществ.
пр = обр;
Концентрации
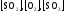
остаются постоянными.
остаются постоянными.
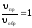
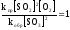 ;
; 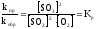 .
.
В общем виде: aA+bB⇔cC+dD
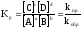 кинетическое
уравнение для константы равновесия.
кинетическое
уравнение для константы равновесия.
Константа равновесия обратимой химической реакции равна отношению произведения концентраций продуктов реакции, взятых в некоторых степенях, к произведению концентраций исходных веществ в некоторых степенях.
Смещение равновесия.
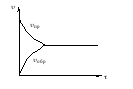
Если не изменяются условия существования системы, то равновесие может существовать сколь угодно долго. Если изменить хотя бы одно из условий, то система выйдет из равновесия – скорости прямого и обратного процесса изменятся неодинаково – будет протекать реакция. Процесс изменения концентраций, вызванный нарушением равновесия, называется сдвигом или смещением равновесия.
Сдвиг равновесия вправо, это сдвиг в сторону продуктов реакции. Сдвиг равновесия влево, это сдвиг в сторону исходных веществ.
Принцип смещения равновесия сформулировал Ле - Шателье:
Если изменить одно из условий, при которых система находится в равновесии, то в системе усиливается та реакция, которая противодействует произведённому изменению, т. е. система сопротивляется производимым изменениям.
Используя этот принцип, всегда можно определить направление смещения равновесия.
Пример:
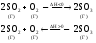
При увеличении температуры в системе усиливаются те процессы, в результате которых температура будет снижаться, т.е. равновесие сместится в направлении эндотермической реакции, в данном случае – в сторону обратной реакции, т.е. влево.
При уменьшении температуры в системе усиливаются те процессы, в результате которых температура может увеличиться, т.е. равновесие сместится в направлении экзотермической реакции, в данном случае – в сторону прямой реакции, т.е. вправо.
При увеличении давления равновесия смещается в сторону образования меньшего числа молекул газа, что приведет к снижению давления в данном объеме системы, т.е. в данном случае – вправо.
При уменьшении давления равновесие смещается влево, т. е. в сторону образования большего количества молекул газа.
Изменение давления влияет на смещение равновесия только в тех случаях, когда в системе имеются газы.
Изменение давления не влияет на смещение равновесия, если не меняется число молекул газообразных веществ.
При увеличении концентрации исходных веществ или уменьшении концентрации продуктов реакции равновесие смещается вправо, т.е. в сторону продуктов реакции.
При увеличении концентрации продуктов реакции или уменьшении концентрации исходных веществ равновесие смещается влево, т. е. в сторону исходных веществ.
Концентрации газообразных веществ пропорциональны их парциальным давлениям, поэтому в кинетическом уравнении концентрацию газа можно заменять парциальным давлением:
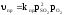
Если реакция гетерогенная, то концентрации твёрдых веществ не входят в кинетическое уравнение для константы равновесия.
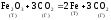 ;
;

