
- •7.1.2. Методы получения
- •7.1.3.Физические свойства
- •7.1.4. Химические свойства
- •7.2. Алкадиены
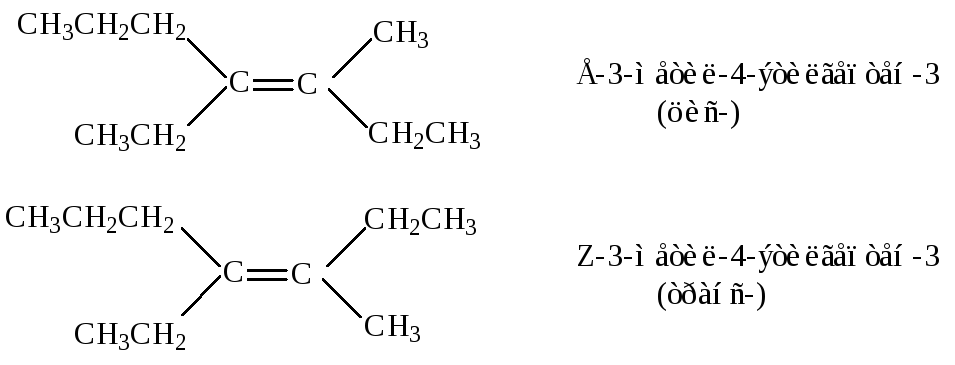
- •7.2.1.Классификация и номенклатура
- •7.2.2. Методы получения сопряженных диенов
- •7.2.3. Химические свойства сопряженных диенов
- •7.3. Алкины
- •7.3.1.Номенклатура
- •7.3.2. Методы получения
- •7.3.3. Химические свойства
7.1.2. Методы получения
1)Крекинг алканов
![]()
2)Дегидрирование алканов:
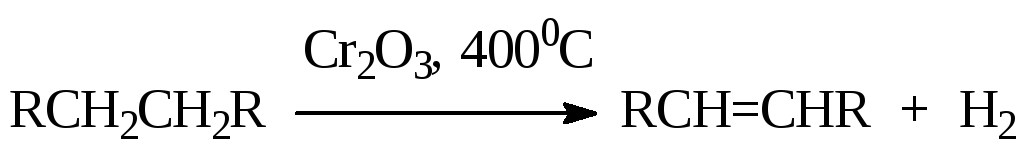
3)Дегидратация спиртов:
![]()
4)Дегидрогалогенирование галогеналканов:
![]()
5)Дегалогенирование вицинальных дигалогенидов:
![]()
7.1.3.Физические свойства
Алкены
![]() -
-![]() - газы, следующие гомологи - бесцветные
жидкости или твердые вещества,
нерастворимые в воде. Этен и пропен
имеют слабый запах, алкены с большим
числом атомов углерода имеют едкий
раздражающий запах.
- газы, следующие гомологи - бесцветные
жидкости или твердые вещества,
нерастворимые в воде. Этен и пропен
имеют слабый запах, алкены с большим
числом атомов углерода имеют едкий
раздражающий запах.
7.1.4. Химические свойства
Химические
свойства алкенов определяются наличием
связи С=С. -Связь
обладает меньшей энергией, чем -связи,
так как энергия С=С связи (611 кДж/моль)
меньше удвоенной энергии простой связи
(703 кДж/моль). Связь С=С неполярна, но
обладает большей поляризуемостью, чем
-связи.
Поэтому -связь
легко разрывается под действием как
электрофильных (![]() реакции), так и радикальных (
реакции), так и радикальных (![]() реакции) реагентов. Кроме того,-связь
оказывает влияние на реакционную
способность связи С-Н в аллильном
положении, что делает возможным протекание
реакций радикального замещения атома
водорода. Таким образом, молекулы алкенов
содержат два основных реакционных
центра – связь С=С и связь С-Н в аллильном
положении:
реакции) реагентов. Кроме того,-связь
оказывает влияние на реакционную
способность связи С-Н в аллильном
положении, что делает возможным протекание
реакций радикального замещения атома
водорода. Таким образом, молекулы алкенов
содержат два основных реакционных
центра – связь С=С и связь С-Н в аллильном
положении:
Основные типы реакций алкенов представлены на схеме 7.1.
Схема 7.1. Основные превращения алкенов
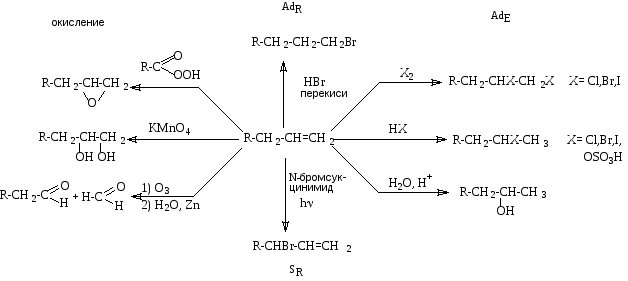
Реакции электрофильного присоединения
![]() -реакции
– основной тип превращений алкенов. По
электрофильному механизму к алкенам
присоединяются галогены, галогеноводороды,
серная кислота, вода и другие электрофильные
реагенты. Общий механизм реакции включает
ряд последовательных стадий:
-реакции
– основной тип превращений алкенов. По
электрофильному механизму к алкенам
присоединяются галогены, галогеноводороды,
серная кислота, вода и другие электрофильные
реагенты. Общий механизм реакции включает
ряд последовательных стадий:
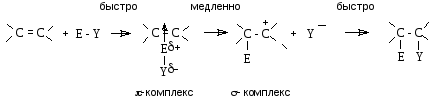
На первой
стадии электрофил образует -комплекс
с алкеном, в котором двойная связь
выступает как донор, а электрофил (E-Y
или
![]() )
как акцептор электронов. Далее-комплекс
медленно перегруппировывается в
карбокатион (-комплекс).
На последней стадии происходит быстрое
взаимодействие карбокатиона с нуклеофилом
(
)
как акцептор электронов. Далее-комплекс
медленно перегруппировывается в
карбокатион (-комплекс).
На последней стадии происходит быстрое
взаимодействие карбокатиона с нуклеофилом
(![]() )
с образованием продукта присоединения.
Скоростьопределяющей стадией процесса
является стадия образования-комплекса.
Следовательно скорость процесса в
целом, зависит от стабильности интермедиата
– карбокатиона, который близок по
энергии к переходному состоянию
лимитирующей стадии.
)
с образованием продукта присоединения.
Скоростьопределяющей стадией процесса
является стадия образования-комплекса.
Следовательно скорость процесса в
целом, зависит от стабильности интермедиата
– карбокатиона, который близок по
энергии к переходному состоянию
лимитирующей стадии.
Относительная стабильность карбокатионов зависит от возможности делокализации в них положительного заряда. Алкильные группы обладают способностью понижать положительный заряд на соседнем атоме углерода за счет +I-эффекта. Поэтому стабильность карбокатионов возрастает в ряду:
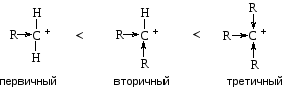
Таким образом, электронодонорные заместители (алкильные группы) увеличивают реакционную способность алкенов, так как, с одной стороны, повышают электронную плотность двойной связи, с другой стороны, стабилизируют карбокатион. Электроноакцепторные заместители действуют в противоположном направлении.
Присоединение галогенов. Галогены легко присоединяются к алкенам с образованием вицинальных дигалогенидов.
![]()
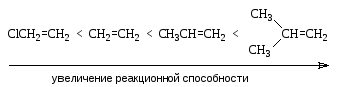
Реакционная
способность галогенов возрастает в
ряду:
![]() <
<![]() <
<![]() <
<![]()
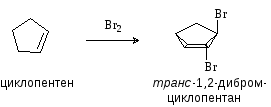
Присоединения брома используют как качественную реакцию на двойную связь. Механизм реакции:

Реакция протекает через образование мостикового бромониевого катиона, существование которого доказано спектральными методами. Образование мостикового иона подтверждается также стереохимическим результатом реакций галогенирования, которые протекают как анти-присоединение, так что результатом присоединения к циклоалкенам является транс-изомер.
Присоединение протонных кислот. Галогеноводороды, концентрированная серная кислота и вода присоединяются к алкенами с образованием соответственно алкилгалогенидов, алкилсульфатов и спиртов.
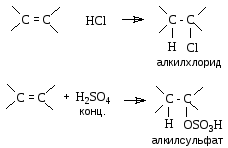
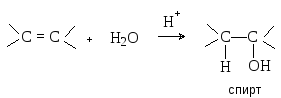
Механизм реакции включает следующие стадии.
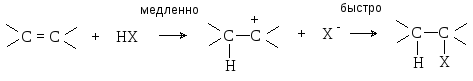
Реакционная
способность протонных кислот зависит
от их силы. Вода как слабая кислота
присоединяется к алкенам в условиях
кислотного катализа более сильными
протонными кислотами (![]() ,
,![]() ).
).

При присоединении протонных кислот к несимметрично замещенным алкенам возможно образование двух разных продуктов. Реакция протекает региоселективно по правилу Марковникова: водород присоединяется к наиболее гидрированному атому углерода.
![]()
Направление присоединения определяется относительной стабильностью промежуточно образующихся карбокатионов:
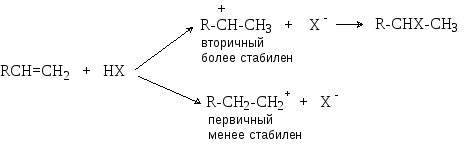
Реакция идет в направлении образования наиболее стабильного вторичного карбокатиона, который образуется с большей скоростью. Энергетическая диаграмма процессов образования первичного и вторичного карбокатионов представлена на рисунке 7.1.
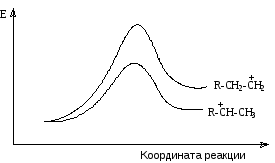
Рис.7.1. Энергетическая диаграмма процесса присоединений протонных кислот к алкенам
Правило
Марковникова не является универсальным.
Оно может нарушаться в случае изменения
механизма реакции, а также при присоединении
кислот к алкенам, содержащим
электроноакцепторные заместители,
обладающие –I-эффектом
(![]() ,
,![]() )
или –I-
и –М-эффектами (-CHO,
-COOH,
-CN),
например:
)
или –I-
и –М-эффектами (-CHO,
-COOH,
-CN),
например:
![]()
В этом случае реакция протекает в направлении образования наименее дестабилизированного интермедиата, которым является первичный карбокатион, так как в нем электроноакцепторный заместитель не расположен в непосредственной близости от положительно заряженного атома углерода:
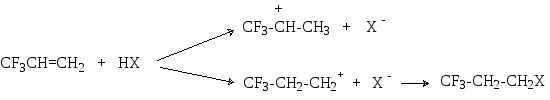
С учетом приведенных фактов можно сформулировать следующее правило:
Электрофильное присоединение несимметричных реагентов к несимметричным алкенам протекает в направлении образования наиболее стабильного карбокатиона.
Это правило позволяет предсказать строение продуктов присоединения к алкенам не только соединений типа HX, но и других несимметричных реагентов (ICl, HOCl).
Присоединение карбокатионов к алкенам. Карбокатионы, которые образуются при присоединении протона к алкенам, являются электрофильными частицами и могут присоединяться к двойной связи другой молекулы алкена, давая продукты алкилирования. Таким образом происходит полимеризация алкенов под действием кислот:
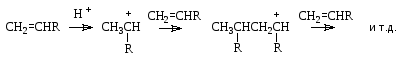
Реакции алкилирования являются способом наращивания углеродной цепи и встречаются в процессах биосинтеза терпенов и стероидов.
Реакции радикального присоединения
-Связь в алкенах может разрываться гомолитически под действием радикальных реагентов. Наиболее важной реакцией этого типа является реакция радикального присоединения HBr в присутствии перекисей (ROOR), которая позволяет получать продукты “антимарковнинского” присоединения к несимметричным алкенам:
![]()
Реакция протекает по цепному радикальному механизму:

Образуется продукт, которому предшествует более стабильный свободный радикал. Реакция характерна только для HBr. В случае НСl и HI радикальный процесс энергетически не выгоден.
Реакции окисления связи С = С
Алкены легко окисляются. Состав продуктов окисления зависит от окислителя и условий проведения реакции. Реакции окисления можно рассматривать как электрофильное присоединение по связи С=С.
Эпоксидирование. Алкены взаимодействуют с надкислотами с образованием эпоксидов:
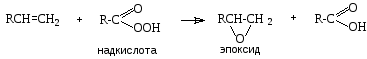
Эпоксиды обладают высокой реакционной способностью и являются ценными продуктами в промышленном органическом синтезе. Предполагают, что эпоксиды являются первичными продуктами ферментативного окисления кислородом связей С=С, в том числе в конденсированных ароматических углеводородах.
Гидроксилирование. Алкены окисляются перманганатом калия в нейтральной среде при комнатной температуре с образованием двухатомных спиртов:
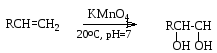
Реакция используется как тест на присутствие в соединении С=С связи.
Окисление KMnO4 в более жестких условиях (кислая среда, нагревание) протекает с расщеплением углеродного скелета.
Озонолиз. Алкены взаимодействуют с озоном с образованием озонидов, которые гидролизуются, давая карбонильные соединения и пероксид водорода:
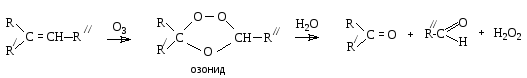
Состав продуктов озонолиза позволяет установить положение двойной связи в исходном алкене. Гидролиз озонида обычно проводят в присутствии восстановителей (Zn), чтобы избежать окисления альдегидов пероксидом водорода.
Реакции по аллильному положению
Алкены, содержащие атом водорода в аллильном положении, способны вступать в реакции радикального замещения. Легкость протекания таких реакций обусловлена высокой стабильностью образующегося при гомолитическом разрыве связи С-Н в аллильном положении свободного радикала, так как в нем возможна делокализация неспаренного электрона за счет сопряжения полувакантной р-орбитали с орбиталями соседней -связи:
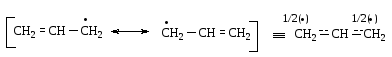
Галогенирование. Хлорирование пропена хлором при высоких температурах дает продукт замещения, а не присоединения:
![]()
Реакция протекает по цепному свободнорадикальному механизму:
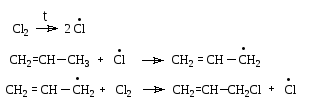
Реакция протекает в условиях термодинамического контроля в направлении образования наиболее стабильного интермедиата - аллил-катиона.
При использовании специальных бромирующих реагентов и инициаторов радикальных реакций происходит бромирование алкенов по аллильному положению:
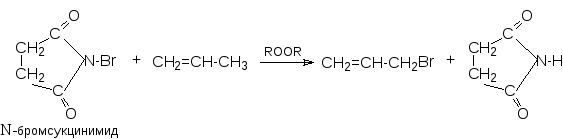
Окисление. Алкены взаимодействуют с кислородом по радикальному цепному механизму с образованием гидропероксидов и продуктов их дальнейшего распада:
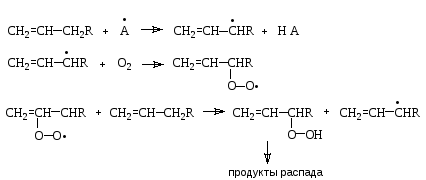
По аналогичному механизму протекает пероксидное окисление липидов in vivo с образованием моно- и дикарбоновых кислот.
