
Основные положения теории катализа.
1) Катализ применим для изменения скорости только термодинамически возможных процессов (для каталитических реакций G<0).
2) Катализаторы изменяют механизм реакции, направляя её по пути с меньшей энергией активации, что и приводит к увеличению скорости процесса.
3) Катализатор не влияет на тепловой эффект процесса.
4) Катализатор не влияет на положение химического равновесия, так как в равной степени ускоряет прямую и обратную реакции, сокращая тем самым время достижения равновесия.
5) Катализаторы действуют селективно, т. е. ускоряют одни процессы и не влияют на протекание других.
В зависимости от фазового состояния катализатора и реагентов различают гомогенныйигетерогенныйкатализ.
При гомогенномкатализе катализатор и реагенты находятся в одной фазе.
При гетерогенном катализе катализатор образует отдельную фазу, на поверхности которой протекает каталитическая реакция.
Механизм гомогенногокатализа основан на образовании катализатором и реагентами в той же фазе реакционноспособных промежуточных соединений. В результате каталитическая реакция протекает по новому механизму, который складывается из элементарных стадий с меньшими энергиями активации, чем некаталитическая реакция, например (см. рис.1):
в отсутствие катализатора
А В Еакт=Е1
в присутствии катализатора К
А
[K]; В
1
стадия А + К АК Еакт=Е2
2 стадия АК В + К Еакт=Е3.
В качестве гомогенных катализаторов используют кислоты, основания, комплексные соединения переходных металлов. Примером гомогенного катализа является ферментативный катализ.
Механизм гетерогенногокатализа более сложен и включает несколько последовательных стадий:
В гетерогенном катализе ускоряющее действие катализатора связано с понижением энергии активации, которое происходит за счет образования реагирующими веществами промежуточных поверхностных соединений на активных участках катализатора. Например, энергия активации реакции 2NH3N2 + 3H2в присутствии платинового катализатора уменьшается с 330 до 160 кДж/моль.
Катализаторами для гетерогенного катализа служат металлы (Pt,Pd,Ni,Fe,Co), оксиды металлов (Al2O3,V2O5,MnO2,Cr2O3,MoO3), сульфиды металлов (MoS2,CoS).
Кинетика ферментативного катализа
Ферменты– это вещества белковой природы, которые служат катализаторами биохимических процессов.
Особенности действия ферментов по сравнению с обычными катализаторами:
проявляют активность в мягких условиях;
действуют специфично, т. е. изменяют скорость только определенной реакции или группы реакций;
ускорение биохимических процессов под действием ферментов чрезвычайно велико (до 1010 раз);
действуют в узком интервале температур и рН среды.
Ферментативная реакция - это сложная реакция, механизм которой может быть представлен следующей схемой:
1) E + S k1;k-1;>?@ ES
2) ESk2;P+E,
где S– субстрат - вещество, на которое фермент оказывает каталитическое
действие;
Е – фермент (энзим);
ES– фермент-субстратный комплекс;
Р – продукт;
k1, k–1иk2– константы скоростей соответствующих реакций.
Обозначим через [E], [S] и [ES] текущие концентрации фермента, субстрата и фермент-субстратного комплекса, а через [E]0и [S]0– начальные концентрации фермента и субстрата.
Запишем в соответствии с законом действия масс кинетические уравнения для элементарных стадий ферментативной реакции.
Скорость образования фермент-субстратного комплекса V1равна
V1=k1[E][S],
Концентрация субстрата, как правило, гораздо больше, чем концентрация фермента:
[S]>>[E].
Поэтому можно считать, что концентрация субстрата в ходе ферментативной реакции практически не меняется и равна начальной концентрации:
[S] = [S]0=const.
Текущая концентрация фермента равна:
[E] = [E]0– [ES].
Таким образом, скорость образования фермент-субстратного комплекса определяется уравнением:
V1=k1([E]0– [ES])[S]0.
Скорость распада фермент-субстратного комплекса на фермент и субстрат V-1равна:
V-1=k-1[ES].
Скорость распада фермент-субстратного комплекса на фермент и продукт V2определяется уравнением:
V2=k2[ES]. (1)
Стадия распада фермент-субстратного комплекса на продукт и фермент является лимитирующей и определяет скорость процесса в целом.
Уравнение (1) не может быть использовано для описания кинетики ферментативной реакции, так как величину [ES] нельзя измерить. Необходимо выразить [ES] через начальные концентрации фермента и субстрата. Для этого допускают, что процесс протекает пристационарном состоянии. Это означает, что [ES] =const, поскольку скорость его образование равна скорости его распада:
V1 = V-1 + V2
Тогда k1([E]0 – [ES])[S]0 = k-1[ES] + k2[ES].
Решим полученное уравнение относительно [ES]:
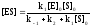 .
.
Разделив
числитель и знаменатель на k1и введя обозначение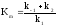 ,
получим:
,
получим:
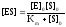 ,
гдеKm– константа Михаэлиса.
,
гдеKm– константа Михаэлиса.
Подстановка полученного выражения для концентрации фермент-субстратного комплекса в уравнение (1), дает основное уравнение кинетики ферментативных реакций - уравнение Михаэлиса-Ментен:
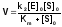 .
.
Вид кинетического уравнения показывает, что ферментативная реакция имеет 1-ый порядок по ферменту (рис.2а). Порядок реакции по субстрату зависит от его концентрации.
Если концентрация субстрата мала, то Km>>[S]0, и уравнение Михаэлиса-Ментен принимает вид:
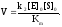
Т. е., при малых концентрациях S реакция имеет 1-ый порядок по субстрату (рис.12.8)
Если концентрация
субстрата велика, то Km<<
[S]0, и уравнение
Михаэлиса-Ментен принимает вид: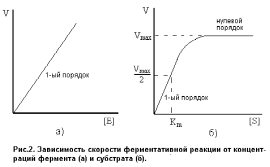
V=k2[E]0.
Т. е., при высоких концентрациях Sреакция имеет нулевой порядок по субстрату. Это означает, что при высокой концентрации субстрата все молекулы фермента связаны в фермент-субстратный комплекс, и дальнейшее увеличение концентрации субстрата не влияет на скорость реакции. Скорость ферментативной реакции принимает максимально возможное в данных условиях значение:
Vmax=k2[E]0.
Подставив значение Vmaxв уравнение Михаэлиса-Ментен, получим:
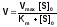 .
.
Km,k2иVmax– основные характеристики ферментативной реакции. Рассмотрим физический смысл величинKmиk2.
Решив
уравнение Михаэлиса-Ментен относительно
Km,
получим: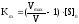 .
.
Если
V=1/2Vmax,
тоKm=[S]0.
Таким образом, константа Михаэлиса
численно равна концентрации субстрата,
при которой скорость ферментативной
реакции достигает половины максимального
значения. Константа Михаэлиса измеряется
в моль/л и принимает значения: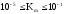 .
.
Из уравнения для максимальной скорости ферментативной реакции следует, что
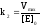 .
.
Величину
k2называютмолекулярной
активностьюиличислом оборотов
фермента. Она численно равна числу
молекул субстрата, которое превращается
под действием одной молекулы фермента
в единицу времени. Константаk2измеряется в мин-1и принимает
значения: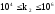 .
.
