
- •1. Белки и их основные признаки
- •2. Биологические функции белков
- •3. Аминокислотный состав белков
- •5.Классификация аминокислот в соответствии с полярностью их r-групп.
- •7. Классификация белков по растворимости
- •8. Классификация белков по форме молекул. Понятие о простых и сложных белках. Доменная структура белков.
- •9. Первичная структура белков. Зависимость конформации белков от их первичной структуры. Связь первичной структуры с функцией. Наследственные протеинопатии
- •Пространственное расположение полипептидных цепей (Конформация пептидных цепей в белках)
- •11.Вторичная структура белка. Типы вторичной структуры. Характеристика связей, стабилизирующих вторичную структуру.
- •12.Третичная структура белка. Характеристика связей, стабилизирующих третичную структуру. Денатурация белков.
12.Третичная структура белка. Характеристика связей, стабилизирующих третичную структуру. Денатурация белков.
определяется взаимодействием боковых заместителей пептидной цепи. Для фибриллярных белков трудно выделить общие закономерности в образовании третичных структур. Что касается глобулярных белков, то такие закономерности существуют, и мы их рассмотрим. Третичная структура глобулярных белков образуется путем дополнительного складывания пептидной цепи, содержащей -структуры, -спирали и нерегулярные участки, так , что гидрофильные боковые группы аминокислотных остатков оказываются на поверхности глобулы, а гидрофобные боковые группы спрятаны вглубь глобулы, иногда образуют гидрофобный карман.
Силы, стабилизирующие третичную структуру белка.
Электростатическое взаимодействие между разно заряженными группами, крайний случай - ионные взаимодействия.
Водородные связи, возникающие между боковыми группами полипептидной цепи.
Гидрофобные взаимодействия.
Ковалентные взаимодействия (образование дисульфидной связи между двумя остатками цистеина с образованием цистина). Образование дисульфидных связей приводит к тому, что удаленные области полипептидной молекулы сближаются и фиксируются. Дисульфидные связи разрушаются под действием восстановителей. Это свойство используется для химической завивки волос, которые почти полностью представляют собой белок кератин, пронизанный дисульфидными связями.
Характер пространственной укладки определяется аминокислотным составом и чередованием аминокислот в полипептидной цепи (первичной структурой). Следовательно, каждый белок имеет только одну пространственную структуру, соответствующую его первичной структуре. Небольшие изменения конформации белковых молекул происходят при взаимодействии с другими молекулами. Эти изменения порой играют огромную роль при функционировании белковых молекул. Так, при присоединении молекулы кислорода к гемоглобину несколько изменяется конформация белка, что приводит к эффекту кооперативного взаимодействия при присоединении остальных трех молекул кислорода. Такое изменение конформации в лежит в основе теории индуцирующего соответствия при объяснении групповой специфичности некоторых ферментов.
Кроме ковалентной дисульфидной все остальные связи, стабилизирующие третичную структуру, являются по своей природе слабыми и легко разрушаются. При разрыве большого числа связей, стабилизирующих пространственную структуру белковой молекулы, упорядоченная уникальная для каждого белка конформация нарушается, при этом часто теряется биологическая активность белка. Такое изменение в пространственном строении называется денатурацией.
Способность к специфическим взаимодействиям как основа биологической активности белков. Ингибиторы функции белков.
В основе функционирования белка лежит его способность к взаимодействию с каким-либо другим веществом - лигандом. Лигандом может быть как низкомолекулярное вещество, так и макромолекула, в том числе и другой белок. Лиганд присоединяется к определенному участку глобулярной молекулы - активному центру. Активный центр формируется в ходе образования третичной структуры белка, поэтому при денатурации белка (когда разрушается его третичная структура) белки теряют свою активность. Специфичность взаимодействия белка и лиганда объясняется комплиментарностью пространственной структуры активного центра и молекулы лиганда. Взаимодействие между белком P и лигандом L описывается уравнениями:
P + L PL
![]() Ксв
определяет сродство белка к данному
лиганда, чем больше Ксв,
тем больше сродство. На специфичности
взаимодействия белков и лигандов
основан методов разделения белков -
аффинная
хроматография.
Ксв
определяет сродство белка к данному
лиганда, чем больше Ксв,
тем больше сродство. На специфичности
взаимодействия белков и лигандов
основан методов разделения белков -
аффинная
хроматография.
Ингибиторы функций белков
Учитывая, что различные лиганды отличаются Ксв, всегда можно подобрать вещество, похожее по структуре на природный лиганд, но имеющий большее значение Ксв с данным белком. Например, СО имеет Ксв в 100 раз больше, чем О2 с гемоглобином, поэтому достаточно 0,1% СО в воздухе, чтобы заблокировать большое количество молекул гемоглобина. По такому же принципу действуют многие лекарства. Например, дитилин.
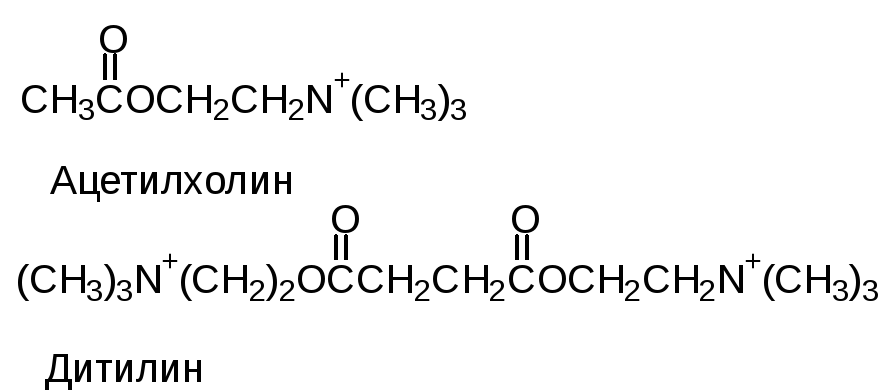 Ацетилхолин
- медиатор передачи нервных импульсов
на мышцу. Дитилин блокирует белок-рецептор,
с которым связывается ацетилхолин и
создает эффект парализации.
Ацетилхолин
- медиатор передачи нервных импульсов
на мышцу. Дитилин блокирует белок-рецептор,
с которым связывается ацетилхолин и
создает эффект парализации.
Строение олигомерных белков на примере гемоглобина. Характеристика связей, стабилизирующих четвертичную структуру
Под четвертичной структурой белка подразумевают способ укладки в пространстве отдельных полипептидных цепей, обладающих первичной, вторичной и третичной структурой и формирование единого в структурном и функциональном отношении макромолекулярного образования. Каждая отдельная полипептидная (протомер или субъединица) не обладают биологической активностью, а образовавшаяся молекула - олигомер обладает биологической активностью. Четвертичная структура белка уникальна, как и другие уровни организации. Четвертичная структура поддерживается нековалентными взаимодействиями между контактными площадками протомеров.
Четвертичная структура белков - еще один пример удивительной мудрости природы. Докажем это на примере функционирования двух белков: миоглобина, обладающего только третичной структурой и гемоглобина, обладающего четвертичной структурой. Гемоглобины представляют собой тетрамерные белки, молекулы которых образованы различными типами полипептидных цепей (, , , , S). В состав молекулы входит по две цепи двух разных видов. Длина - и -цепей примерно одинакова (- 141 а.к., - 146 а.к.). Наиболее распространенные гемоглобины имеют следующую тетрамерную структуру: HbA (нормальный гемоглобин взрослого человека) - 22,; HbF (фетальный гемоглобин) -22; HbS (гемоглобин при серповидноклеточной анемии) - 2S2; HbA2 (минорный гемоглобин человека) - 22.
Четвертичная структура наделяет гемоглобин дополнительными важными особенностями, которые способствуют выполнению гемоглобином уникальной биологической функцией и обеспечивают возможность строгой регуляции его свойств. Гемоглобин обладает аллостерическими свойствами (от греч. - аллос - другой, стерос - пространство). На его примере можно лучше понять свойства других аллостерических белков, поэтому рассмотрим работу гемоглобина подробнее.
Миоглобин способен запасать кислород, а гемоглобин обеспечивает его транспорт. Вторичная и третичная структуры миоглобина и протомеров гемоглобина очень сходны. Простетической группой этих белков является гем. Гем расположен в гидрофобном кармане пептидной цепи каждого протомера, т.е. окружен неполярными остатками, за исключением 2-х остатков гистидина, расположенных по обе стороны плоскости гема. С одним из них (проксимальным гистидином) Fe2+ связано координационно по 5 координационному положению. Второй (дистальный) гистидин расположен почти напротив проксимального, но несколько дальше, поэтому 6-ое координационное положение Fe2+ остается свободным. В неоксигенированном миоглобине или протомере гемоглобина атом железа выступает из плоскости кольца в направлении проксимального гистидина на 0,03 нм. В оксигенированном миоглобине (протомере гемоглобина) кислород занимает 6-ое координационное положение атома железа, при этом Fe2+ не меняет степени окисления. Такого эффекта позволяет достичь гидрофобное белковое окружение гема, которое не позволяет кислороду слишком сблизиться с железом, чтобы его окислить. Железо, координируя О2, выступает из плоскости кольца лишь на 0,01 нм. Т.о., оксигенирование миоглобина сопровождается смещением атома железа и, следовательно, проксимального гистидина и ковалентно связанных с ним аминокислотных остатков в направлении плоскости кольца. В результате белковая глобула меняет конформацию. Эти изменения приводят в гемоглобине сопровождаются разрывом солевых связей между протомерами, что облегчает связывание следующих молекул О2. Тем самым проявляется эффект кооперативного связывания.
Особенности функционирования олигомерных белков (кооперативное взаимодействие субъединиц, аллостерическая регуляция) на примере гемоглобина,
Четвертичная структура наделяет гемоглобин дополнительными важными особенностями, которые способствуют выполнению гемоглобином уникальной биологической функцией и обеспечивают возможность строгой регуляции его свойств. Гемоглобин обладает аллостерическими свойствами (от греч. - аллос - другой, стерос - пространство). На его примере можно лучше понять свойства других аллостерических белков, поэтому рассмотрим работу гемоглобина подробнее.
Миоглобин способен запасать кислород, а гемоглобин обеспечивает его транспорт. Вторичная и третичная структуры миоглобина и протомеров гемоглобина очень сходны. Простетической группой этих белков является гем. Гем расположен в гидрофобном кармане пептидной цепи каждого протомера, т.е. окружен неполярными остатками, за исключением 2-х остатков гистидина, расположенных по обе стороны плоскости гема. С одним из них (проксимальным гистидином) Fe2+ связано координационно по 5 координационному положению. Второй (дистальный) гистидин расположен почти напротив проксимального, но несколько дальше, поэтому 6-ое координационное положение Fe2+ остается свободным. В неоксигенированном миоглобине или протомере гемоглобина атом железа выступает из плоскости кольца в направлении проксимального гистидина на 0,03 нм. В оксигенированном миоглобине (протомере гемоглобина) кислород занимает 6-ое координационное положение атома железа, при этом Fe2+ не меняет степени окисления. Такого эффекта позволяет достичь гидрофобное белковое окружение гема, которое не позволяет кислороду слишком сблизиться с железом, чтобы его окислить. Железо, координируя О2, выступает из плоскости кольца лишь на 0,01 нм. Т.о., оксигенирование миоглобина сопровождается смещением атома железа и, следовательно, проксимального гистидина и ковалентно связанных с ним аминокислотных остатков в направлении плоскости кольца. В результате белковая глобула меняет конформацию. Эти изменения приводят в гемоглобине сопровождаются разрывом солевых связей между протомерами, что облегчает связывание следующих молекул О2. Тем самым проявляется эффект кооперативного связывания.
Изофункциональные белки. Изменение белкового состава организма. Протеинопатии.
Изофункциональные белки
Белок, выполняющий определенную функцию в клетке, может быть представлен несколькими формами - изофункциональными белками, или изоферментами. такие белки хоть и выполняют одинаковую функцию, но отличаются, константой связывания, что приводит к некоторым различиям в функциональном отношении. Например, в эритроцитах человека обнаружено несколько форм гемоглобина: HbA (96%), HbF (2%), HbA2(2%). Все гемоглобины представляют собой тетрамеры, построенные из протомеров , , , (HbA -22, HbF - 22, HbA2 - 22). Все протомеры сходны между собой по первичной структуре, и очень большое сходство наблюдается по вторичной и третичной структурам. Все формы гемоглобинов предназначены для переноса кислорода в клетки тканей, но HbF, например, имеет большее сродство к кислороду, чем HbA. HbF характерен для эмбриональной стадии развития человека. Он способен отнимать кислород у HbA, что обеспечивает нормальное снабжение кислородом плода.
Изобелки - это результат наличия более чем одного структурного гена в генофонде вида.
Изменения белкового состава организма
Белковый состав взрослого человека более или менее постоянен, однако возможны некоторые изменения содержания некоторых белков в зависимости от физиологической активности, состава пищи, циклические изменения (биоритмы). При болезнях белковый состав тканей изменяется. Эти проявления болезней называют протеинпатиями. Различают протеинпатии двух типов - наследственные и приобретенные. Наследственные - результат повреждения в генетическом аппарате организма (например, HbS). Приобретенные сопровождают любую болезнь. При приобретенных первичная структура белка не изменяется, изменяется количество белка и его распределение в тканях. Нарушение этих параметров в тканях и жидкостях организма позволяют поставить правильный диагноз.
