
- •Липиды. Жирорастворимые витамины. Клеточные мембраны: их структура и функции. Транспорт веществ и передача сигнала через мембраны.
- •Жирорастворимые витамины
- •Витамин а(ретинол, антиксерофтальмический)
- •Биохимические функции витамина а
- •1. Регуляция экспрессии генов
- •2. Участие в акте зрения
- •Витамин д(кальциферол, антирахитический)
- •Витамин е(токоферол, антистерильный или антиоксидантный)
- •Витамин к(нафтохинон, антигеморрагический)
- •Мембраны: их строение и функционирование
- •Строение и состав мембран
- •Перенос вещества и информации через мембраны
- •Трансмембранная передача сигнала
- •ЦАмф – как вторичный гормональный посредник
- •Вторичные посредники липидной природы
- •ЦГмф – как вторичный гормональный посредник
ЦАмф – как вторичный гормональный посредник
Роль цАМФ в качестве вторичного посредника установлена амер. ученым Сазерлендом в 1957 году. В 1971 году за это открытие и разработку теории о вторичном гормональном посреднике ему присуждена Нобелевская премия.
Реализация гормональных эффектов через цАМФ представляется следующим образом. Гормон изменяет уровень цАМФ в клетке, модулируя активность аденилатциклазы (АЦ). Аденилатциклаза встроена в мембрану и состоит из 3-х компонентов:
1) рецепторов, локализованных на наружной поверхности плазматической мембраны. При этом все рецепторы можно разделить на 2 типа: 1) Rs– повышающие уровень цАМФ путем активации АЦ и 2)Ri– понижающие уровень цАМФ путем ингибирования АЦ.
2) регуляторных белков (GsиGi), действующих как трансдуктор между соответствующими рецепторами и каталитической субъединицей АЦ. При этом регуляторные белки состоят из 3-х субъединиц:,и.и-субъединицы у всехG-белков одинаковы, а-субъединицы различны.
3) каталитической субъединицы АЦ или собственно АЦ, которая обладает ферментативной активностью и катализирует реакцию:
АТФ + Н2ОцАМФ + Н4Р2О7
Функционирование аденилатциклазной системы:
комплекс Hs-Rsвзаимодействует сGs-белком, активируя его, что выражается в замещении ГДФ на ГТФ, после чего-субъединица отделяется от комплекса из-субъединиц и активирует каталитическую субъединицу АЦ. Последняя катализирует образование цАМФ из АТФ.
О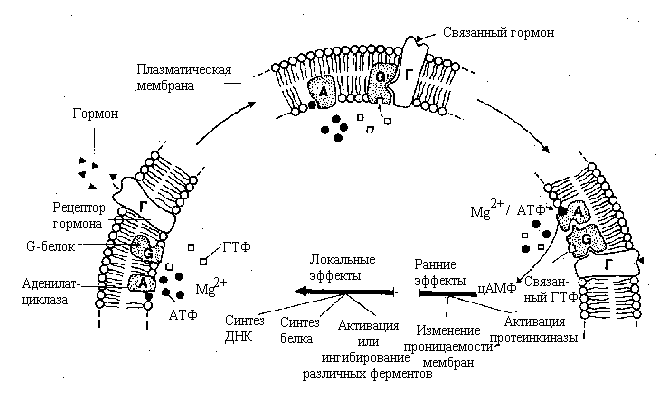 бразовавшийся
цАМФ реализует свои эффекты через
цАМФ-зависимую протеинкиназу (ПК А).
Последняя представляет собой тетрамер,
состоящий из 2 регуляторных (R)
и 2 каталитических (С) субъединиц.
Присоединение цАМФ кR-субъединицам
вызывает диссоциацию тетрамера, при
этом образующийся димер из двух
С-субъединиц является активной формой
ПК А. ПК А фосфорилирует белки по остаткам
серина и треонина, изменяя их функциональную
активность.
бразовавшийся
цАМФ реализует свои эффекты через
цАМФ-зависимую протеинкиназу (ПК А).
Последняя представляет собой тетрамер,
состоящий из 2 регуляторных (R)
и 2 каталитических (С) субъединиц.
Присоединение цАМФ кR-субъединицам
вызывает диссоциацию тетрамера, при
этом образующийся димер из двух
С-субъединиц является активной формой
ПК А. ПК А фосфорилирует белки по остаткам
серина и треонина, изменяя их функциональную
активность.
Прекращение действия цАМФ связано с функционированием 3 ферментов: 1) фосфодиэстеразы (ФДЭ) циклических нуклеотидов, гидролизующей цАМФ и переводящей его в ациклическую форму 2) фосфопротеинфосфатазы, катализирующей дефосфорилирование белков и переводящей их тем самым в исходное функциональное состояние и 3) ГТФазы, катализирующей гидролиз ГТФ до ГДФ, и тем самым вызывающей диссоциацию комплекса α-субъединица Gs-белка – аденилатциклаза, что переводит последнюю в неактивную форму.
Взаимодействие Hicо специфическим рецептором приводит к образованию комплексаHi-Riи активацииGi-белка.-субъединицаGi-белка отделяется от-субъединиц, в результате чего последние приобретают способность взаимодействовать с-субъединицейGs-белка и, таким образом, ингибировать каталитическую субъединицу АЦ.
Вторичные посредники липидной природы
Их предшественником является фосфатидилинозитолдифосфат (ФИФ2), образующийся в результате фосфорилирования фосфатидилинозитола (ФИ), локализованного преимущественно в обращенном к цитоплазме слое клеточной мембраны. Гидролиз этого фосфолипида под действием фосфолипазы С (ФЛ С) приводит к образованию 2-х вторичных посредников липидной природы: ИФ3и ДАГ.
Гормон, связываясь со специфическим рецептором, активирует Gq-белок. При этом ГТФ замещает вGq-белке ГДФ,-субъединица отделяется от ингибиторных βγ-субъединиц и присоединяется к фосфолипазе С, переводя ее в активную форму. Последняя гидролизует ФИФ2с образованием ДАГ и ИФ3. ИФ3хорошо растворим в воде, поэтому он диффундирует в цитоплазму, взаимодействует со специфическим рецептором на цистернах эндоплазматического ретикулума и вызывает освобождение депонированного в них Са2+. ДАГ плохо растворим в воде, поэтому он остается в пределах липидного слоя мембраны и взаимодействует с доменом протеинкиназы С, чувствительным к ДАГ. Результатом является повышение сродства протеинкиназы С к Са2+. Активированная Са2+протеинкиназа С катализирует фосфорилирование белков-мишеней по остаткам серина и треонина, изменяя их функциональное состояние.
