
Метод валентных связей.
В основе метода ВС лежат следующие положения:
1. Ковалентная химическая связь образуется двумя электронами с противоположно направленными спинами, причем эта электронная пара принадлежит двум атомам. Комбинации таких двухэлектронных двухцентровых связей, отражающие электронную структуру молекулы, получили название валентных схем.
2. Ковалентная связь тем прочнее, чем в большей степени перекрываются взаимодействующие электронные облака.
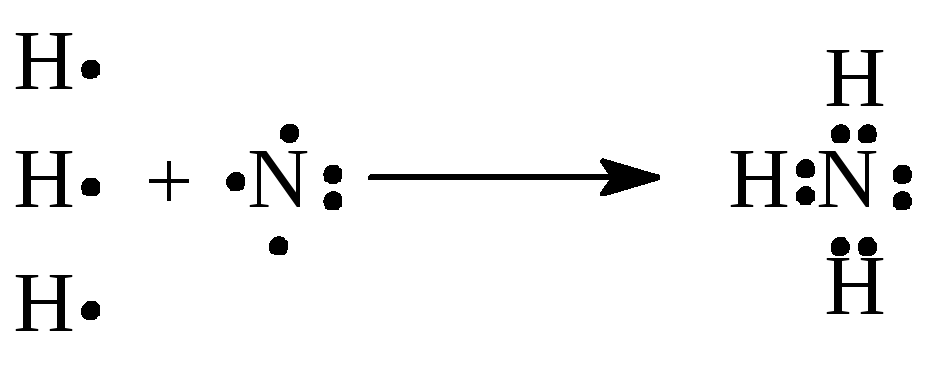
Для наглядного изображения валентных схем обычно пользуются следующим способом: электроны, находящиеся во внешнем электронном слое обозначают точками, располагаемыми вокруг химического символа атома. Общие для двух атомов электроны показывают точками, помещаемыми между их химическими символами; двойная или тройная связь обозначается соответственно двумя или тремя парами общих точек:
H:
1s1;
![]()
N:
1s22s2p3;
C:
1s22s2p4
![]()
Из приведенных схем видно, что каждая пара электронов, связывающая два атома, соответствует одной черточке, изображающей ковалентную связь в структурных формулах:
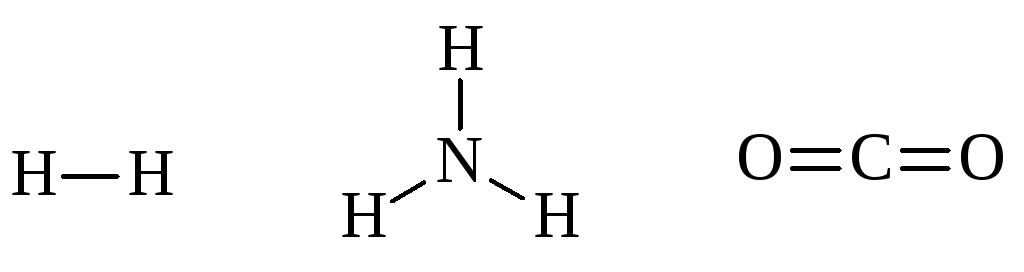
Число общих электронных пар, связывающих атом данного элемента с другими атомами, или, иначе говоря, число образуемых атомом ковалентных связей, называется ковалентностью по методу ВС. Так, ковалентность водорода равна 1, азота – 3.
По способу перекрывания электронных облаков, связи бывают двух видов: - связь и - связь.
- связь возникает при перекрывании двух электронных облаков по оси, соединяющей ядра атомов.
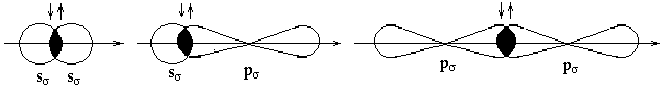
Рис. 15. Схема образования - связей.
- связь образуется при перекрывании электронных облаков по обе стороны от линии, соединяющей ядра взаимодействующих атомов.
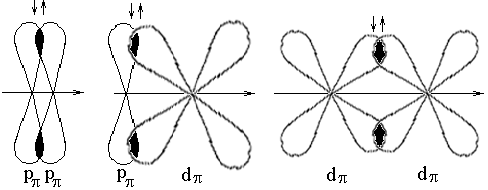
Рис. 16. Схема образования - связей.
ОСНОВНЫЕ ХАРАКТЕРИСТИКИ КОВАЛЕНТНОЙ СВЯЗИ.
1. Длина связи, ℓ. Это минимальное расстояние между ядрами взаимодействующих атомов, которое соответствует наиболее устойчивому состоянию системы.
2. Энергия связи, Emin – это то количество энергии, которое необходимо затратить для разрыва химической связи и для удаления атомов за пределы взаимодействия.
3. Дипольный момент связи,
![]() ,
=qℓ.
Дипольный момент служит количественной
мерой полярности молекулы. Для неполярных
молекул дипольный момент равен 0, для
неполярных не равен 0. Дипольный момент
многоатомной молекулы равен векторной
сумме диполей отдельных связей:
,
=qℓ.
Дипольный момент служит количественной
мерой полярности молекулы. Для неполярных
молекул дипольный момент равен 0, для
неполярных не равен 0. Дипольный момент
многоатомной молекулы равен векторной
сумме диполей отдельных связей:
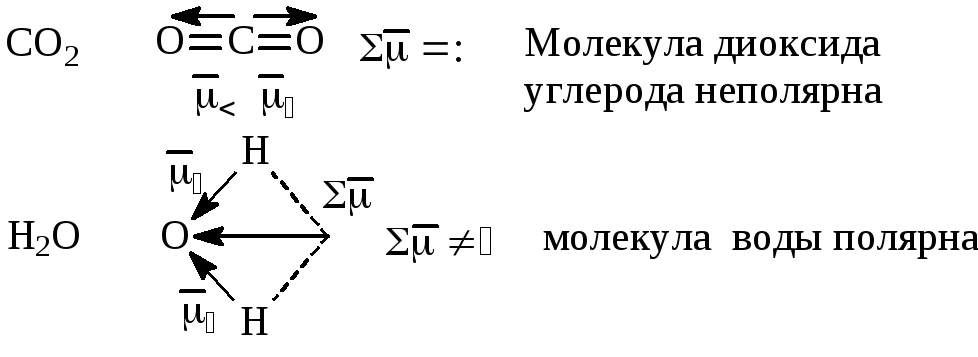
4. Ковалентная связь характеризуется направленностью. Направленность ковалентной связи определяется необходимостью максимального перекрывания в пространстве электронных облаков взаимодействующих атомов, которые приводят к образованию наиболее прочных связей.
Так как эти -связи строго ориентированы в пространстве, в зависимости от состава молекулы они могут находиться под определенным углом друг к другу – такой угол называется валентным.
Двухатомные молекулы имеют линейное строение. Многоатомные молекулы имеют более сложную конфигурацию. Рассмотрим геометрию различных молекул на примере образования гидридов.
1. VI группа, главная подгруппа (кроме кислорода), Н2S, Н2Sе, Н2Те.
Н 1s1
S 1s22s2р63s2р4
У водорода в образовании связи участвует электрон с s-АО, у серы – 3ру и 3рz. Молекула Н2S имеет плоское строение с углом между связями 900..
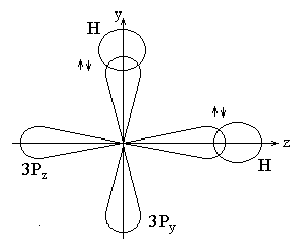
Рис 17. Строение молекулы Н2Э
2. Гидриды элементов V группы, главной подгруппы: РН3, АsН3, SbН3.
Н 1s1
Р 1s22s2р63s2р3.
В образовании связи принимают участие: у водорода s-АО, у фосфора - ру, рх и рz АО.
Молекула РН3 имеет форму тригональной пирамиды (в основании – треугольник).
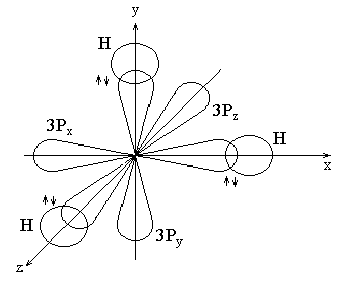
Рис 18. Строение молекулы ЭН3
5. Насыщаемость ковалентной связи - это число ковалентных связей, которые может образовывать атом. Оно ограничено, т.к. элемент обладает ограниченным количеством валентных электронов. Максимальное число ковалентных связей, которые может образовывать данный атом в основном или возбуждённом состоянии, называется его ковалентностью.
Пример: водород – одноковалентен, кислород – двухковалентен, азот – трёхковалентен и т. д.
Некоторые атомы могут повышать свою ковалентность в возбуждённом состоянии за счёт разъединения спаренных электронов.
Пример. Be0 1s22s2
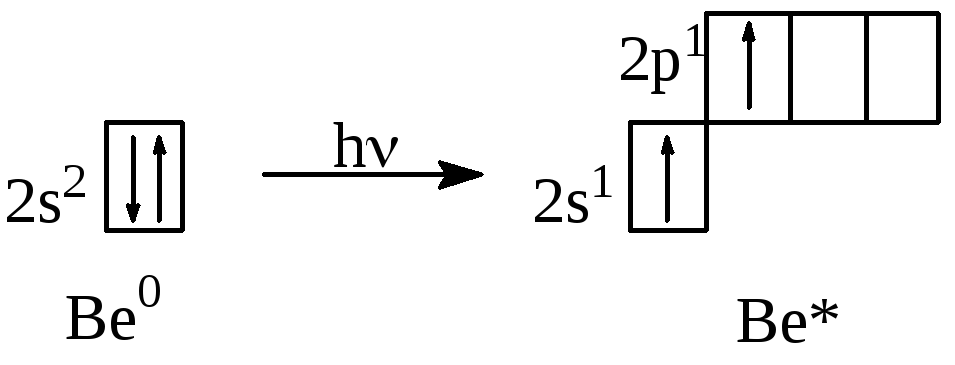
У атома бериллия в возбужденном состоянии один валентный электрон находится на 2p-АО и один электрон на 2s-АО, то есть ковалентность Be0 = 0 а ковалентность Be* = 2. В ходе взаимодействия происходит гибридизация орбиталей.
Гибридизация - это выравнивание энергии различных АО в результате смешения перед химическим взаимодействием. Гибридизация - условный прием, позволяющий предсказать структуру молекулы при помощи комбинации АО. В гибридизации могут принимать участие те АО, энергии которых близки.
Каждому виду гибридизации соответствует определенная геометрическая форма молекул.
В случае гидридов элементов II группы главной подгруппы в образовании связи участвуют две одинаковые sр-гибридные орбитали. Подобный тип связи называется sр-гибридизация.
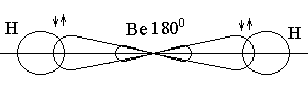
Рис 19. Молекула ВеН2. sp-Гибридизация.
sp-Гибридные орбитали имеют несимметричную форму, в сторону водорода направлены удлиненные части АО с валентным углом, равным 180о. Поэтому молекула ВеН2 имеет линейное строение (рис. ).
Строение молекул гидридов элементов III группы главной подгруппы рассмотрим на примере образования молекулы BH3.
B0 1s22s2p1
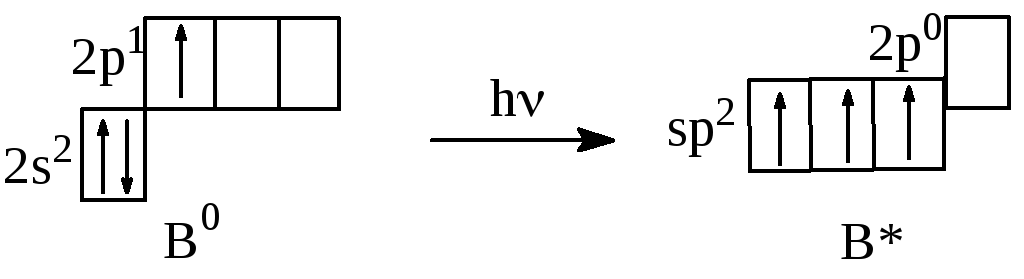
Ковалентность B0 = 1, ковалентность B* = 3.
В образовании связей принимают участие три sр-гибридные орбитали, которые образуются в результате перераспределения электронных плотностей s-АО и двух р-АО. Такой тип связи называется sр2 - гибридизацией. Валентный угол при sр2 - гибридизации равен 1200, поэтому молекула ВН3 имеет плоское треугольное строение.
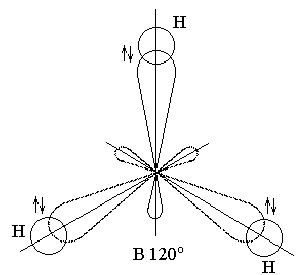
Рис.20. Молекула BH3. sp2-Гибридизация.
На примере образования молекулы СH4 рассмотрим строение молекул гидридов элементов IV группы главной подгруппы.
C0 1s22s2p2
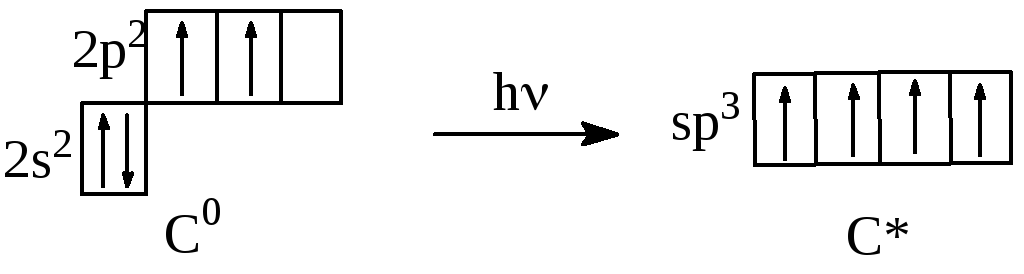
Ковалентность C0 = 2, ковалентность C* = 4.
У углерода в образовании химической связи участвуют четыре sр-гибридные орбитали, образованные в результате перераспределения электронных плотностей между s-АО и тремя р-АО. Форма молекулы СН4 - тетраэдр, валентный угол равен 109о28`.
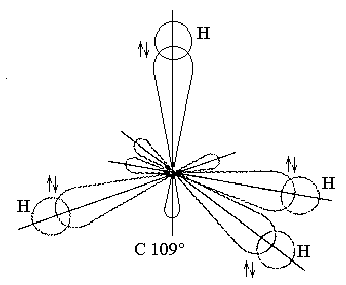
Рис. 21. Молекула СН4. sp3-Гибридизация.
Исключениями из общего правила являются молекулы Н2О и NН3.
В молекуле воды углы между связями равны 104,5о. В отличии от гидридов других элементов этой группы, вода имеет особые свойства, она полярна, диамагнитна. Все это объясняется тем, что в молекуле воды тип связи sр3. То есть в образовании химической связи участвуют четыре sр - гибридные орбитали. На двух орбиталях находится по одному электрону, эти орбитали взаимодействуют с водородом, на двух других орбиталях находится по паре электронов. Наличие этих двух орбиталей и объясняет уникальные свойства воды.
В молекуле аммиака углы между связями равны примерно 107,3о, то есть форма молекулы аммиака - тетраэдр, тип связи sр3. В образовании связи у молекулы азота принимает участие четыре гибридные sр3-орбитали. На трех орбиталях находится по одному электрону, эти орбитали связаны с водородом, на четвертой АО находится неподеленная пара электронов, которая обуславливает уникальность молекулы аммиака.
