
- •Электрохимия.
- •Растворы электролитов.
- •Электролитическая диссоциация воды
- •Водородный электрод. Измерение электродных потенциалов. Стандартные электродные потенциалы.
- •2). Предположим, что исследуемый металл неактивен, например медь. Тогда происходит процесс окисления водорода – анодный процесс. Водородный электрод в этом случае будет являться анодом.
- •Равновесные электрохимические системы.
- •Окислительно-восстановительные реакции.
- •Электролиз
Равновесные электрохимические системы.
Существует 3 типа электрохимических цепей.
1 Система первого рода - физические цепи, состоящие из двух электродов, одинаковых по химическому составу и по природе электродных процессов, опущенных в раствор электролита. Различаются по физическому составу
2 Система второго рода - концентрационные цепи, состоят из двух электродов, одинаковых по физическому и химическому составу и по природе электродных реакций. Различаются концентрацией ионных проводников.
3 Система третьего рода - химические цепи, состоят из двух электродов, различных по химическому и физическому составу.
Любой гальванический элемент состоит из двух электродов (электронные проводники, опущенные в растворы солей, (ионные проводники), соединенных между собой электролитическим ключом.
Условная запись гальванического элемента
(-)анод электролит электролит катод (+)
ХИМИЧЕСКИЕ ЦЕПИ.
Примером простой химической цепи является свинцовый аккумулятор.
(-)Рb,PbSO42SO4Pb,PbO2(+)
Процесс накопления химической энергии под действием приложенной извне электрической энергии - заряд. Процесс превращения химической энергии - разряд.
Схема разряда:
А: Рb + SО42- - 2е = РbSО4
К: РbО2 + 4Н+ + SО42- + 2е = РbSО4 + 2Н2О
Уравнение Нернста для свинцового аккумулятора:
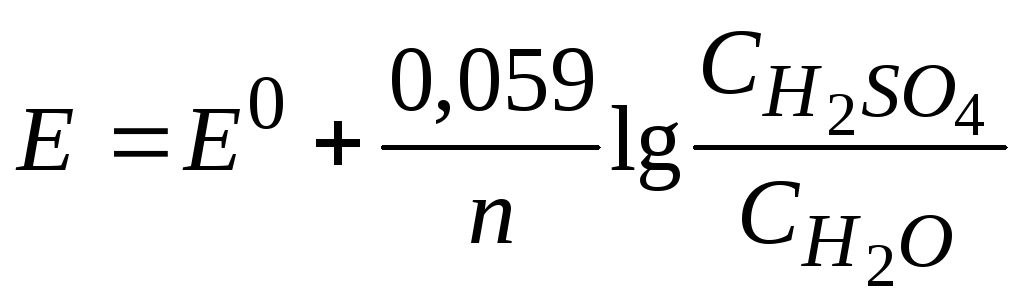
При разряде ЭДС гальванического элемента падает до 0, при заряде процессы окисления-восстановления идут в обратном направлении, происходит накопление химической энергии и аккумулятор может работать как гальванический элемент.
Примером сложной химической цепи является гальванический элемент Даниэля – Якоби, рассмотренный выше.
Окислительно-восстановительные реакции.
Это процессы, которые происходят с изменением степени окисления элементов. Вещество, теряющее электроны, называется восстановителем, вещество, приобретающее ионы, называется окислителем. Процесс отдачи электронов - окисление, процесс приема электронов - восстановление.
Правила написания окислительно-восстановительных процессов.
1. Определяют элементы, которые изменяют степень окисления.
2. Отдельно записывают процессы окисления и восстановления (электронно-ионный баланс), учитывая при этом:
а) обычные правила написания уравнений,
б) среду раствора, уравнивание в кислой среде производится с помощью ионов Н+, в нейтральной и щелочной - с помощью ОН- и Н2О,
в) в кислой среде вода добавляется в той части уравнения, где кислорода меньше, в щелочной среде - там, где кислорода больше.
г) количество вещества и количество зарядов в обеих частях уравнения должно быть одинаково.
3. С помощью дополнительных коэффициентов уравнивается число принятых и число отданных электронов.
4. Если элемент, изменяющий степень окисления, входит в состав сложного иона, нерастворимого соединения или кислотного остатка, то записывается процесс окисления или восстановления этого сложного иона.
В гальваническом элементе можно измерить электродные потенциалы полуреакций. Например: MnO4– + e = MnO42– ;
В таблицах приведены
стандартные электродные потенциалы
для полуреакций восстановления:
![]() =
+0,56В. Значение электродного
потенциала при восстановлении равно
значению при окислении.
=
+0,56В. Значение электродного
потенциала при восстановлении равно
значению при окислении.
Пример:
2KMnO4 + 2NaOH + Na2SO3 = K2MnO4 + Na2MnO4 + NaSO4 + H2O
2 MnO4–
+ e = MnO42–
восстановление MnO4–
– окислитель
MnO4–
+ e = MnO42–
восстановление MnO4–
– окислитель
1 SO32– + 2OH– – 2e = SO42– + H2O окисление SO32– – восстановитель

2MnO4– + SO32– + 2OH– = 2MnO42– + SO42– + H2O
![]() =
=
![]() = + 0,56B,
= + 0,56B, ![]() = – 0,93В.
= – 0,93В.
Более сильными восстановителями являются вещества, имеющие наименьший электродный потенциал.
Если эту реакцию проводить в гальваническом элементе, то работа гальванического элемента определяется так: Amax = nFE, где E = EK – EA . На катоде происходит восстановление окислителя, значит, Ек = Еокисл., соответственно, Еа= Евосстан.
E = Eокисл. – Eвосстан. = 0,56 + 0,93 =1,49В.
Работа происходит за счёт убыли свободной энергии, следовательно:
Amax = – G; G = - nFE .
Если при этом E > 0, то G < 0 – условие самопроизвольности окислительно-восстановительного процесса. E > 0 если Eокисл. > Eвосстан., т. о. самопроизвольность протекания процесса можно определить без проведения реакции.
