
- •Электрохимия.
- •Растворы электролитов.
- •Электролитическая диссоциация воды
- •Водородный электрод. Измерение электродных потенциалов. Стандартные электродные потенциалы.
- •2). Предположим, что исследуемый металл неактивен, например медь. Тогда происходит процесс окисления водорода – анодный процесс. Водородный электрод в этом случае будет являться анодом.
- •Равновесные электрохимические системы.
- •Окислительно-восстановительные реакции.
- •Электролиз
Электрохимия.
План.
-
Общие положения электрохимии.
-
Растворы электролитов.
-
Электролитическая диссоциация воды.
-
Гальванический элемент. Элемент Даниэля – Якоби.
-
Возникновение электродных потенциалов.
-
Водородный электрод. Измерение электродных потенциалов. Стандартные электродные потенциалы.
-
Уравнение Нернста.
-
Электродный потенциал водородного электрода.
-
Классификация электрохимических систем.
-
Химические цепи.
-
Окислительно-восстановительные реакции.
-
Электролиз.
ОБЩИЕ ПОЛОЖЕНИЯ ЭЛЕКТРОХИМИИ.
Электрохимия - это наука, которая изучает процессы, протекающие благодаря электричеству, либо в процессе которых образуется электричество, т.е. взаимные переходы химической и электрической энергии.
Приведенная ниже реакция может быть проведена химическим и электрохимическим путем.
Fe3++Cu+ = Fe2++Cu2+
Химическая реакция.
1. Непосредственное столкновение участников приводит к тому, что путь электрона очень краток.
2. Столкновение происходит в любой части реакционной системы. Отсюда следует ненаправленность взаимодействия.
3. Энергетические эффекты выражаются в виде теплоты.
Электрохимическая реакция.
1. Путь электрона должен быть велик по сравнению с размерами электрона. Отсюда следует то, что участники реакции должны быть пространственно разделены.
2. Непосредственный контакт между участниками реакции заменяется на контакт с металлическими электродами.
3. Требуется реакционное пространство.
4. Электрод является катализатором - это приводит к снижению энергии активации процесса.
Составные части электрохимической системы:
1. электролиты - вещества, расплавы или растворы которых проводят электрический ток,
2. электроды - электронные проводники электрического тока,
3. внешняя цепь - металлические проводники, соединяющие электроды.
Растворы электролитов.
Теория электролитической диссоциации.
Теория предложена Аррениусом в 1883-1887 г. и в дальнейшем получила развитие в работах Менделеева и Каблукова.
Согласно этой теории, при растворении в воде электролита происходит распад его на противоположно заряженные ионы. Положительно заряженные ионы называются катионами; к ним относятся , например, ионы металлов и водорода (H+). Отрицательно заряженные ионы называются анионами, к ним принадлежат ионы кислотных остатков и гидроксид-ионы.
Процесс распада молекул веществ на ионы называется под действием полярных молекул растворителя , а также при их расплавлении называется электролитической диссоциацией. Распадаться на ионы могут только те молекулы, химическая связь в которых имеет достаточно высокую степень ионности.
Доля молекул, распавшихся на ионы называется степенью диссоциации и обычно обозначается .
![]() ,
где n - число
распавшихся молекул, N
- общее число молекул
,
где n - число
распавшихся молекул, N
- общее число молекул
– количественная характеристика электролитов:
>30% - сильные электролиты;
3%< >30% - элекролиты средней силы:
<3% - слабые электролиты.
К сильным электролитам относятся кислоты: HClO4, HCl, HNO3, HBr, H2SO4; гидроксиды щелочных и щелочноземельных металлов, многие соли с ионной кристаллической решеткой, хорошо растворимые в воде.
К электролитам средней силы - кислоты: HF, H3PO4, H2SO3; малорастворимые в воде гидроксиды металлов, различные соли.
Слабыми электролитами являются кислоты: H2CO3, H2S, HCN; большинство органических кислот, гидроксиды d-элементов, малорастворимые в воде соли.
Степени диссоциации различных электролитов приведены в соответствующих таблицах.
Второй количественной характеристикой электролитов является константа диссоциации. Связь Кд и можно рассмотреть на примере бинарного электролита. Бинарный электролит - это электролит, состоящий из однозарядного аниона и катиона.
![]()
С - общая концентрация раствора;
Са - концентрация недиссоциированных молекул;
С+ - концентрация катионов;
С– - концентрация анионов.
![]() ,
где С+ = С- = С
; Cа = (1-)С
,
где С+ = С- = С
; Cа = (1-)С
![]() - закон разбавления
Оствальда.
- закон разбавления
Оствальда.
Степень диссоциации зависит от концентрации электролита, температуры и давления.
Константа диссоциации Kд зависит от температуры и давления.
По способности диссоциировать различают 4 класса электролитов:
1. Основания диссоциируют с образованием ОН– и основного остатка. Диссоциация протекает ступенчато и обратимо.
![]() - диссоциация по
первой ступени.
- диссоциация по
первой ступени.
![]()
![]() - по второй ступени
- по второй ступени
![]()
2. Кислоты диссоциируют ступенчато и обратимо с образованием Н+ и кислотного остатка.
![]() - 1
ступень;
- 1
ступень;
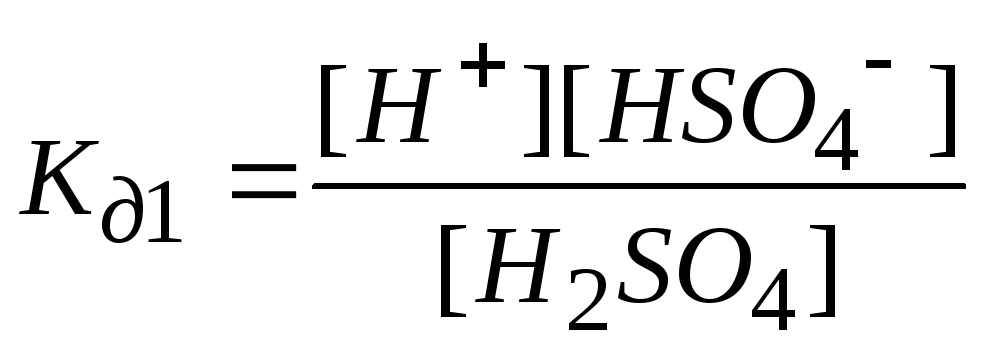
![]() - 2
ступень.
- 2
ступень.
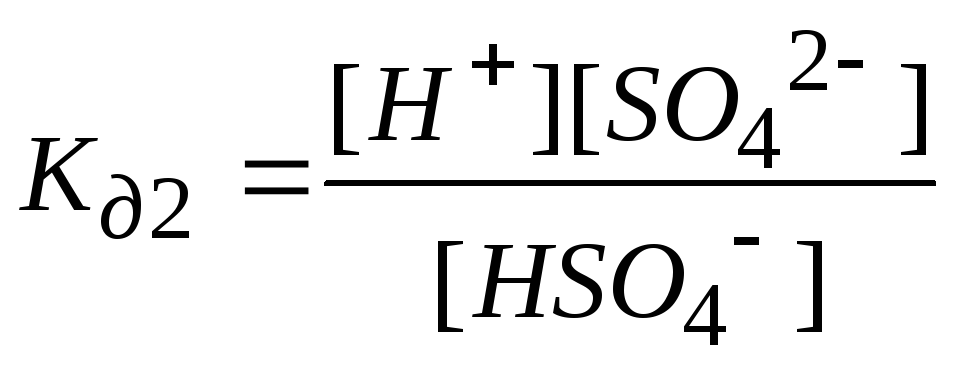
3. Диссоциация амфолитов протекает по основному или кислотному механизму в зависимости от условий.
4. Соли являются сильными электролитами. Их диссоциация необратима; тип связи - ионный.
![]()
Способность к электролитической диссоциации зависит не только от самого электролита, но и от растворителя.
По закону Кулона электростатическое притяжение (F) двух разноименных зарядов (q1 и q2), расстояние между которыми r:
![]()
– диэлектрическая проницаемость среды, то есть, чем больше диэлектрическая проницаемость среды, тем слабее взаимодействуют между собой частицы, тем вероятнее произойдет ионизация молекул. Поэтому растворители с высокой диэлектрической проницаемостью обладают сильной ионизирующей способностью. Большая диэлектрическая проницаемость воды не является единственной причиной ее высокого ионизирующего действия. Дипольный характер молекул воды, обладающих неподеленными электронными парами, обусловливает ее значительную способность к образованию гидратированных ионов за счет донорно-акцепторного взаимодействия, а выделяющаяся при этом энергия гидратации ионов компенсирует энергию, необходимую для преодоления сил электростатического притяжения ионов в кристаллической решетке вещества. В растворителях с малой диэлектрической проницаемостью ионы продолжают достаточно сильно притягиваться друг к другу, оставаясь в виде ионных пар.
