
- •Электрохимия.
- •Растворы электролитов.
- •Электролитическая диссоциация воды
- •Водородный электрод. Измерение электродных потенциалов. Стандартные электродные потенциалы.
- •2). Предположим, что исследуемый металл неактивен, например медь. Тогда происходит процесс окисления водорода – анодный процесс. Водородный электрод в этом случае будет являться анодом.
- •Равновесные электрохимические системы.
- •Окислительно-восстановительные реакции.
- •Электролиз
Водородный электрод. Измерение электродных потенциалов. Стандартные электродные потенциалы.
Абсолютное значение электродных потенциалов измерить невозможно, поэтому измеряют ЭДС цепи, состоящей из исследуемого электрода и электрода сравнения.
Для водных растворов в качестве стандартного электрода сравнения обычно используют водородный электрод, потенциал которого при давлении водорода 0,101 МПа и термодинамической активности ионов водорода в растворе, равной единице, принимают условно равным нулю.
Водородный электрод представляет собой платиновую пластину, покрытую платиновой чернью. Пластинка опущена в раствор серной кислоты с концентрацией 1 моль/л и омывается струей газообразного водорода (рис. 29).
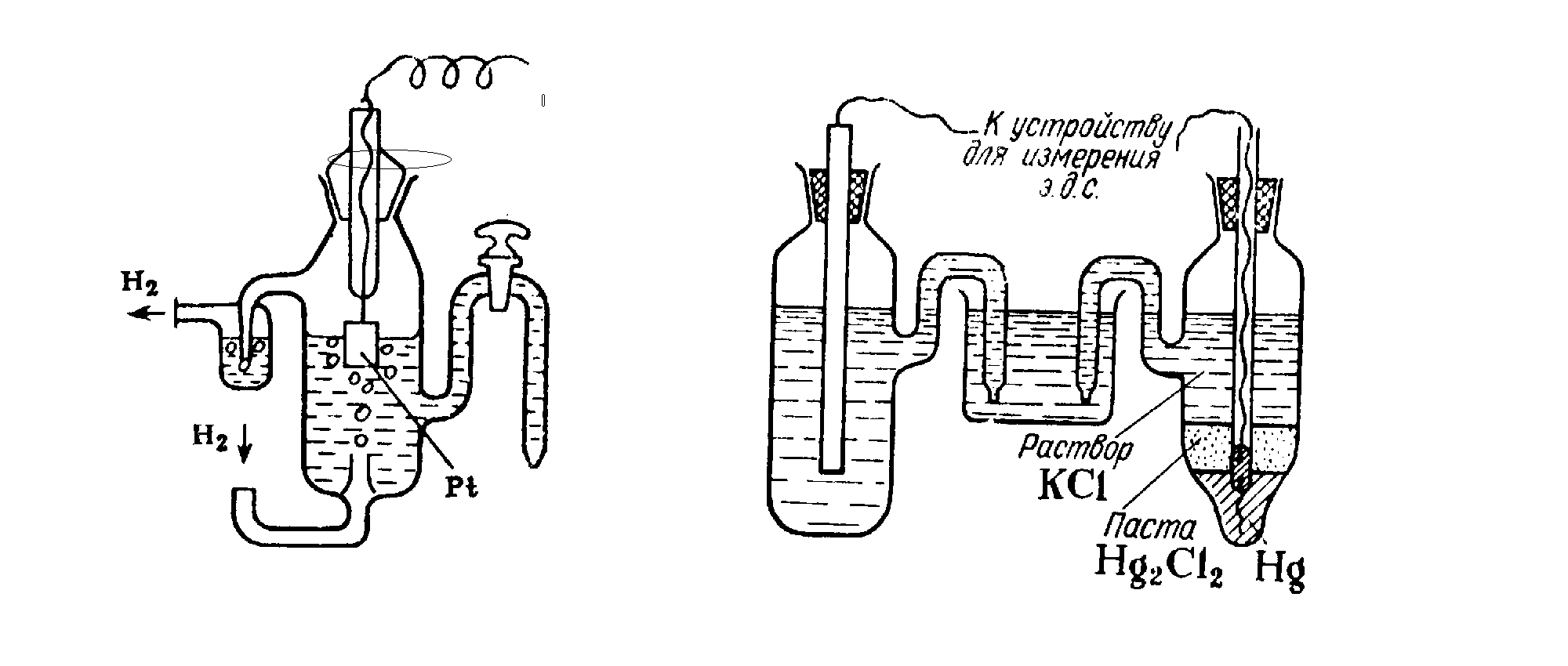
Рис. 29. Устройство водородного электрода.
При измерении электродных потенциалов возможны два случая. Если металл является активным, например Zn, то происходит процесс окисления металла (анодный процесс)
анодный процесс: Zn – 2e = Zn2+;
Водород в этом случае является катодом.
катодный процесс: 2H + 2e = H2 .
(А) Zn|ZnSO4 ||H2SO4|Pt(H2) (K)
E = EK – EA > 0, если EK = 0 EA < 0, т. е. потенциалы активных металлов имеют отрицательные значения.
2). Предположим, что исследуемый металл неактивен, например медь. Тогда происходит процесс окисления водорода – анодный процесс. Водородный электрод в этом случае будет являться анодом.
(А) Pt(H2)|H2SO4 ||CuSO4 |Cu (K)
анодный процесс: H2 – 2e = 2H+;
катодный процесс: Cu2+ + 2e = Cu0.
E = EK – EА > 0, если EA = 0 EК > 0, т. е. потенциалы неактивных металлов имеют положительные значения.
Таким образом, составляется ряд напряжения металлов. Значения электродных потенциалов относительно водородного потенциала выводятся в таблицу.
Стандартный электродный потенциал – это потенциал данного электродного процесса, измеренный при стандартных условиях, т. е. концентрации ионов, участвующих в реакции составляет 1 моль/л, давление газов – 101325Па, Т = 298 К
Стандартные электродные потенциалы обозначаются так: E[B].
УРАВНЕНИЕ НЕРНСТА.
Значения электродных потенциалов зависят от природы металла, от концентрации веществ, участвующих в процессе и от температуры системы. Эта зависимость выражается уравнением Нернста:
![]()
где: Е – стандартный электродный потенциал;
R –
универсальная газовая постоянная
≈ 8,314![]() ;
;
Т – абсолютная температура;
n – число электронов, участвующих в окислительно-восстановительном процессе.
[Ox] – концентрация ионов в окисленной форме;
[Red] – концентрация ионов в восстановленной форме.
При подстановке
постоянных уравнение принимает вид:
![]() .
.
Для полуреакции окисления металла:
Me° – ne = Men+
Red Ox
![]() .
.
Насколько же концентрация влияет на потенциал? Например, в медно-цинковом электроде, где анодом является цинк:
(А) Zn|ZnSO4|CuSO4|Cu (К) E0 = 0,34 – (–0,76) = 1,1B.
![]() =
+ 0,34B;
=
+ 0,34B;
![]() = – 0,76B;
= – 0,76B;
Пусть [ZnSO4] = 0,1 М; [CuSO4] = 0,01 M, тогда
ЭДС
= ЕK
– EA=![]() 0,34
+0,3∙2 + 0,76 +0,03 =1,07 В.
0,34
+0,3∙2 + 0,76 +0,03 =1,07 В.
ЭЛЕКТРОДНЫЙ ПОТЕНЦИАЛ ВОДОРОДНОГО ЭЛЕКТРОДА.
2H+ + 2e = H2
Ox Red
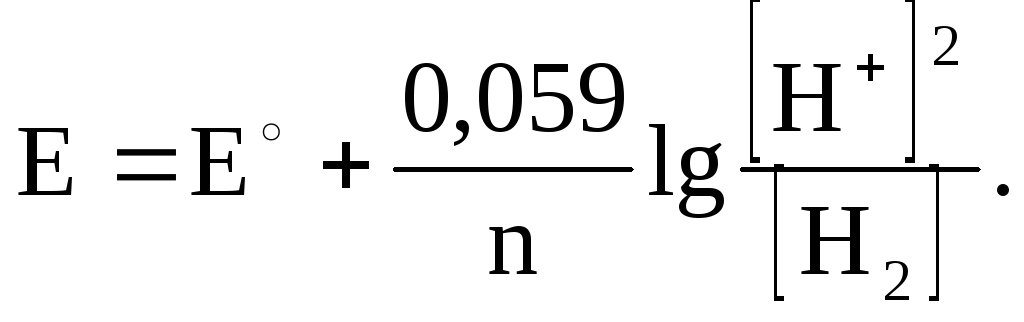 Если мы имеем дело
с газами, то заменяем концентрацию
парциальным давлением (P(H2)
= 1атм.).
Если мы имеем дело
с газами, то заменяем концентрацию
парциальным давлением (P(H2)
= 1атм.).
E = E° + 0,059 lg[H+]; Е° = 0; Е = 0,059 lg[H+] или Е = -0,059рН
В нейтральной среде: [H+] = 10–7; Е = – 0,41В.
КЛАССИФИКАЦИЯ ЭЛЕКТРОХИМИЧЕСКИХ СИСТЕМ.
Электрохимические системы могут быть равновесными и неравновесными. Равновесные - это системы, в которых возникновение электрического тока происходит за счет протекания химических реакций(гальванический элемент).
Неравновесные - в них превращения происходят за счет подвода из вне электрического тока (электролизер).
