
“Обмен углеводов”, часть 2
Челночные механизмы
 Поскольку
ферменты гликолиза локализованы в
цитоплазме, то и НАДН·Н+,
образовавшийся
в ходе глицеральдегид-3-фосфатдегидрогеназной
реакции, находится в цитоплазме. Для
переноса водорода с цитоплазматического
НАДН·Н+
в дыхательную цепь существуют специальные
механизмы, называемые челночными: 1)
малат-аспартатный – дает на выходе 3
молекулы АТФ, и 2) α-глицеролфосфатный
(глицерол-3-фосфатный) – дает на выходе
2 молекулы АТФ.
Поскольку
ферменты гликолиза локализованы в
цитоплазме, то и НАДН·Н+,
образовавшийся
в ходе глицеральдегид-3-фосфатдегидрогеназной
реакции, находится в цитоплазме. Для
переноса водорода с цитоплазматического
НАДН·Н+
в дыхательную цепь существуют специальные
механизмы, называемые челночными: 1)
малат-аспартатный – дает на выходе 3
молекулы АТФ, и 2) α-глицеролфосфатный
(глицерол-3-фосфатный) – дает на выходе
2 молекулы АТФ.
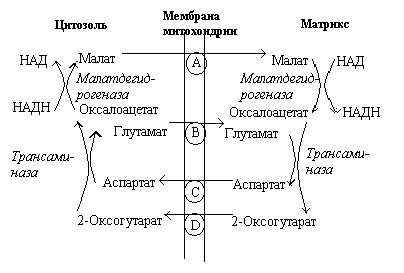
Р ис.
Малат-аспартатный челнок
ис.
Малат-аспартатный челнок
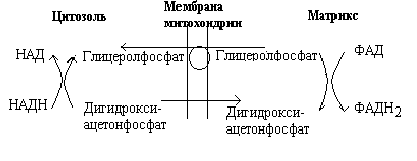
Рис. Глицеролфосфатный челнок
Выход АТФ при аэробном распаде глюкозы
Аэробный распад глюкозы не следует путать с аэробным гликолизом. Аэробный распад глюкозы это процесс полного распада глюкозы до СО2 и Н2О. И в этом процессе аэробный гликолиз представляет собой лишь первый этап:
Глюкоза
Глицеральдегид-3-фосфат
Пируват
Ацетил-КоА
СО2 и Н2О
Поскольку в результате подготовительной стадии гликолиза глюкоза окисляется с образованием 2 молекул глицеральдегид-3-фосфата, начиная с глицеральдегид-3-фосфата вводим коэффициент 2.
При окислении 1 мол. ацетил-КоА до СО2 и Н2О (ЦЛК) образуется 3 молекулы НАДН·Н+, молекула ФАДН2 и молекула ГТФ.
При окислении 1 мол. пирувата до ацетил-КоА образуется 1 мол. НАДН·Н+.
При окислении глицеральдегид-3-фосфата до пирувата образуется 2 молекулы АТФ (путем субстратного фосфорилирования) и молекула НАДН·Н+. Наконец, при окислении глюкозы в глицеральдегид-3-фосфат затрачивается 2 молекулы АТФ.
Итого, 38(40) – 2 = 36(38) молекул АТФ в расчете на 1 молекулу глюкозы.
Аэробный распад глюкозы может происходить во всех органах и тканях. В наибольшей зависимости от аэробного распада глюкозы находится мозг. Он расходует около 100 г глюкозы в сутки. В состоянии основного обмена около 20% всего поступающего в организм кислорода потребляется мозгом (при том, что на долю мозга приходится лишь 2% массы тела). Поэтому как недостаток глюкозы, так и недостаток кислорода проявляют себя прежде всего симптомами со стороны ЦНС – головокружением, потерей сознания, судорогами.
Анаэробный гликолиз
В анаэробных условиях образовавшийся при гликолизе НАДН·Н+ реокисляется не за счет кислорода (который отсутствует), а за счет пирувата, восстанавливающегося в лактат:
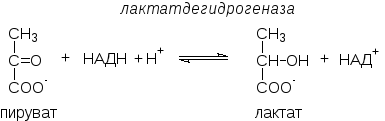
Лактатдегидрогеназа представляет собой тетрамер, содержащий протомеры двух типов - М (muscle) и Н (heart). Известно 5 изоферментов, различающихся набором протомеров.
Изомерные формы ЛДГ1 и ЛДГ2 обнаруживаются в мозге, сердце, корковом веществе почек, т.е. в тканях с интенсивным снабжением кислородом. Форма ЛДГ3 - в поджелудочной железе, ЛДГ4 и ЛДГ5 в скелетных мышцах, печени, мозговом веществе почек, т.е. в тканях с менее интенсивным снабжением кислородом. Все эти формы ферментов значительно различаются максимальной скоростью реакции и константами Михаэлиса для лактата и пирувата. ЛДГ5 быстро катализирует восстановление пирувата в лактат при низких концентрациях лактата. ЛДГ1 катализирует быстрое окисление лактата в пируват в сердечной мышце.
С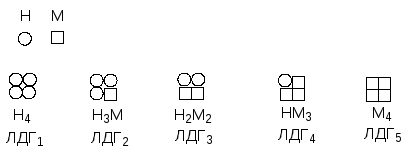 уммарное
уравнение анаэробного гликолиза выглядит
следующим образом:
уммарное
уравнение анаэробного гликолиза выглядит
следующим образом:
Глюкоза + 2 АДФ + 2 H3PO4 = 2 Лактат + 2 АТФ + 2 Н2О
Т.о. десять ферментов, превращающих глюкозу в пируват, совместно с ЛДГ способны обеспечить синтез АТФ в отсутствие кислорода. В анаэробных условиях АТФ образуется только за счет двух реакций субстратного фосфорилирования. В этих реакциях в расчете на 1 моль глюкозы образуется 4 моль АТФ. После вычитания 2 моль АТФ, потребляемых в подготовительной стадии, получаем чистый выход АТФ при гликолизе – 2 моль АТФ на 1 моль глюкозы.
Гликолиз у животных и человека протекает во многих типах клеток, но его значение для разных органов различно. В интенсивно работающих скелетных мышцах аэробный процесс не может обеспечить потребности мышц в энергии. В этих условиях резко усиливается анаэробный путь синтеза АТФ и в мышцах накапливается молочная кислота. Если после ночного сна концентрация лактата в крови составляет 1-2 ммоль/л, то после тяжелой мышечной работы может достигать 20 ммоль/л. Особенно большое значение анаэробный гликолиз имеет при кратковременной интенсивной работе продолжительностью от 30 секунд до 2,5 минут. При более продолжительной интенсивной мышечной работе скорость анаэробного гликолиза довольно быстро уменьшается, а аэробного процесса – возрастает. Через 4-5 минут бега (дистанция 1,5 км) энергия поставляется поровну аэробным и анаэробным процессами, а через 30 минут (10 км) – почти целиком аэробным процессом. В продолжение первой минуты работы благодаря анаэробному процессу достигается гораздо большая мощность, чем при дальнейшей работе. Следует отметить, что при длительной работе в аэробном процессе все в большей мере используется не глюкоза, а жирные кислоты.
Эритроциты вообще не имеют митохондрий, и их потребность в АТФ целиком удовлетворяется за счет анаэробного гликолиза. Интенсивный гликолиз характерен также для клеток злокачественных опухолей.
Глюконеогенез
Образование D-глюкозы из неуглеводных предшественников называется глюконеогенезом. Глюконеогенез протекает в основном в печени и значительно менее интенсивно – в корковом веществе почек и слизистой оболочке кишечника.
Механизм глюконеогенеза
Центральным путем глюконеогенеза является превращение пирувата в глюкозу. Т.о. глюконеогенез можно рассматривать как процесс обратный гликолизу. В гликолизе, однако, имеются три необратимые реакции (гексокиназная, фосфофруктокиназная и пируваткиназная), которые по этой причине не могут использоваться в глюконеогенезе. В обход этих реакций в глюконеогенезе протекают реакции, катализируемые другими ферментами. Эти обходные реакции тоже необратимы, но идут в направлении синтеза глюкозы.
Первый обходной путь – образование фосфоенолпирувата из пирувата в обход пируваткиназной реакции. Катализируется двумя ферментами: пируваткарбоксилазой (Е1) и фосфоенолпируваткарбокикиназой (Е2):
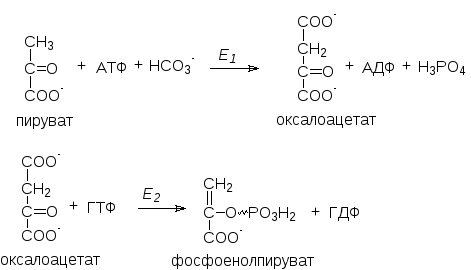
Пируваткарбоксилаза – регуляторный фермент. В отсутствие ацетил-КоА, являющимся для нее положительным регулятором, она практически неактивна. Реакция протекает в митохондриях, куда пируват поступает с помощью пируваттранслоказы. Образовавшийся оксалоацетат не способен проникать через внутреннюю митохондриальную мембрану и поступать в цитоплазму, где протекают остальные реакции (в том числе вторая) глюконеогенеза. Поэтому он обратимо восстанавливается за счет НАДН·Н+ в малат под действием митохондриальной малатдегидрогеназы (МДГ):
Оксалоацетат + НАДН·Н+ ––––––––––→ малат + НАД+
Малат при участии специальной транспортной системы переходит из митохондрий в цитоплазму, где под действием цитоплазматической малатдегидрогеназы окисляется с образованием оксалоацетата:
малат + НАД+ ––––––––––→ оксалоацетат + НАДН·Н+
И, образовавшийся таким образом, оксалоацетат вступает в реакцию глюконеогенеза, катализируемую фосфоенолпируваткарбоксикиназой.
Второй обходной путь связан с образованием фруктозо-6-фосфата из фруктозо-1,6-дифосфата в обход фосфофруктокиназной реакции. Реакция катализируется фруктозо-1,6-дифосфатазой:

Третий обходной путь связан с образованием из глюкозо-6-фосфата свободной глюкозы в обход гексокиназной реакции. Реакция катализируется
глюкозо-6-фосфатазой:
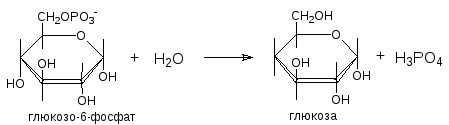
Свободная глюкоза, образующаяся в результате реакции, поступает из печени в кровь.
Суммарное уравнение процесса:
2 пируват + 4 АТФ + 2 ГТФ + 2 НАДН·Н+ + 4 Н2О → глюкоза + 4 АДФ + 2ГДФ + 6 Н3РО4 + 2 НАД+
Неуглеводные источники для глюконеогенеза
условно можно разделить на три группы:
-
вещества, способные превращаться в один из метаболитов гликолиза. Например, глицерин.
-
вещества, способные превращаться в пируват. Например, лактат.
-
вещества, способные превращаться в оксалоацетат. К ним относятся метаболиты ЦЛК.
Однако, главными источниками глюконеогенеза являются аминокислоты, превращающиеся в пируват или оксалоацетат. Аминокислоты, способные превращаться в глюкозу, называются гликогенными. К ним относятся все протеиногенные аминокислоты, кроме лейцина.
Значение глюконеогенеза
-
В организме взрослого человека за сутки может синтезироваться около 80 г глюкозы. Особенно важное значение глюконеогенез играет в обеспечении глюкозой мозга при недостатке углеводов в организме.
-
Возвращение лактата в метаболический фонд углеводов.
Регуляция гликолиза и глюконеогенеза в печени
Каждая из необратимых реакций гликолиза вместе с соответствующей ей необратимой реакцией глюконеогенеза составляет субстратные циклы. Эти циклы служат точками приложения регуляторных механизмов. Переключение печени с гликолиза на глюконеогенез и наоборот происходит при участии инсулина и глюкагона.
Направление реакций первого субстратного цикла регулируется главным образом концентрацией глюкозы. При пищеварении концентрация глюкозы в крови повышается (до10-20 ммоль/л). Активность глюкокиназы в этих условиях максимальна. Кроме того, инсулин индуцирует синтез глюкокиназы и ускоряет тем самым фосфорилирование глюкозы.
Направление реакций второго субстратного цикла зависит от активности фосфофруктокиназы 1 и фруктозо-1,6-дифосфатазы. Активность этих ферментов зависит от концентрации фруктозо-2,6-дифосфата. Фруктозо-2,6-дифосфат образуется путем фосфорилирования фруктозо-6-фосфата при участии фосфофруктокиназы-2 (ФФК-2). ФФК-2 является бифункциональным ферментом, поскольку катализирует не только прямую, но и обратную реакцию (дефосфорилирования). Киназная активность проявляется, когда ФФК-2 находится в дефосфорилированной форме, которая характерна для абсорбтивного периода, когда инсулин-глюкагоновый индекс (ИГИ) высокий. При низком ИГИ, характерном для периода голодания, происходит фосфорилирование ФФК-2 и проявление ее фосфатазной активности, результатом чего является снижение количества фруктозо-2,6-дифосфата.
Фруктозо-2,6-дифосфат аллостерически активирует ФФК-1, фермент гликолиза, и одновременно ингибирует фруктозо-1,6-дифосфатазу, фермент глюконеогенеза. Поэтому при накоплении фруктозо-2,6-дифосфата происходит активация гликолиза и угнетение глюконеогенеза и наоборот, при снижении концентрации фруктозо-2,6-дифосфата происходит угнетение гликолиза и активация глюконеогенеза.
В регуляции третьего субстратного цикла основная роль принадлежит пируваткиназе, фосфорилированная форма которой неактивна, а дефосфорилированная активна.
Взаимосвязь гликолиза в мышцах и глюконеогенеза в печени (цикл Кори)
При выполнении кратковременной интенсивной работы, когда основным процессом, обеспечивающим работающие мышцы энергией, является анаэробный гликолиз, глюкоза, а затем и мышечный гликоген быстро расщепляются с образованием лактата. Лактат не подвергается в мышцах дальнейшим превращениям и диффундирует в кровь. В период восстановления лактат удаляется из крови печенью и превращается в глюкозу путем глюконеогенеза. Глюкоза поступает в кровь и далее в мышцы. Т.о. цикл замыкается. Этот цикл получил название глюкозо-лактатного цикла или цикла Кори.
Р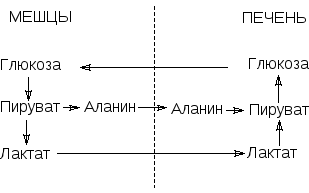 ис.
Цикл Кори и глюкозо-аланиновый цикл
ис.
Цикл Кори и глюкозо-аланиновый цикл
Метаболизм гликогена
Гликоген представляет собой разветвленный полисахарид, мономером которого служит глюкоза. Остатки глюкозы соединены в линейных участках α-1,4-гликозидными связями, а в местах разветвления - α-1,6-гликозидными связями. Молекула гликогена более разветвлена, чем крахмал, точки ветвления встречаются через каждые 8-10 остатков глюкозы.
Гликоген – основной резервный полисахарид в клетках животных. Гликоген плохо растворим в воде и не влияет на осмотическое давление в клетке, поэтому в клетке депонируется гликоген, а не свободная глюкоза.
Гликоген депонируется главным образом в печени и скелетных мышцах, запасаясь в цитозоле клеток в форме гранул. С гранулами связаны и ферменты, участвующие в обмене гликогена. Синтез и распад гликогена протекают разными метаболическими путями.
Гликогенолиз
Мобилизация гликогена происходит в основном в период между приемами пищи и ускоряется во время физической работы.
Этот процесс происходит в результате действия ключевого фермента гликогенолиза гликогенфосфорилазы, которая катализирует реакцию:
(глюкоза)n + Н3РО4 (глюкоза)n-1 + глюкозо-1-фосфат
Реакция практически необратима. Поскольку в результате реакции глюкоза образуется в фосфорилированной форме, данный процесс распада гликогена называется фосфоролитическим. Гликогенфосфорилаза катализирует расщепление только концевых -1,4-гликозидных связей в боковых цепях гликогена. Поскольку участки разветвления гликогена для гликогенфосфорилазы не доступны (она не действует на -1,6-гликозидные связи), на полисахарид в этом случае действует другой фермент – -1,6-гликозидаза, катализируя гидролитическое расщепление -1,6-связи в точке ветвления с образованием одной молекулы D-глюкозы и открывая для действия гликогенфосфорилазы новый участок цепи гликогена.
Образовавшийся под действием гликогенфосфорилазы глюкозо-1-фосфат превращается в глюкозо-6-фосфат (метаболит гликолиза) под действием фермента фосфоглюкомутазы.
Распад гликогена в печени и мышцах имеет одну различающую их реакцию, обусловленную наличием в печени фермента глюкозо-6-фосфатазы. Присутствие в печени этого фермента обусловливает главную функцию гликогена печени – освобождение глюкозы в кровь в период между приемами пищи. Т.о. мобилизация гликогена печени обеспечивает поддержание уровня глюкозы в крови на постоянном уровне. Через 10-18 ч после приема пищи запасы гликогена в печени значительно истощаются, а голодание в течение 24 ч приводит к полному его исчезновению.
Функция мышечного гликогена заключается в высвобождении глюкозо-6-фосфата, используемого в самой мышце для окисления и получения энергии.
