
Тепломеханика
.pdfМинистерство образования и науки Российской Федерации Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования
«Кузбасский государственный технический университет им. Т. Ф. Горбачева»
Кафедра стационарных и транспортных машин
ПАРАМЕТРЫ И ФУНКЦИИ СОСТОЯНИЯ РАБОЧЕГО ТЕЛА. ПРИБОРЫ ДЛЯ ИЗМЕРЕНИЯ ПАРАМЕТРОВ СОСТОЯНИЯ.
ФУНКЦИИ ПРОЦЕССА
Методические указания к лабораторной работе по дисциплине «Источники и системы теплоснабжения промышленных предприятий» для студентов специальности 140104, по дисциплине «Теплотехника» для студентов специальности 190601, по дисциплине «Теплоснабжение и тепловое хозяйство горного предприятия» для студентов специальности 150402
Составитель В. В. Назаревич
Утверждено на заседании кафедры Протокол № 24 от 29.04.2011
Рекомендовано к печати учебно-методической комиссией специальности 140104
Протокол № 26 от 28.06.2011
Электронная копия хранится в библиотеке КузГТУ
Кемерово 2011

1
1. ЦЕЛЬ РАБОТЫ
Уяснить смысл основных параметров, функций состояния и функций процесса рабочего тела. Изучить типы и конструкции приборов, применяемых в теплотехнике для измерения температуры, давления и плотности рабочего тела.
2. ТЕОРЕТИЧЕСКИЕ ПОЛОЖЕНИЯ
Взаимные преобразования тепла и механической работы в тепловых машинах происходят при помощи рабочих тел. Рабочее тело может быть по своему агрегатному состоянию твердым, жидким и газообразным. В тепловых машинах наибольшее распространение в качестве рабочего тела получили пар и газ.
Состояние рабочего тела характеризуется параметрами и функциями состояния.
3. ПАРАМЕТРЫ СОСТОЯНИЯ
3.1. Общие сведения
Состояние рабочего тела характеризуется основными термодинамическими параметрами: удельным объемом , абсолютными температурой Т и давлением Pàáñ .
3.2. Удельный объем Удельный объем – это объем единицы массы вещества.
Если объем тела обозначить через V , м3, а массу через M , кг, то удельный объем будет равен:
MV , м3/кг.
Величина, обратная удельному объему, т.е. масса единицы объема вещества, называется плотностью :
MV , кг/м3.
Как видно, величины и взаимно-обратные, и поэтому
1.
2
В СИ удельный объем измеряют в кубических метрах на килограмм (м3/кг), а плотность вещества в килограммах на кубический метр (кг/м3). Значения плотности веществ при нормальных физических условиях приведены в справочных таблицах.
3.3. Температура Температура есть мера интенсивности неупорядоченного
теплового движения молекул. Числовая величина температуры однозначно связана с величиной средней кинетической энергии молекул вещества, следовательно, можно записать
T |
2 |
|
|
MW 2 |
, |
|
3K |
|
2 |
|
|||
|
|
|
|
|
||
где T – абсолютная температура; |
MW 2 |
– средняя кинетическая |
||||
|
|
2 |
||||
|
|
|
|
|
|
|
энергия поступательного движения молекул; К – константа Больцмана, равная 1,3805·10–23 Дж/(моль·К).
Практически невозможно непосредственно измерить кинетическую энергию молекул вещества, поэтому для измерения температуры используют различные косвенные методы, основанные на изменении каких-либо физических свойств вещества в связи с колебанием температуры: расширение тел от нагревания в жидкостных или изменение давления при постоянном объеме в газовых термометрах; изменение электрического сопротивления проводника при нагревании в термометрах сопротивления; изменение электродвижущей силы в цепи термопары при нагревании или охлаждении ее спая. В оптических приборах используют свойство тел излучать тепловые и световые лучи в раскаленном состоянии.
Международной шкалой температур, утвержденной в 1968 г. (МШТ-68), принята термодинамическая шкала (абсолютная) с единицей температуры градус Кельвина. Обозначается в международной системе символом Т, К. Кроме МШТ-68 широко используется Международная практическая шкала (МПШТ-68) с единицей температуры градус Цельсия, обозначается символом t, ºС.
Измерение температур можно производить как в градусах Кельвина, так и в градусах Цельсия в зависимости от принятого начала отсчета (положение нуля по шкале).

3
В так называемой реперной (тройной) точке воды, где равновесно существуют твердая, жидкая и газообразная фазы, температура в градусах Кельвина равна 273,16 К, а в градусах Цель-
сия 0,01 ºС.
Следовательно, между температурами, отсчитанными по указанным двум шкалам, существует соотношение
T = t ºС + 273,15 К.
Измерение температуры может осуществляться различными методами и приборами. Каждый метод имеет свои особенности, определяемые как принципом, так и применяемыми средствами измерений и схемами их подключения.
3.4. Давление
Давление газов Р следует рассматривать как результат уларов молекул о стенки сосуда. Численно давление равно силе, действующей на единицу площади поверхности, воспринимающей удары молекул в направлении по нормали к ней. Согласно мо- леклрно-кинетичской теории газов:
P 2 n mW 2 . 3 2
где – коэффициент сжимаемости, f (T ) ; n – молекулярная плотность, n VN ; N – общее число молекул в теле; V – объем
занимаемый телом.
Выразив кинетическую энергию молекул через температуру
mW 2 3 KT
2 2
и подставив последнее в выражение давления, получим:
P K nT
Откуда видно, что давление P будет тем выше, чем выше абсолютная температура тела T и чем больше молекулярная плотность n.
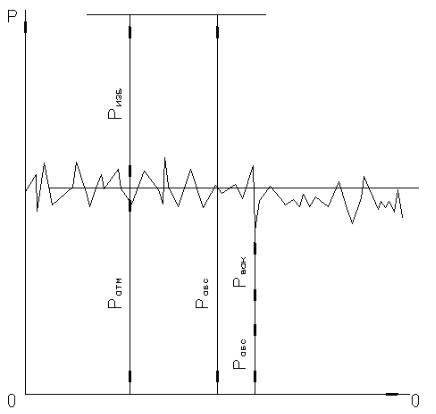
Следует различать (рис. 1):
– атмосферное давление или барометрическое ( Páàð );
– давление, создаваемое окружающей средой (атмосферой);
4
Pизб – избыточное или манометрическое давление, выше атмосферного;
– вакуумметрическое давление, ниже атмосферного.
Из-за непостоянства атмосферного давления последнее нельзя принимать в качестве базисной шкалы отсчета.
Рис. 1. Схема видов давления
Для исключения возможных затруднений для тех или иных расчетов, связанных с определением полного давления, за шкалу отсчета принята линия абсолютного нулевого давления. В этих условиях полное давление в сосуде с учетом атмосферного назвали абсолютным давлением, которое определяется как
Pабс Pатм Pизм .
Знак плюс принимается при избыточном давлении, минус – при вакуумметрическом давлении в сосуде. Как видно, Pàòì не измеряется, а рассчитывается.
Следует помнить, что Pизб и Pвак не являются параметрическими величинами состояния, поскольку они зависят от атмо-
5
сферного давления. Параметром состояния является только абсо-
лютное давление Pабс .
Что касается избыточного давления, то здесь, наоборот, теоретически нет никаких ограничений. В космосе существуют тела, у которых давление достигает миллионы наших атмосфер.
Единицей измерения давления в СИ является паскаль (Па) – это давление, вызываемое силой в 1 Н (ньютон), равномерно рас-
пределяемой по нормали к поверхности площадью в 1 м2. 1 Па = 1 Н/м2.
Исторически сложилось, что для измерения существуют различные внесистемные единицы измерения, которые еще довольно часто встречаются на практике.
Техническая атмосфера
1атм = 735,6·13,6 мм рт. ст. = 104 мм вд. ст. (кгс/м2) =
=10 м вд. ст. = 1,0 кгс/см2 (1 атм) = 104 кгс/м2·9,81 м/с2 =
= 98100 Н/м2 (Па) = 0,981 бар.
Физическая атмосфера
1 Атм = 760·13,6 мм рт. ст = 1,0332 кгс/см2 = 1,0136 бар.
1кгс = 1 даН (деканьютон).
4.ФУНКЦИИ ПРОЦЕССА
4.1. Общие сведения
Кроме разобранных основных трех параметров состояния Ð, Ò и , из которых два определяют непосредственным измерением, существует вторая, более сложная категория величин, дополняющих основные. Это так называемые функции состояния. Особенность функций состояния заключается в том, что их нельзя замерить, они определяются только расчетным путем. К функци-
ям состояния относятся: внутренняя энергия, энтропия, эн-
тальпия и эксэргия.
Изменение функций состояния зависит только от начальных и конечных значений основных параметров состояния. В силу этого их и называют функциями состояния.
6
4.2. Внутренняя энергия
Внутренняя энергия U, согласно МКТ, – это сумма кинетической энергии поступательного и колебательного движений молекул, которая зависит от температуры вещества, потенциальной энергии – энергии взаимосвязи между молекулами и атомами, последняя зависит от удельного объема. Следовательно, всякое изменение внутренней энергии тела (если отсутствуют химические превращения) заключается в изменении энергетических составляющих теплового движения его молекул и удельного объема. Таким образом, внутренняя энергия U, отражая состояние рабочего тела, является однозначной и непрерывной функцией параметров состояния тела:
U U |
2 |
U f |
2 |
(P T ) f (P T ) . |
|||||
|
1 |
2 |
2 |
2 |
1 |
1 |
1 1 |
||
На практике чаще пользуются формулойu c t , Дж/кг,
где c – удельная, средняя изохорная теплоемкость рабочего те-
ла; u – изменение удельной внутренней энергии отнесенной к единице массы вещества.
Втермодинамике обычно находят лишь изменение внутренней энергии в заданном процессе, которое целиком определяется начальным и конечным состоянием рабочего тела и совершенно не зависит от его промежуточных состояний.
ВСИ изменение внутренней энергии U измеряют в джоу-
лях (Дж), а удельную внутреннюю энергию u , отнесенную к 1 кг рабочего тела, – в джоулях на килограмм (Дж/кг).
4.3. Энтальпия
Энтальпия I – это тепловая функция состояния, введенная физиком Гиббсом для облегчения термодинамических расчетов. Измеряется в джоулях на килограмм (Дж/кг).
Физический смысл энтальпии состоит в том, что I представляет собой энергию расширенной системы – рабочего тела и окружающей среды. Представить это можно следующим образом. Пусть в цилиндре 1 под поршнем 2 находится рабочее тело – газ 3, с параметрами U , P , T и V (рис. 2). На поршень давит груз
– 4, массой М. В равновесном энергетическом состоянии рабочее
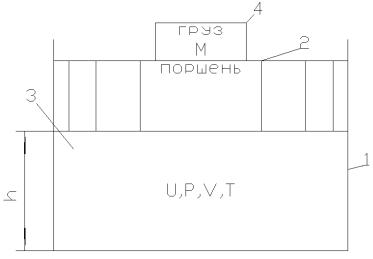
7
тело и груз будут находиться при равенстве энергий: потенциальной энергии груза M g h и внутренней энергии U.
Общая энергия всей рассматриваемой системы (рабочее тело и цилиндр) будет равна сумме:
Eсис U M g h ;
Рис. 2. Расширенная термодинамическая система: рабочий газ – влажная среда
При любом бесконечно малом изменении состояния системы изменение энтальпии равно:
di dq VdP ,
где dq – это количество тепла, полученное системой; VdP – работа внешних сил над системой.
Выразив M g h через параметры состояния газа как M g h PV и учитывая, что согласно определению общая энергия системы Eсис это и есть энтальпия, можно записать:
Из выражения I U PV видно, что в изобарном процессе при P const и VdP 0 количество тепла, участвующего в процессе, равно разности энтальпий в конце и в начале процесса:
q p i2 i1 i сp t , Дж/кг,
где с p – удельная, массовая средняя изобарная теплоемкость ра-
бочего тела.
Последнее положение весьма удобно при проведении термодинамических анализов. На практике обычно требуется знать только изменение энтальпий в процессе, которое полностью
8
определяется начальным и конечным состоянием рабочего тела и не зависит от промежуточных состояний.
4.4. Энтропия Энтропия – это отношение теплоты, участвующей в про-
цессе, к абсолютной температуре рабочего тела.
Теплота q 1 кг любой термодинамической системы с температурой рабочего тела Т, с энергетической точкой зрения возможности получения полезной работы состоит из двух частей: превратимой, которая при данной температуре окружающей сре-
ды способна перейти в работу l , и непревратимой, равной q ТТ0 ,
которая остается в системе:
q l q ТТ0 .
Непревратимая часть тепла системы q ТТ0 , равная произве-
дению тепла на отношение абсолютных температур тел, участвующих в процессе, содержит отношение, называемое энтропией. Понятие энтропии ввел физик Клаузиус:
S Тq .
Можно рассматривать энтропию как тепло, уходящее в окружающую среду в процессе преобразования тепла в работу. В адиабатной системе (процесс без теплообмена или с идеальной теплоизоляцией) dS 0 .
Чем ниже температура Т рабочего тела, тем больше энтропия и тем меньшая часть тепла системы может быть превращена в работу. Поскольку в реальных необратимых процессах в результате теплообмена температура рабочего тела падает, энтропия растет, следовательно, энтропия системы является показателем необратимости процесса и снижения ее работоспособности. В современной науке известны процессы, протекающие с уменьшением энтропии, например во вселенной «черные дыры». Изменение энтропии в процессе можно определить через начальные и конечные параметры тела:
9
S S S |
2 |
с ln |
Т1 |
R ln |
V1 |
с ln |
Т2 |
R ln |
V2 |
. |
|
|
|
|
|||||||
1 |
|
Т2 |
V2 |
|
Т1 |
|
V1 |
|||
|
|
|
|
|
||||||
И через теплоту процесса
dS |
dq |
2 |
|
; S1 S2 dq / Т . |
|||
Т |
|||
|
1 |
||
|
|
Поскольку рост энтропии указывает на наличие потерь полезной работы, следовательно, энтропийный метод анализа позволяет оценить достоинства, выявить недостатки тепловой машины по преобразованию тепла в работу и наметить пути совершенствования процессов преобразования.
4.5. Эксергия Эксергия å – это максимальная работа, которую может со-
вершить рабочее тело в данных условиях, пока его параметры не выровняются с параметрами окружающей среды. Это превратимая в работу часть общего тепла системы, участвующего в процессе:
е lmax q Т0 (S1 S0 ) (i1 i0 ) Т0 (S1 S0 ) ,
где i0 , S0 – энтальпия и энтропия рабочего тела в состоянии равновесия с окружающей средой; Т0 – абсолютная температура окружающей среды; i1, S1 – энтропия и энтальпия рабочего тела на момент начала процесса; q – тепло системы.
Выражение Т0 (S1 S0 ) характеризует потери полезной ра-
боты в результате необратимости процесса. Это та часть из общего количества тепла, участвующего в процессе, которая в данных условиях не может превратиться в работу. Оставаясь в системе, это тепло при соответствующих условиях может быть преобразовано в работу. Иногда эти потери полезной работы называют анергией. Из определения эксергии видно, что если энтропия системы увеличивается, то ее максимальная полезная работа уменьшается.
Эксергия как функция состояния весьма удобна для определения термодинамического совершенства любого теплового аппарата или его отдельных частей. Эксергетический или термодинамический анализ дает более правильное представление об эффективности работы исследуемой тепловой машины.
